热分析法研究硝酸羟铵水溶液的分解
申连华,项 锴,鲍世国,蒋榕培,孙海云,方 涛
(北京航天试验技术研究所 航天绿色推进剂研究与应用北京市重点实验室,北京 100074)
0 引言
单组元推进系统由于具有结构简单、可靠性高、容易控制等特点而广泛应用于卫星、运载火箭和货运飞船等航天器的姿控动力系统和高性能战斗机的应急动力装置。目前,世界各国航天器单组元动力系统上使用的推进剂以肼类推进剂为主。肼类推进剂有剧毒, 且易燃易爆,不但严重污染环境,而且危害操作人员生命健康和航天发射的安全。发展无毒单组元液体推进技术替代有毒的肼类推进技术,实现航天器的无毒化是世界各国的必然选择[1-2]。与传统的肼类推进剂相比,硝酸羟铵(HAN)基推进剂具有高比冲、高密度、低冰点以及无毒无污染的特点,这使其成为世界航天领域最为关注、研究最为活跃的单组元无毒推进剂[3-4]。HAN基单组元推进剂作为未来替代肼的无毒绿色推进剂,对其研究始终都是世界各国学者关注的焦点。
催化分解是液体单组元推进系统实现动力转换的主要方式,液体推进剂通过与催化剂作用,能够在极短的时间内发生分解燃烧,生成大量燃气从喷管高速排出而产生推力[5]。HAN作为硝酸羟铵基单组元推进剂的主要成分,其分解过程和分解机理等特性对硝酸羟铵推进剂的性能具有重要影响。对HAN分解过程的研究,有助于获得HAN分解的机理,分解机理决定了硝酸羟铵基推进剂配方组成的合理性,这对推进剂的配方设计起到指导性作用,也对推力器的启动和产生稳定推力起着至关重要的作用[6-9]。
目前,国外学者对HAN分解进行了多方面的研究,并取得了一定的成果。韩国先进科技学院Chang Hwan Hwang等[10]在室压氮气氛围下,利用DSC对HAN-水-甲醇体系进行了研究,获得了水、甲醇、HAN和催化剂之间的作用机理。Amariei等[11]研究了铂作为催化剂对HAN水溶液的分解研究,通过拉曼光谱测试HAN水溶液分解产物的种类和浓度,对不同温度下Pt催化剂的催化能力进行评估。COURTHÉOUX等[12]研究了硅掺杂氧化铝气凝胶和干凝胶载体负载催化剂对79%HAN基推进剂的催化分解性能。研究结果表明,气凝胶具有更好的热稳定性(耐温达到1 200 ℃),且活性金属分散更加均匀。干凝胶的催化分解性能更优,分解温度低于40℃,点火延迟期小于1 s。Chambreau等[13]利用可调真空紫外电离气溶胶飞行时间质谱仪(VUV-TOF-PIAMS)研究HAN气溶胶在受热的Cu和Ir催化剂上的反应活性,利用荷质比和电离能的差异鉴别分解产物。研究结果表明,分解产物为NH3,H2O,NO,HA(Hydroxyl Amine),HNO3和高温下出现的一小部分NO2。而国内对HAN分解机理等研究文献相对较少。
本文利用TG-DSC热分析技术并结合红外和在线质谱对HAN水溶液的催化分解和热分解进行研究,对其热分解动力性进行了研究,获得了气体产物的动态分布面, 提出了其可能的分解机理。
1 实验
1.1 实验试剂
实验所用的HAN水溶液采用复分解法制备[14-15],经浓缩后含量达到73%;实验所用的催化剂为铱负载型氧化铝催化剂,外观为颗粒状,平均粒径20~30目,铱含量为30%。
1.2 实验设备及条件
综合热分析仪:北京恒久科学仪器厂,DTA-TGA-DSC联用仪。
采用三氧化二铝坩埚;样品量:小于10 mg;载气:高纯氩气;吹扫气流量:50 mL/min;温度范围:25~400 ℃;样品升温速率分别为2.5、5、10 K/min。
质谱仪:英国海德Hiden HPR20在线质谱分析仪,质谱范围:1~90 amu;质量分辨率≤0.2 amu,连接管温度150 ℃,接口温度150 ℃。
红外光谱仪:日本岛津的FTIR-8300傅里叶红外光谱仪。傅里叶红外光谱仪:气体池,温度150 ℃,波数精度:0.05 cm-1。
操作过程:首先在氧化铝坩埚中加入铱基催化剂,然后用注射器加入一定量的硝酸羟铵水溶液,放入热分析仪器中,并利用在线质谱和红外检测其分解产物。其中将不加催化剂的热分解样品作为对照。
2 结果讨论
2.1 HAN水溶液的分解过程研究
在高纯氩气氛围下,升温速率为5 K/min下,测试研究了HAN水溶液的催化分解和热分解的性能,得到的TG曲线如图1所示,DSC曲线如图2所示。

图1 HAN水溶液的TG曲线Fig.1 The TG curve of the HAN aqueous solution
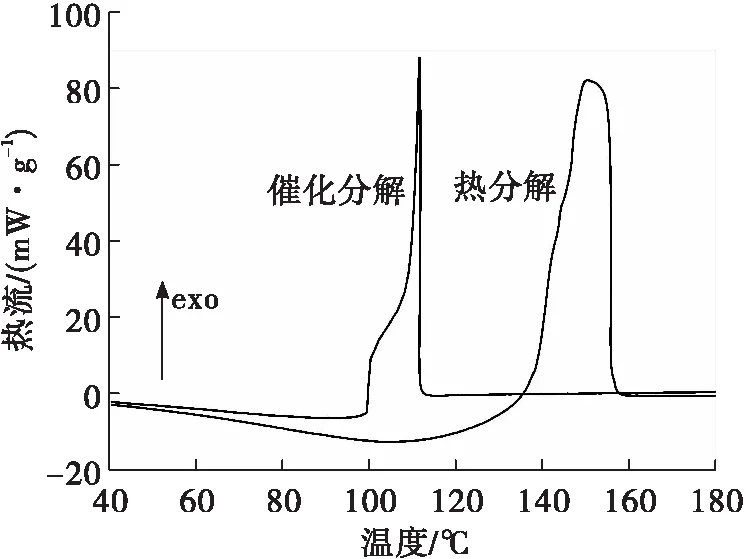
图2 HAN水溶液的DSC曲线Fig.2 The DSC curve of the HAN aqueous solution
由图1中TG曲线可以看出,HAN水溶液的催化分解过程包括如下两个阶段:第一阶段温度范围是50~106.9 ℃,为缓慢失重阶段,对应于水分的挥发;第二阶段为急剧失重阶段,温度范围是106.9~111.8 ℃,对应于HAN的催化分解,催化分解的结束温度为111.8 ℃。HAN水溶液热分解曲线也包括两个阶段,从30~140.5℃,为缓慢失重阶段,对应于水分的挥发,从140.5~156.2 ℃对应于HAN的热分解,热分解的结束温度为156.2 ℃。可以看出,催化分解的结束温度要比热分解的结束温度提前了44.4 ℃。
由图2中DSC曲线可以看出,HAN水溶液的催化分解和热分解的曲线均在100 ℃左右有小的吸热峰,对应于HAN水溶液中水分的挥发。同时两曲线分别在109.8 ℃和155.6 ℃都存在一个明显放热峰,分别对应于HAN的催化分解和热分解,可以看出,HAN水溶液的催化分解放热峰比HAN水溶液的热分解峰提前45.8 ℃,这是由于催化剂的存在降低了HAN的活化能,使HAN分解更容易进行,所以使HAN水溶液的分解放热峰提前。对两个曲线放热峰进行积分,得出催化分解和热分解的放热量分别为1 150.3 J/g和894.2 J/g。HAN催化分解的放热量要明显高于热分解,可能原因是催化剂的加入能使HAN的分解更加完全,从而使催化分解的放热量增加。
2.2 HAN水溶液分解的动力学研究
利用非等温DSC可以测得不同升温(2.5、5、10 K/min)下HAN水溶液的反应放热峰,通过Kissinger法和Fly-Wall-Ozawa法对HAN水溶液分解曲线进行处理,可得热分解和催化分解公式为
式中:β为升温速率,K/min;Tp为HAN水溶液分解放热峰,K ;E为分解反应活化能,J/mol;A为指前因子,s-1;R为气体常数,8.314J/(mol·K)。图3为不同升温速率下的HAN水溶液的催化分解和热分解曲线。
由图3可以看出,随着升温速率增加,HAN水溶液的分解放热峰有向高温方向移动的趋势,这是因为当升温速率较小时,HAN分解释放的热量跟得上温度的变化,表现在较低的温度下就开始分解放热;当升温速率增加时,反应释放的热量跟不上温度的变化,表现为HAN分解的放热峰后移。对不同升温速率下的HAN水溶液分解的DSC曲线进行处理,得到的放热峰温值数据如表1所示。可以看出在相同升温速率下,催化分解的放热量也要明显高于热分解,而在不同升温速率下的HAN水溶液的总的放热量基本上差别不大。根据表1峰温和Kissinger、Ozawa方程,利用最小二乘法分别以ln(β/Tp2)~1 000/Tp作图和以lgβ~1 000/Tp作图得到曲线如图4和图5所示。
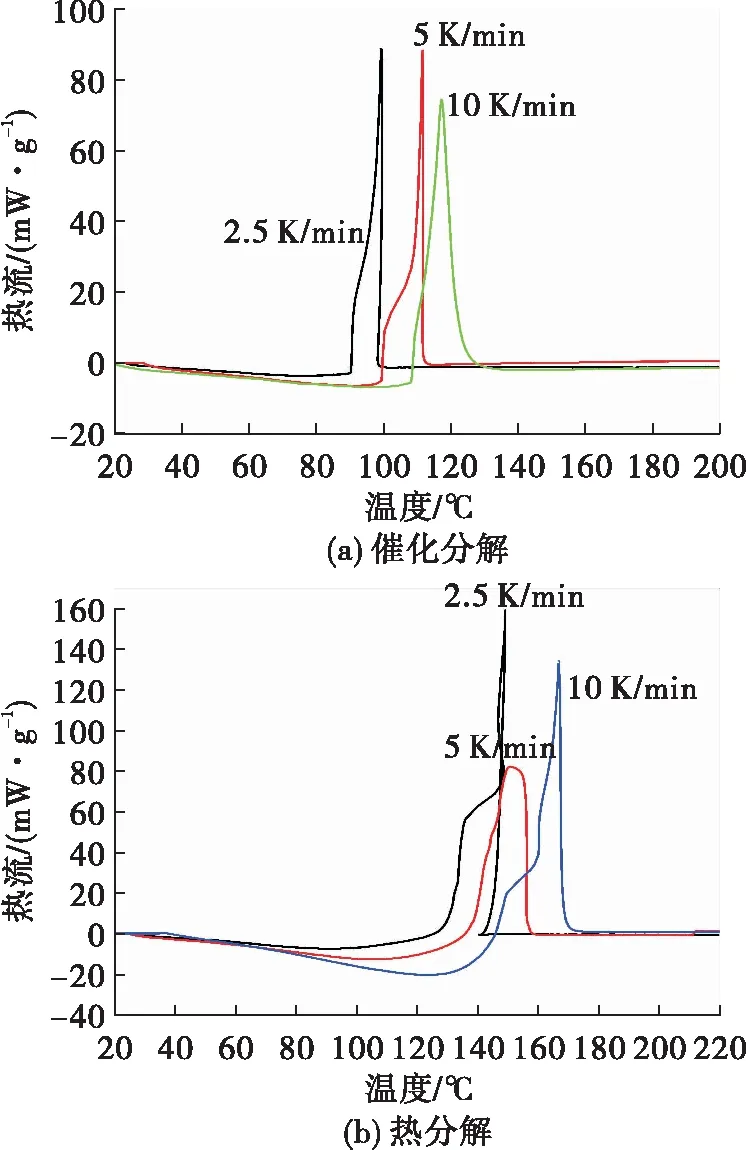
图3 不同升温速率下HAN水溶液的分解曲线Fig.3 DSC curves of HAN aqueous solution at different heating rates
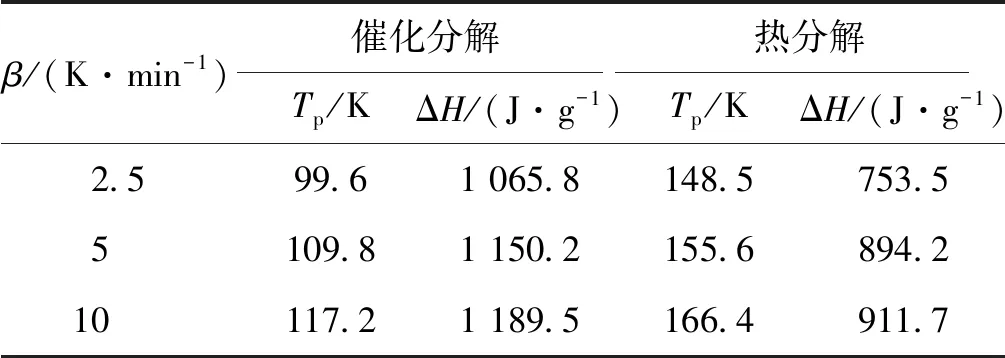
表1 不同升温速率下HAN水溶液的分解放热峰温度
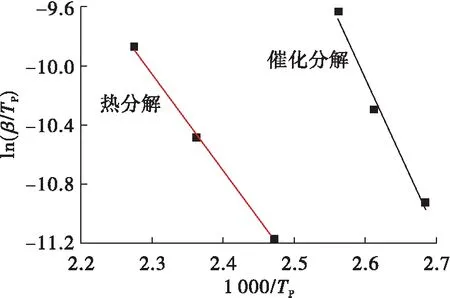
图4 ln(β/Tp2)~1 000/Tp关系曲线Fig.4 The curve of ln(β/Tp2)~1 000/Tp
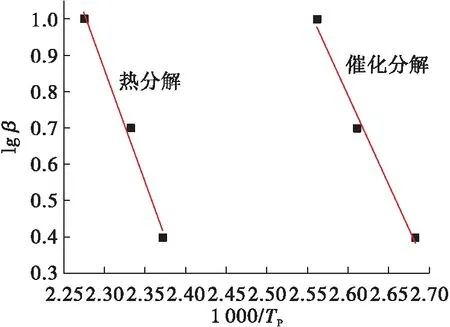
图5 lg β~1 000/Tp关系曲线Fig.5 The curve of lg β~1 000/Tp
由图4和图5可以看出,通过拟合得到的 ln(β/Tp2)~1 000/Tp呈良好的线性关系,相关系数r达到了0.998 9;通过拟合得到lgβ~1 000/Tp呈良好线性关系,相关系数r达到了0.997 9。利用拟合得到直线斜率计算出HAN水溶液的分解的活化能如表2所示。
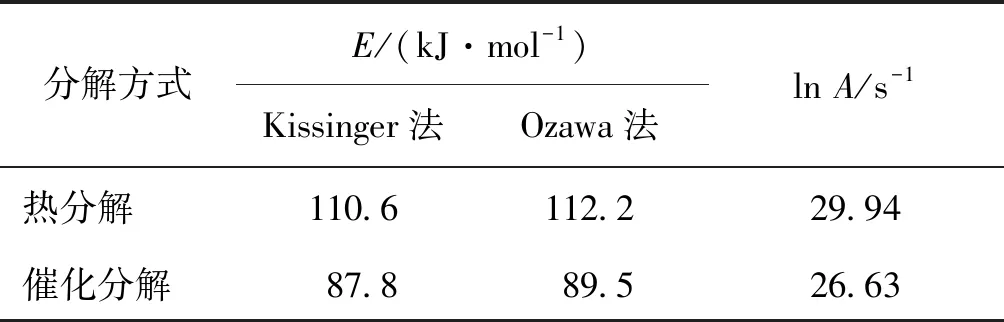
表2 HAN水溶液的分解活化能数据
可以看出,利用Kissinger和Ozawa法计算得出活化能基本一致,同时可以看出,HAN水溶液热分解的活化能要明显低于催化分解的活化能,这是由于催化剂的加入降低了HAN水溶液的分解活化能,因此使HAN水溶液的热分解温度提前。
利用不同升温速率下的TG 曲线,获得HAN水溶液的不同转化率ɑ下的热分解动力学参数如表3所示。从表2和表3可以看出,从TG曲线得到的HAN水溶液的分解活化能与利用DSC法计算得到的活化能基本一致。
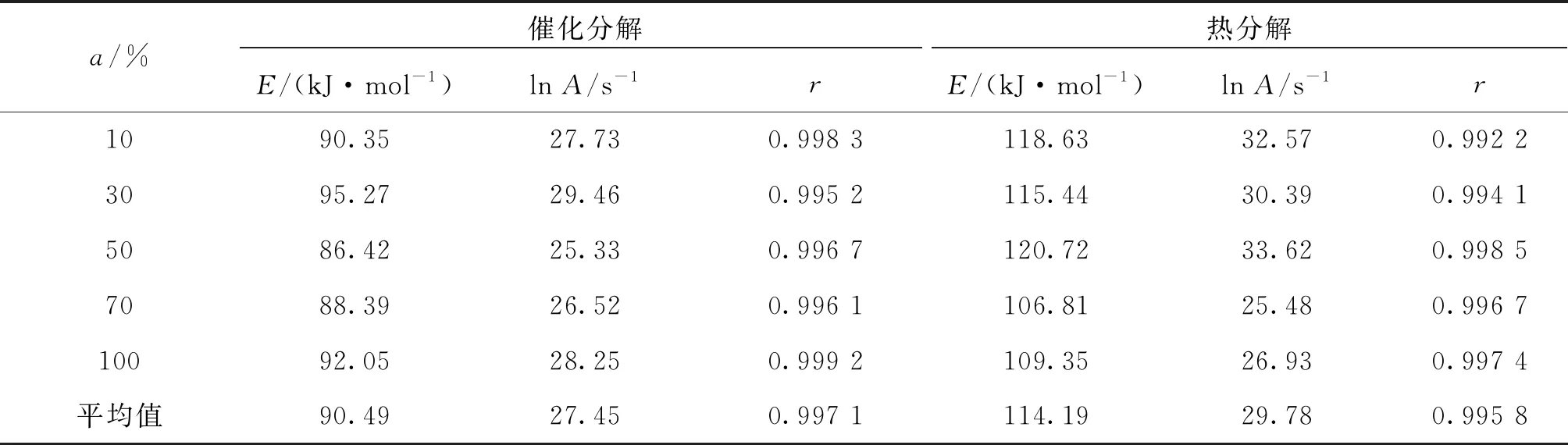
表3 从TG曲线获得不同转化率下HAN水溶液的分解的动力学参数Tab.3 Arrhenius parameters for the thermal decomposition of HAN aqueous solution on TG
2.3 HAN水溶液催化分解产物分析
将HAN水溶液催化分解气体分解产物进行傅里叶红外分析和在线质谱分析,红外图谱如图6 所示,质谱图谱如图7所示。
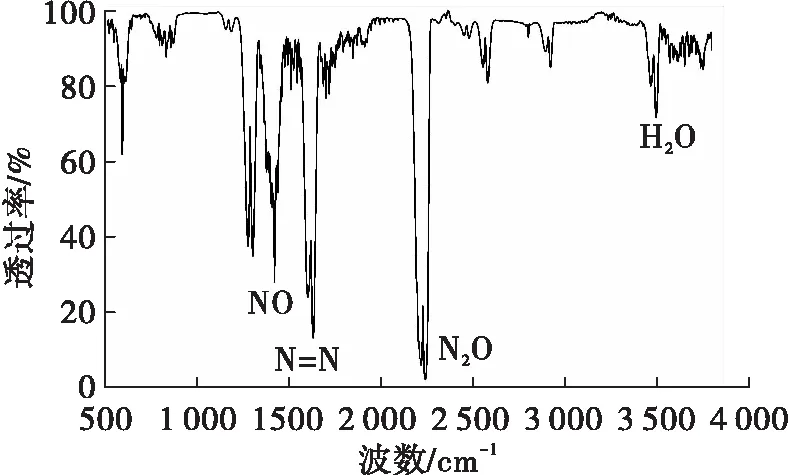
图6 HAN水溶液催化分解产物的红外谱图Fig.6 The infrared specturm of catalytic decomposition products of HAN aqueous solution
从图6红外谱图上可以看出,在红外谱图中2 201 cm-1处,对应的是N2O的特征吸收峰,在1 630 cm-1处,属于N=N的特征吸收峰,在红外谱图中1 306 cm-1处,对应于NO的特征吸收峰[13],在3 580 cm-1处,对应的是H2O的特征吸收峰。
从图7(a)可以看出,纯氩气作为载气时,在质荷比M/Z=40和M/Z=20出现明显峰。在M/Z=40处为其主要原子峰和在M/Z=20时出现其次要峰,两个峰强度之比为6/1;从图7(b)可以看出,氩气作为载气情况下,气体在质荷比为14、20、28、30、40、44处出现明显峰,其中M/Z=40 和M/Z=20处的峰的强度之比为6/1,与纯氩气时峰比例接近,属于载气氩气的峰,其中在质荷比M/Z=14、16、18、28、30、44出现的峰属于HAN水溶液的分解产物及离子碎片,其中主要产物为M/Z=44、30、28的气体产物及离子碎片相对浓度如图 8所示。由图8可知,各峰离子流强度44/30/28之比为9/4/3。
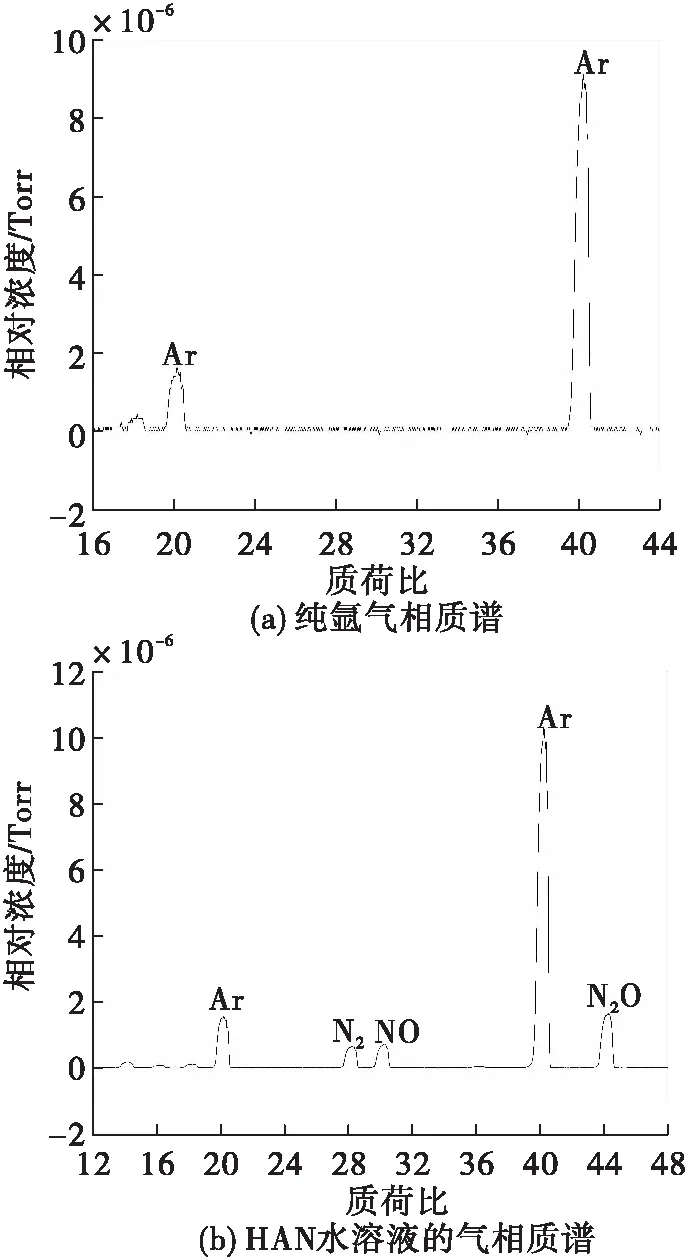
图7 样品的催化分解产物气相质谱Fig.7 The mass spectrometry of catalytic decopmpsotion
质荷比M/Z=44处的峰应仅属于N2O,其主要质谱离子峰为44,而在30、28、16、14属于其次要的离子峰,各峰离子流强度44/30/28/16/14之比为100/31/11/5/13,因此可认为M/Z=30质谱离子峰处由NO和N2O组成,M/Z=28质谱离子峰由 N2和N2O组成,其中M/Z=30属于NO的主要离子峰,在M/Z=14属于次要的离子峰,M/Z=28是N2的主要离子峰。而M/Z=18处应为H2O。因此HAN水溶液主要分解产物为N2O,NO和N2,由于N2没有红外活性所以无法用傅里叶红外检出,这与红外谱图的结果基本一致[16]。

图8 主要气体产物及离子碎片的相对浓度Fig.8 The relative concentration of main gas production and ionic fragments
根据上述热分析及气体产物分析数据并结合文献[17-21],铱负载型催化剂催化HAN水溶液分解可能的机理为
HAN + H2O →NH2OH +HNO3+H2O
(1)
NH2OH+HNO3→HONO+ HNO+H2O
(2)
NH2OH+HONO→N2O +2H2O
(3)
3HONO →2NO +HNO3+H2O
(4)
NH2OH +HNO→ N2+2H2O
(5)
3 结论
利用TG-DSC热分析技术并结合IR,MS等手段对HAN水溶液的分解进行研究,结果如下:
1)采用铱负载型氧化铝催化剂,HAN水溶液的催化分解放热峰是109.8 ℃;不采用催化剂时,HAN水溶液的热分解放热峰为155.6 ℃,催化分解放热峰要比热分解放热峰提前了45.8 ℃;HAN水溶液的分解首先是水分的挥发,然后是HAN的分解。
2)通过利用Kissinger和Ozawa方程得出HAN水溶液热分解和催化分解活化能为110.6 kJ/mol和87.8 kJ/mol, 铱负载型催化剂的加入能明显降低HAN水溶液的分解活化能,使其分解温度明显提前。
3)HAN催化分解的气体产物主要是NO,N2和N2O,并结合文献提出了其可能的催化分解机理。

