二氯苯氧氯酚联合十二烷基苯磺酸钠对蝌蚪生长发育的影响
赵芳娟,王 琦,尚书凤,王杨科
(陕西理工大学 生物科学与工程学院, 陕西 汉中 723000)
如今随着生活的精细化,以及污染物的多元化,人们已经不像过去几十年,只关注在环境中长时间大量存在并有急性毒性或者致癌作用的污染物,具有潜在风险的环境污染物已经引起了人们的关注。
二氯苯氧氯酚[1](triclosan,TCS),广谱抗菌剂,可以杀灭和抑制多种细菌及病毒,同时也能保护有益细菌,广泛应用于香皂、洗衣液、消毒洗手液等个人护理品中。由于应用范围广阔,其对于水体的污染也越来越多地受到重视。最初研究的主要是TCS在环境中的分布及残留风险[2]。近年来在地表水、湖底沉积物、污水和污泥中检测出TCS的报道越来越多,河鱼体内也发现了TCS的积累[3]。甚至是在人类女性的乳汁中也检测出了TCS[4]。在对中国五大水系中TCS污染研究时发现水体中的质量浓度为0.48 μg/L,底泥中的质量浓度为2.7 μg/L[5]。水环境中TCS的含量逐年增加[6]。目前发现水环境中的TCS会对一些敏感的物种产生危害,主要研究方向集中在鱼类,发现TCS对于某些鱼类的生殖和发育有很强的毒性。同时对两栖类也有相关研究,比如董玉瑛等[7]研究发现,二氯苯氧氯酚使蝌蚪体内的过氧化氢酶活性显著升高,马玥等[8]研究认为TCS可通过食品包装、日化用品等,危害人体的健康。
十二烷基苯磺酸钠[9](sodium dodecyl benzene sulfonate,SDBS),是一种阴离子表面活性剂,由于其去污性好,价格低廉,广泛应用于一些洗涤用品中。SDBS排放在水中难以降解,影响水的氧气交换,使水体富氧化速率提升,产生生物毒性。SDBS的产量逐年增加,在环境中分布广泛[10]。地表水中SDBS的含量达到50 μg/L,河床沉积物中也达到1 mg/kg[11]。有研究发现[12],过量的SDBS会造成人体皮肤过敏,还可产生腹泻等现象。陈清香等[13]发现SDBS能影响安氏伪镖水藻的生殖。余坦健等[14]研究表明,SDBS使奥尼罗非鱼的免疫功能得到明显的抑制。叶辽辽等[15]发现当SDBS≥2.5 mg/L时,大鳞副泥鳅受精卵的培育周期及孵化周期延长,同时孵化率降低,鳅苗畸形率升高。
蝌蚪生活范围广阔,易于捕捉,因其特殊的躯体结构、生理特点和生活史特征,对农药等环境污染物的影响极为敏感,是良好的实验材料。因此在生态毒理学研究中,两栖动物常被用作模式生物,相关的研究正成为生态毒理学研究领域的热点[16]。
虽然对于TCS和SDBS的研究较多,但是在环境中,污染物从来都不是单一存在的,目前对于TCS和SDBS的联合实验还没有相关报道。探讨TCS联合SDBS对蝌蚪生长发育的影响,可以为洗涤用品和个人护理品的使用提出相关参考,为治理水体污染及环境保护提供建议,为研制新型洗涤用品和个人护理用品提供依据。
1 实验材料和方法
1.1 实验材料
蝌蚪捕捞于陕西理工大学校园内的天汉湖,经显微镜鉴定为中华蟾蜍(Bufogargarizans),发育时期大体为30期。把蝌蚪分为两批,一批蝌蚪用曝气自来水驯养一周,喂食鸡蛋黄和青菜汁,驯养期间每隔两天进行喂食换水及清理蝌蚪排泄物,用于急性毒性实验[17]。另一批蝌蚪用湖里的水进行饲养,用于后期实验。
显微镜(重庆中显光电仪器有限公司),电子天平(赛多利斯科学仪器北京有限公司),双筒解剖镜(泰克仪器有限公司),SDBS(天津市百世化工有限公司),TCS(山东西亚化学工业有限公司),二甲基亚砜(天津市大茂化学试剂厂),香柏油(人造,中国上海懿洋仪器有限公司),Giemsa染液。
1.2 急性毒性实验
以曝气自来水为溶剂配出具有一定浓度梯度的TCS和SDBS溶液,在装有1000 mL溶液的1 L烧杯中放入大小均匀的8只蝌蚪。每隔两天换掉50%的溶液,保证溶液浓度不变,预实验找出TCS和SDBS对处于30期蝌蚪100%致死极限浓度和零致死极限浓度。100%致死极限浓度分别为0.8 mg/L和700 mg/L以及零致死极限浓度分别为0.25 mg/L和350 mg/L。急性毒性实验按照预实验的实验结果设置浓度组6组,3个平行组。TCS浓度分别为0.30、0.35、0.40、0.45、0.50、0.55 mg/L,SDBS浓度分别为400、450、500、550、600、650 mg/L。实验期间不喂食,实验开始连续观察8 h,然后每12 h观察一次,统计蝌蚪死亡数,使用SPSS计算24、48、72、96 h的半致死浓度。对于评价安全浓度目前主要有以下两种方法:安全浓度(Sc)和最大容许浓度(MPC),评价公式分别为[18]
Sc=0.1×96 hLC50,
MPC=0.01×96 hLC50。
1.3 慢性毒性实验
实验前挑选发育时期均在36期的蝌蚪,测量每一组的体长、体重。采用半静态养殖法,依据蝌蚪急性毒性实验的半致死浓度各设置4个实验组和3个平行组。依据急性毒性实验结果,TCS的浓度间距设置为:0(对照组)、0.06、0.18、0.54 mg/L,SDBS的浓度间距设置为:0(对照组)、60、180、540 mg/L。根据单一毒性实验进行TCS与SDBS的联合毒性实验,其浓度间距设置为:0(对照组)、0.06 mg/L+60 mg/L、0.18 mg/L+180 mg/L、0.54 mg/L+540 mg/L。为短时间内研究两种药物对蝌蚪生长发育的影响,排除其他污染物对实验造成的干扰,实验期间不喂食,实验时间为15 d,每两天换掉50%的溶液,保证溶液浓度不变,及时处理掉蝌蚪排泄物,观察方法同急性毒性实验。
1.4 发育时期观察、体长测量、体重称量
发育时期观察:将蝌蚪置于培养皿中,在双筒解剖镜下用玻璃分针拨动蝌蚪,依据赵尔宓[19]对蝌蚪发育分期的鉴定方法结合蝌蚪的特征,对蝌蚪的发育时期进行鉴定并记录。
体长测量:将鉴定完发育时期的蝌蚪放在滤纸上,用玻璃分针将其身体舒展成一条直线,用分度值为0.5 mm的直尺进行测量并记录。
体重称量:测量完体长的蝌蚪,小心的用玻璃分针拨动在滤纸上滤干水分,将蝌蚪放在已经调好的电子天平上,待读数稳定后进行读数并记录。
1.5 蝌蚪红细胞核异常计数
将称量完体重的蝌蚪放培养皿中,使其腹部朝上放在双筒解剖镜下,小心剖开胸部,找到心脏取血,将血滴加到标有对应浓度标签的载玻片上,以30°角用另一干净的载玻片推动使血液在载玻片上分布均匀,制成血涂片。用吹风机吹干血涂片,在血膜处滴加适量的甲醇溶液固定15 min,吹干。后用Giemsa染液(pH 6.8)染色15 min,水冲洗,吹干。每只蝌蚪做一张血涂片。在本实验中核异常是指蝌蚪红细胞的异常核数和微核数,核异常率=核异常数/观察的总细胞数×100%。
1.6 联合毒性评价
单一毒性和联合毒性完成之后,依据核异常率用SPSS软件进行回归分析计算得到LC50[20]。根据修瑞琴[21]水生毒理联合效应相加指数法计算出AI值。当AI>0为协同作用,AI=0为相加作用,AI<0为拮抗作用。
1.7 数据处理
采用SPSS 20.0软件对实验数据进行统计分析,半致死浓度(LC50)及其95%置信区间的计算采用概率单位法用Regression进行计算分析[22],核异常采用One-Way ANOVA进行方差分析。
2 结果分析
2.1 蝌蚪的急性毒性实验
通过观察发现,正常的蝌蚪游动快速,反应灵活,在烧杯的上中下三部分不停游动,而在染毒液中游动缓慢,反应迟钝,游动至烧杯中部后自然沉在烧杯底部,一段时间后在杯底不动呈现假死,用玻璃分针轻轻拨动蝌蚪有反应。当蝌蚪尾巴弯曲,用玻璃分针轻轻拨动无反应,体表有白色粘液状物体时,则判断为死亡。蝌蚪在TCS和SDBS中刚死亡的状态存在不同之处,TCS溶液中的蝌蚪死亡后尾巴基部弯曲,SDBS溶液中的蝌蚪死亡后尾巴端部弯曲。实验中还发现随着污染物浓度的增加蝌蚪所排出来的粪便量也在增加,通过增设浓度为700 mg/L的SDBS两个组,每组15尾蝌蚪,放入蝌蚪后一组立即喂食,一组不喂食,12 h后发现,不喂食的一组全部死亡,喂食的一组死了1尾。所以可以初步判断蝌蚪通过增加排便来排毒。
随着污染物浓度的增高,蝌蚪的累计死亡数目也随之增加,并且SDBS对蝌蚪的毒性比TCS低的多。同时采用概率单位法用SPSS 20.0软件计算半致死浓度(LC50)及其95%置信区间,及Sc和MPC结果如表1所示。
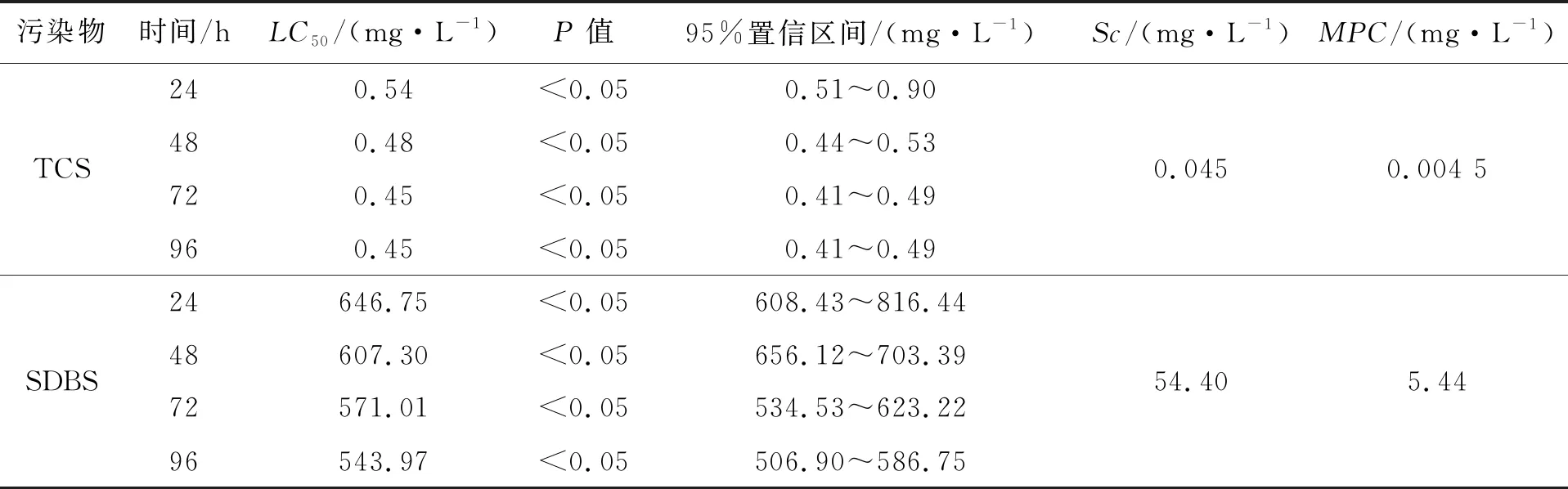
表1 TCS与SDBS对蝌蚪的毒性效应及半致死浓度
2.2 蝌蚪的慢性毒性实验
2.2.1 TCS和SDBS对蝌蚪体重的影响
图1(a)—(c)统计了不同浓度TCS、SDBS、TCS联合SDBS在室温条件下处理15 d后与处理前蝌蚪的体重。经过15 d培养发现,实验组体重较实验前都有明显减轻,联合组体重减少值大于单一组体重减少值。同一染毒组中对照组的蝌蚪体重减小值与低浓度的蝌蚪体重减小值接近,减小值在0.15 g左右,低于中浓度的体重减少值,中浓度的体重减少值最高,高浓度下体重减少值最少。说明蝌蚪体重的减少值随着浓度的增加先升高再降低。
2.2.2 TCS和SDBS对蝌蚪体长的影响
蝌蚪体长的减小情况与体重相似,如图1(d)—(f)所示,最高浓度下的体长减少值最少。低浓度的蝌蚪体长减小值与对照组很相近。联合浓度组低浓度蝌蚪的体长减小值为0.31 cm高于单一低浓度组TCS的减小值0.29 cm和SDBS的减小值0.3 cm。联合组中浓度蝌蚪的体长减小值0.38 cm高于单一中浓度组TCS的减小值0.36 cm和SDBS的减小值0.28 cm。联合组高浓度的体长减少值0.29 cm低于单一高浓度组TCS的减小值0.28 cm和SDBS的减小值0.2 cm。以上结果说明联合组的体重减少值大于单一组体重减少值,且随着浓度的增加蝌蚪体重的减少值先增高再降低。

图1 污染物对蝌蚪体重体长的影响
2.2.3 TCS和SDBS对蝌蚪发育时期的影响
挑选处于36期的蝌蚪进行实验,经过15 d培养后观察发现,对照组中的蝌蚪处于42—43期,43期较多。TCS浓度组中0.06 mg/L的蝌蚪基本处于42期,0.18 mg/L处于41—42期,41期较多,0.54 mg/L基本处于40期。SDBS浓度组中的60 mg/L基本处于42期,180 mg/L基本处于41期,540 mg/L基本处于40期。TCS联合SDBS浓度组中的0.06 mg/L+60 mg/L基本处于42期,0.18 mg/L+180 mg/L基本处于40—41期,0.54 mg/L+540 mg/L处于38—39期,39期较多。通过对比分析,低浓度下TCS与SDBS的蝌蚪发育时期基本一致,联合组中的蝌蚪明显较TCS与SDBS的蝌蚪发育缓慢,随着污染物浓度的升高对蝌蚪发育的抑制作用也逐渐加强。
2.3 TCS和SDBS对蝌蚪红细胞核的影响
2.3.1 微核和异常核的主要类型
用油镜观察发现,在染毒处理以后,蝌蚪的红细胞出现了各种类型的异常核以及微核。正常的成熟红细胞核为椭圆形,位于细胞中央。幼红细胞核为圆形位于细胞中央,经甲醇固定Giemsa染液染色后细胞核呈蓝色,细胞质颜色很浅。微核一般游离在主核周围,体积比主核小很多,颜色比主核浅。异常核主要有双核、核空泡、核缢缩等多种类型(见图2)。

图2 正常红细胞和各类异常核细胞
2.3.2 TCS和SDBS对蝌蚪红细胞核异常率的影响
蝌蚪在不同污染物染毒15 d后,随着污染物浓度的增加,蝌蚪核异常率逐渐提高,并且联合组的核异常率高于单一污染物的核异常率。不同染毒组的蝌蚪红细胞核异常率见表2。经单因素多重比较,与对照组相比,TCS染毒组0.18、0.54 mg/L对蝌蚪核异常率有极显著影响(P<0.01),0.06 mg/L组存在显著差异(P<0.05)。0.06 mg/L与0.18 mg/L组存在显著差异(P<0.05),其余不同浓度对蝌蚪核异常率两两之间存在极显著影响(P<0.01)。
SDBS组中,对照组与180 mg/L组相比存在显著差异(P<0.05),与540 mg/L组相比存在极显著影响(P<0.01)。除了对照与60 mg/L、60 mg/L与180 mg/L组,其余不同浓度对蝌蚪核异常率两两之间多数存在极显著影响(P<0.01),有些存在显著差异(P<0.05)。
不同浓度的TCS联合SDBS对蝌蚪红细胞核异常率两两之间除了对照组和0.06 mg/L+60 mg/L、0.06 mg/L+60 mg/L和0.18 mg/L+180 mg/L外,都存在极显著差异(P<0.01)或显著差异(P<0.05)。
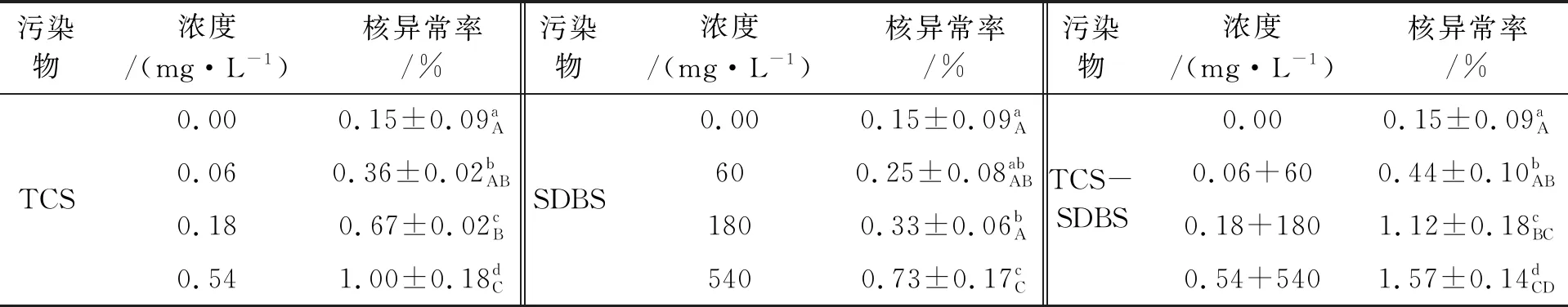
表2 污染物对蝌蚪红细胞核异常率
3 讨论与分析
3.1 TCS和SDBS对蝌蚪的毒性作用
由TCS和SDBS的急性毒性实验可见,高效广谱抗菌剂TCS和阴离子表面活性剂SDBS都对蝌蚪有着明显的毒性作用。TCS对蝌蚪96 h的LC50为0.445 mg/L,SDBS的96 hLC50为543 mg/L, TCS对蝌蚪的毒性比SDBS强1000多倍。造成这种毒性差异可能有多种因素。如Boehmer等[23]发现TCS的亲水性低,亲脂性强,容易融解于细胞的脂肪、脂质中,并且TCS在环境之中较难降解,因此易于在生物体内富集。宋书娟等[24]研究表明TCS会干扰两栖动物的甲状腺功能,进而影响其发育变态。Kristian等[25]认为,SDBS可以使动物细胞膜的通透性增加,从而引起动物死亡。程吕柏等[26]认为SDBS 可以导致蛋白质变性,从而使细胞膜的通透性改变。所以综合来说TCS对动物的毒性是由于TCS的亲脂性和不易降解性导致很容易被吸收和积累,干扰蝌蚪内分泌和新陈代谢从而引起动物死亡。SDBS对动物的毒性主要是SDBS使动物蛋白质降解,细胞膜通透性增加引起死亡。正因为TCS和SDBS不同的毒性作用造成它们对蝌蚪的毒性差异。
根据实验中的数据,我们得到SDBS最大容许浓度为5.44 mg/L,安全浓度为54.40 mg/L。TCS最大容许浓度为0.004 5 mg/L,安全浓度为0.045 mg/L。以期为我国农业灌溉用水等基本控制指标的筛选及定值提供依据。
3.2 TCS和SDBS对蝌蚪发育的影响
实验中污染物对蝌蚪的生长表现出一定的抑制作用,蝌蚪的体重体长和实验前相比都在减少。并且随着污染物浓度的增加,蝌蚪的体重体长减少值先增加后减少,对照组的蝌蚪体重体长减少值与低浓度下的蝌蚪体重体长减少值很接近,高浓度下的体重体长减少值最小。
同时发现蝌蚪在染毒15 d后,对照组中的蝌蚪基本处于42—43期,43期较多,而0.54 mg/L的TCS与540 mg/L的SDBS基本处于40期,0.54 mg/L+540 mg/L的TCS联合SDBS处于38—39期,39期较多。这说明TCS和SDBS都对蝌蚪的发育有着明显的抑制作用,并且联合毒性作用大于单一毒性作用。
众所周知,蝌蚪的生长发育要经历变态,在蝌蚪变态过程中,26—40期处于发育期,主要表现为蝌蚪的生长,体重增加,体长延长;40—46处于变态发育期,其中的42—46处于变态期,变态期的蝌蚪即处于42期的蝌蚪开始前肢伸出,尾巴变短,体重减轻,所以发育处于42期以上的蝌蚪,其体重和体长却小于处于39期以及至41期的蝌蚪。

图3 蝌蚪39期和43期的对比
蝌蚪体重体长减少值随着污染物浓度的增加逐渐增大,但实验中蝌蚪的体重和体长减少值先增加后减少。这是因为是发育时期的影响,随着污染物浓度的增加,蝌蚪的发育时期大致处于43至40—39期,而处于40—39期的蝌蚪体重与体长明显大于43期的蝌蚪。这也就是为什么随着污染物浓度的增加,蝌蚪的体重和体长减少值先增加后减少。如图3所示,39期的蝌蚪体重体长明显大于发育较快处于43期的蝌蚪。
3.3 污染物对蝌蚪红细胞核的影响
细胞受外界影响后形成微核和异常核,可以根据动物红细胞核异常的数量多少来判断生物的受损程度。通常认为,核异常包括异常核以及微核,微核由有丝分裂的细胞在细胞分裂后期细胞内的部分染色体断裂所形成,其裂片或整条染色体没有随着纺缍丝进入子细胞的细胞核中,而是停留在细胞质中,形成单独的一微小核,此小核的体积远小于细胞核,称为微核。微核可进一步分为,染色体断裂剂打断染色体产生的小微核,纺锤体毒剂打断纺锤丝造成的一条或一组染色体滞后形成的大微核[27]。也有人认为微核由核外突形成[28],在本次实验中也观察到核外突、核不均等缢缩现象,所以推测这有可能是蝌蚪微核形成的过程。因此SDBS可能是染色体断裂剂的一种,如形成小微核以及大微核。Giudice等[29]发现在细胞凋亡过程中会激活降解核酸的酶,从而把核酸切成小碎片,而TCS也有这种性质。
本次实验中观察到联合污染物组中的核异常种类多于单一污染物组。因此,TCS可能是使核酸结构出现多种损伤,SDBS可能是使染色体断裂。所以当蝌蚪接触到TCS、SDBS这种有毒物质时,蝌蚪的正常细胞分裂过程将受到影响从而产生异常核、微核。
根据相加指数法算出S值为1.81,代入公式计算出AI的值为0.81>0,所以联合毒性作用为协同作用。
综上所述,TCS和SDBS在高浓度下对蝌蚪有急性致死作用,在低浓度下对蝌蚪也具有潜在的危害,随着浓度的增加直接影响蝌蚪的生长发育。在TCS联合SDBS作用下,由于SDBS可以使动物细胞膜的通透性增加,这就会使得细胞对TCS的吸收量增加,对蝌蚪的毒性作用更加明显,SDBS与TCS表现出协同作用。2006年,杨承信等[11]对LAS的安全评估工作中检测到地表水中的含量低于50 μg/L,密西西比河测出的含量低于28 μg/L,河床沉积物中低于1 mg/kg,地表水和沉积物中的SDBS处于本实验所得出的安全容许溶度5.44 mg/L内。2009年,赵建亮等[5]对中国五大水系中TCS污染进行研究,发现水体中的质量浓度为0.48 μg/L,底泥中的质量浓度为2.7 μg/L,均处于本实验所得出的安全容许溶度4.5 μg/L内。随着我国经济快速发展,人民生活水平提高,TCS和SDBS使用量逐年增加[6,10],大量未经处理的生活污水排入环境中,导致水体环境中TCS和SDBS的含量增加,并且TCS和SDBS对蝌蚪的毒性作用表现出协同效应。因此应加强TCS和SDBS对水产品及农产品质量安全方面影响研究,以及生产污水和生活污水的排放处理方面的风险管理,以便合理科学的使用TCS和SDBS。

