近距离放疗中危及器官吸收剂量相关因素研究
杨 蕾,王有华,庞皓文*
(1.西南医科大学附属医院肿瘤科,四川泸州 646000;2.古蔺县人民医院肿瘤科,四川古蔺 646500)
0 引言
近年来,近距离放疗已经被广泛应用于宫颈癌等疾病治疗中,尤其对于局部晚期宫颈癌患者,近距离放疗结合体外放疗已逐渐成为其标准治疗方式[1-2]。
作者简介:杨 蕾(1989—),女,护师,主要从事近距离放疗方面的研究工作,E-mail:121931011@qq.com。
通信作者:庞皓文,E-mail:haowenpang@foxmail.com制订稳定、高质量放疗计划是现阶段计划制订面临的挑战[3-5]。在外照射中已经有很多方法对危及器官吸收剂量进行预测以保证外照射放疗计划质量[6-7],但在近距离放疗中还未见相关报道。因此应寻找近距离放疗中危及器官吸收剂量相关因素,并建立相应预测公式,对近距离放疗计划进行质控,以生成稳定、高质量放疗计划,减少人为经验对放疗计划质量的影响。本研究以宫颈癌、肺癌接受近距离放疗患者为数据收集组,探索近距离放疗计划中危及器官相关因素与拟合公式,并通过数据验证组对拟合公式进行验证。
1 资料与方法
1.1 数据收集
选取2017—2019 年西南医科大学附属医院肿瘤科宫颈癌接受近距离放疗的患者50 例(分期ⅡB~ⅣA)、周围型肺癌接受近距离放疗的患者27 例(分期ⅠB~ⅣA)作为数据收集组。选取宫颈癌近距离放疗患者与周围型肺癌近距离放疗患者各10 例(分期ⅠB~ⅣA)作为数据验证组。
1.2 靶区及危及器官的勾画
使用LightSpeed Plus 4 CT 机(通用电气公司,美国)对患者实施增强CT 扫描,层厚0.25 cm。CT 扫描完成后,将CT 图像传输到Oncentra 4.3 放疗计划系统(医科达公司,瑞典)进行靶区与危及器官勾画。宫颈癌患者扫描前膀胱内注入100~150 mL 生理盐水以适当充盈膀胱,治疗前进行灌肠以减少乙状结肠和直肠内的气体和粪便。
宫颈癌:根据欧洲放射治疗与肿瘤学会第一工作组(European Society for Radiotherapy and Oncology Working GroupⅠ)推荐方法勾画高危临床靶区(highrisk clinical target volume,HR-CTV),包括近距离治疗时全部的宫颈及有残留的肿瘤;危及器官包括膀胱、直肠、乙状结肠与小肠。
肺癌:勾画影像学可见的肺部原发大体肿瘤区(gross tumor volume,GTV),包括肉眼可见的原发肿瘤区域;危及器官包括肺、心脏、食道、气管、脊髓。
1.3 靶区剂量要求与危及器官限量
宫颈癌:处方剂量为6 Gy/次,共5 次。危及器官限量:联合外照射剂量,膀胱D2cm3[2 Gy 分次放射等效生物剂量(equivalent dose in 2 Gy,EQD2),α/β=3]≤90 Gy,直肠乙状结肠小肠3)≤75 Gy。
肺癌:处方剂量为30 Gy/次,共1 次。危及器官限量:肺
1.4 计划制订与确定
对于宫颈癌患者,将Flectcher 施源器置入患者体内,通过手动优化的方法对放疗计划进行优化。
对于肺癌患者,首先在Oncentra 4.3 放疗计划系统中构建模拟施源器,以确定施源器进入GTV 的路线。模拟施源器进入GTV 的路线要保证以最短距离进入肿瘤组织,并避开肋骨及血管、心脏等危及器官。模拟施源器间距为0.8~1.5 cm,反复调整模拟施源器在共面模板中的位置,最终确定模拟施源器进入GTV 路线。在实施实时近距离放疗时,患者体位、共面引导模板位置及角度与定位时保持一致,在模拟施源器进入人体位置处实施局部麻醉,施源器沿事先确定好的共面引导模板的引导孔方向进入,并确保施源器置入深度与模拟路线深度一致。施源器进入人体过程中患者应避免呼吸,以减少划伤胸膜的可能性。施源器置入完毕后采用固定胶垫对其末端进行固定,防止产生位移。所有施源器置入时间控制在30 min 以内。其中1 例宫颈癌与周围型肺癌近距离放疗患者的CT 图像如图1、2 所示。
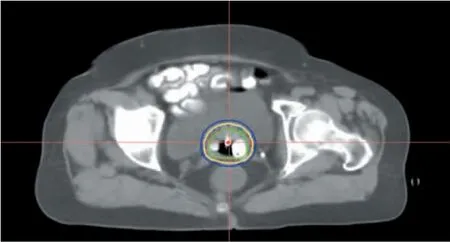
图1 宫颈癌近距离放疗患者的CT 图像

图2 周围型肺癌近距离放疗患者的CT 图像
1.5 计划实施
将近距离放疗计划传送到microSelectron V3 后装机(医科达公司,瑞典),通过192Ir 放射源(mHDR,医科达公司,瑞典)实施放疗。
1.6 相关因素分析
宫颈癌:将患者首次近距离放疗计划纳入分析,对数据收集组患者将HR-CTV 外扩0.5 cm(HRCTV0.)5,对各危及器官的与HRCTV0.5和各危及器官的相交体积(Voverlap0.5-OAR)进行相关性分析,并拟合出相关性公式。
肺癌:对数据收集组患者的肺体积、GTV 体积(VGTV)、GTV 前后方向最大径(d前后)、GTV 左右方向最大径(d左右)、GTV 头脚方向最大径(d头脚)等因素与肺进行相关性分析,并拟合出相关性公式。
1.7 统计学方法
采用SPSS 17.0 软件对数据进行分析,所有相关性分析采用Spearman 相关分析,P<0.05 说明相关性有统计学意义。组间均值差异比较采用成组t 检验。
2 结果
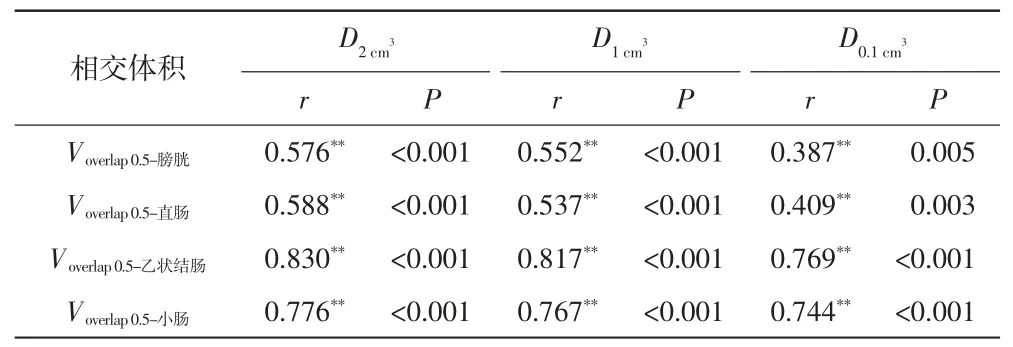
表1 宫颈癌患者危及器官剂量与相交体积之间的相关性

表2 肺癌患者危及器官剂量与体积及最大径之间的相关性
由于危及器官剂量与相关参数呈显著相关性,所以最终选定线性拟合数学模型,建立线性拟合公式。对于宫颈癌,其危及器官吸收剂量拟合公式如下:
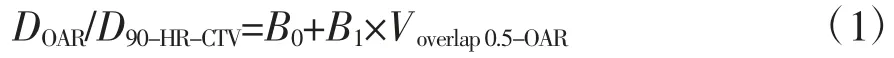
式中,DOAR为危及器官吸收剂量;D90-HR-CTV为90%的HR-CTV 得到的剂量;B0、B1为拟合系数,其值见表3~5。分别为膀胱、直肠、乙状结肠以及小肠2 cm3体积得到的剂量分别为膀胱、直肠、乙状结肠以及小肠1 cm3体积得到的剂量;分别为膀胱、直肠、乙状结肠以及小肠0.1 cm3体积得到的剂量。
表 3 对应的 B0 与 B1 取值
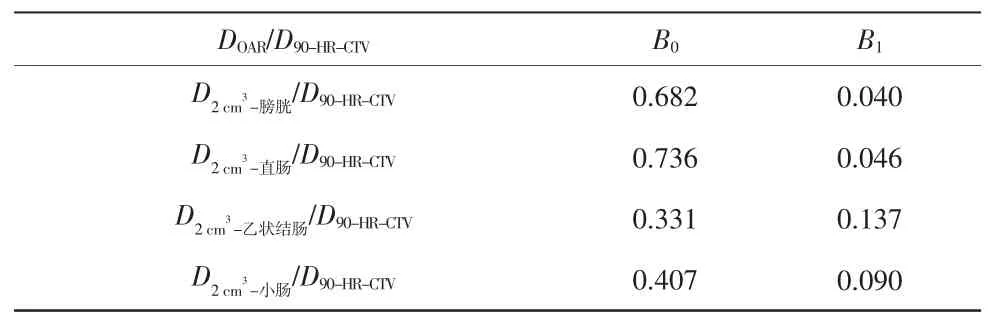
表 3 对应的 B0 与 B1 取值
DOAR/D90-HR-CTV B0 B1 D2 cm3-膀胱/D90-HR-CTV 0.682 0.040 D2 cm3-直肠/D90-HR-CTV 0.736 0.046 D2 cm3-乙状结肠/D90-HR-CTV 0.331 0.137 D2 cm3-小肠/D90-HR-CTV 0.407 0.090
表 4 对应的 B0 与 B1 取值
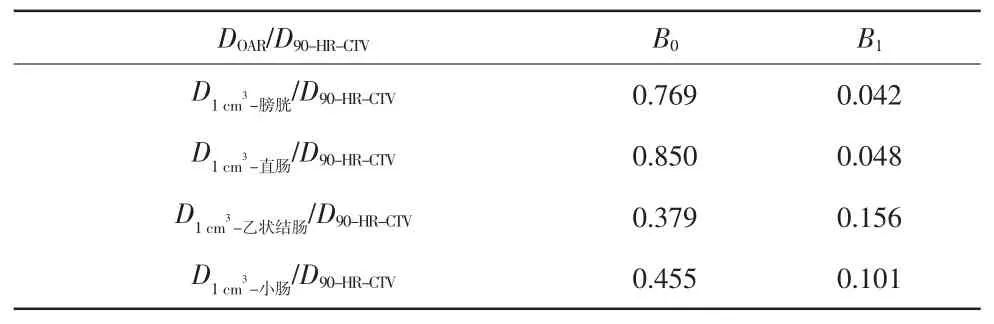
表 4 对应的 B0 与 B1 取值
DOAR/D90-HR-CTV B0 B1 D1 cm3-膀胱/D90-HR-CTV 0.769 0.042 D1 cm3-直肠/D90-HR-CTV 0.850 0.048 D1 cm3-乙状结肠/D90-HR-CTV 0.379 0.156 D1 cm3-小肠/D90-HR-CTV 0.455 0.101
表 5 对应的 B0 与 B1 取值
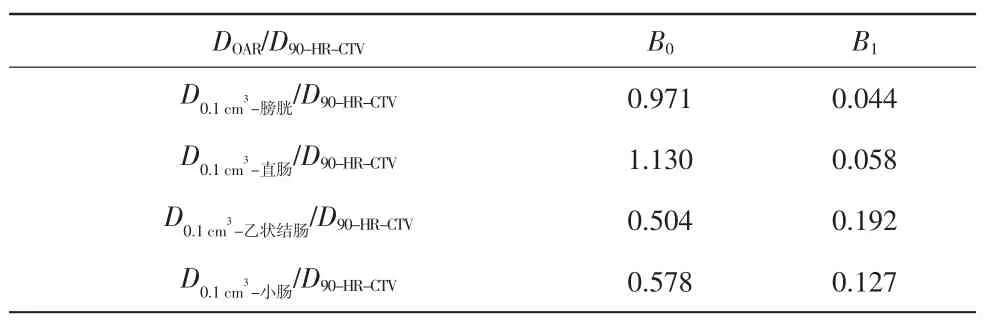
表 5 对应的 B0 与 B1 取值
DOAR/D90-HR-CTV B0 B1 D0.1 cm3-膀胱/D90-HR-CTV 0.971 0.044 D0.1 cm3-直肠/D90-HR-CTV 1.130 0.058 D0.1 cm3-乙状结肠/D90-HR-CTV 0.504 0.192 D0.1 cm3-小肠/D90-HR-CTV 0.578 0.127
对于肺癌,肺的吸收剂量拟合公式见公式(2)、(3):

式中,D90-GTV为90%的GTV 得到的剂量。
对于数据验证组,假设 δ=(Dplan-Dstandard)/Dstandard。对于宫颈癌,Dplan为数据验证组计划所得DOAR/D90-HR-CTV,Dstandard为基于数据收集组数据得到的模型所计算出的对应危及器官的DOAR/D90-HR-CTV。对于肺癌,Dplan为数据验证组计划所得D90-GTV,Dstandard为基于数据收集组数据得到的模型所计算出的δ 值越接近0,Dplan与Dstandard越接近。以宫颈癌数据验证组中 DOAR/D90-HR-CTV为例的δ 值分别为 0.021±0.017、0.036±0.015、0.024±0.010、0.018±0.008。宫颈癌数据验证组与数据收集组所有危及器官DOAR/D90-HR-CTV之间均无统计学差异(P 均>0.05);肺癌数据验证组与数据收集组的也均无统计学差异(P 均>0.05)。
3 讨论
近年来寻找放疗计划危及器官剂量相关因素并对危及器官吸收剂量进行预测是研究的热点,也是全自动优化放疗计划最为核心一环[8-13],但目前大多针对外照射计划进行研究。早前已有学者将外照射调强放疗中OAR 和靶区相交体积与其吸收剂量间关系进行研究,并成功建立拟合公式[14],但还未见相关研究应用于近距离计划中。本研究以宫颈癌与肺癌为例,通过寻求近距离放疗中危及器官剂量相关因素,试图建立危及器官吸收剂量的拟合公式,从数据验证组数据可知取得了良好的效果。拟合公式是通过大量反复优化后的计划数据生成,因此具有较高的参考价值。在实际应用中可通过设置δ 阈值对危及器官剂量进行评价,如危及器官δ 值超过阈值,则需通过反复优化,最终使得危及器官剂量在满足靶区处方评估条件下获得满意的δ 值,减少人为主观因素对计划质量的影响。常规方法是将危及器官分割为多个子器官,较为耗时,但通过脚本程序可实现获得子器官过程全自动化,从而大幅提高效率。
寻找吸收剂量相关因素是一个不断探索的过程,本研究中的相关系数与P 值说明近距离放疗中危及器官吸收剂量确实存在相关因素,或许相关因素并不局限于本研究中所发现的几个因素。本研究不足在于病例数较少,下一步目标是进行多中心研究,收集更多不同病种患者近距离放疗计划数据,并进行验证。拟合公式也并不只局限于线性拟合,样本量足够大时,可采用神经网络等机器学习数学模型,使得拟合值更加精确,最终形成统一标准。

