次氯酸钾氧化去除烟气中单质汞的反应机理
能子礼超,杨 红,海来伍加,刘盛余,何廷宇
(1. 西昌学院 资源与环境学院,四川 西昌 615000;2. 成都信息工程大学 资源环境学院,四川 成都 610225;3. 西昌学院 环境经济科学研究中心,四川 西昌 615000)
汞是致癌、致畸形、致突变的优先控制污染物之一[1],已成为仅次于氮氧化物、硫氧化物以及粉尘的第四大气污染物[2]。而烟气汞排放是大气汞污染的最大来源[3-6],主要以Hg0、Hg2+和颗粒态Hg(Hgp)形式存在[7]。 湿法烟气脱硫(WFGD)设备可去除Hg2+[8],除尘设备可捕获Hgp,而Hg0较难通过现有气体净化技术除去[9-11]。Hg0净化技术的开发是当今大气汞污染治理领域的难题[12]。
烟气脱汞方法分为干法(吸附法)和湿法(氧化吸收法)[13]。活性炭喷射技术是商业化较为成熟的干法烟气脱汞方法[14-15],但活性炭成本高、耗量大、再生难,因此,开发高效廉价的吸附剂成为一个重要方向[16-19]。氧化吸收法主要是添加氧化剂将Hg0氧化成Hg2+,实现汞的高效去除[20]。利用现有WFGD技术实现多污染物联合控制,是最适合中国国情的烟气脱汞方法[21]。
目前,用于氧化脱汞的氧化剂有 KMnO4,K2S2O8,NaClO2,NaClO3,NaClO4,O3等[22-24]。KClO在酸性条件下的KClO/Cl-标准电极电势为1.47 V,而Hg0的氧化标准电极电势为0.85 V[25],因此,KClO在适当的条件下可以氧化去除Hg0。本工作基于KClO氧化去除烟气中Hg0的条件实验,探索KClO氧化去除Hg0的反应机理,以期为实现WFGD同时脱硫脱汞提供参考。
1 实验部分
1.1 实验材料
Hg0:分析纯;N2:纯度99.9%;KClO:分析纯。
1.2 实验装置及方法
实验装置主要包括:汞发生器、混合加热器、反应器、恒温水浴锅等,见图1。用转子流量计控制N2载气流量为0.1 Nm3/h,将汞渗透管(美国VICI Metronics公司)挥发的Hg0带出,混合加热后进入反应器中与KClO溶液反应,Hg0被氧化吸收去除,尾气净化后外排。
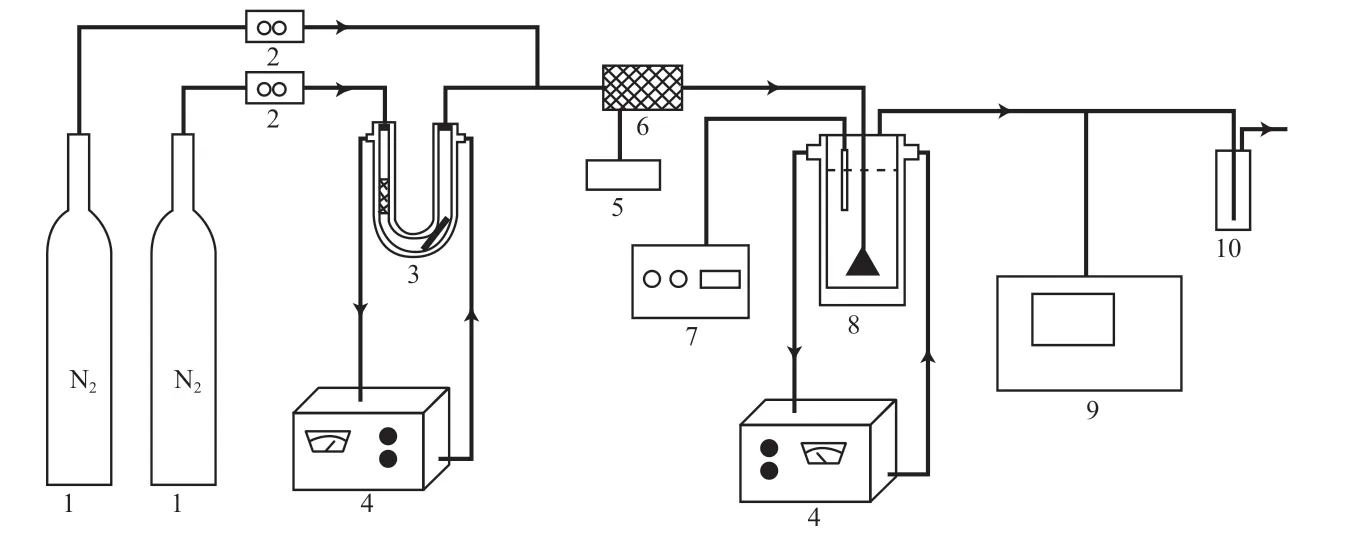
图1 实验装置示意
1.3 分析方法
采用酸性高锰酸钾溶液吸收气体中Hg0,标定后采用AFS-820型原子荧光光度计(北京吉天仪器有限公司)测定Hg质量浓度[20,21,26],计算Hg0去除率。
2 结果与讨论
2.1 反应温度对脱汞性能的影响
反应温度影响KClO溶液氧化吸收Hg0的途径主要有:影响Hg0在溶液中的扩散速率和溶解量;影响溶液中KClO的形态分布和有效氧化物质的产生量;影响化学反应速率。在汞渗透管温度为50℃、吸收液初始pH为3.20、吸收液KClO质量分数为10%的条件下,反应温度对Hg0去除率的影响见图2。由图2可见:Hg0去除率随反应温度的升高而减小,说明提高反应温度不利于KClO溶液氧化吸收Hg0;当反应时间为20 min时,Hg0去除率从10 ℃时的55.68%减小到70 ℃时的25.65%,减小了30.03百分点。

图2 反应温度对Hg0去除率的影响
以反应时间为20 min时的去除率为参照,反应温度对Hg0去除率下降量的影响见图3。由图3可知:反应温度为10 ℃时Hg0去除率下降量最低,反应温度为70 ℃时Hg0去除率下降量最高;反应温度为10,30,50,70 ℃时,反应时间为200 min时的Hg0去除率比20 min时分别下降了34.18,40.50,68.24,82.34百分点。
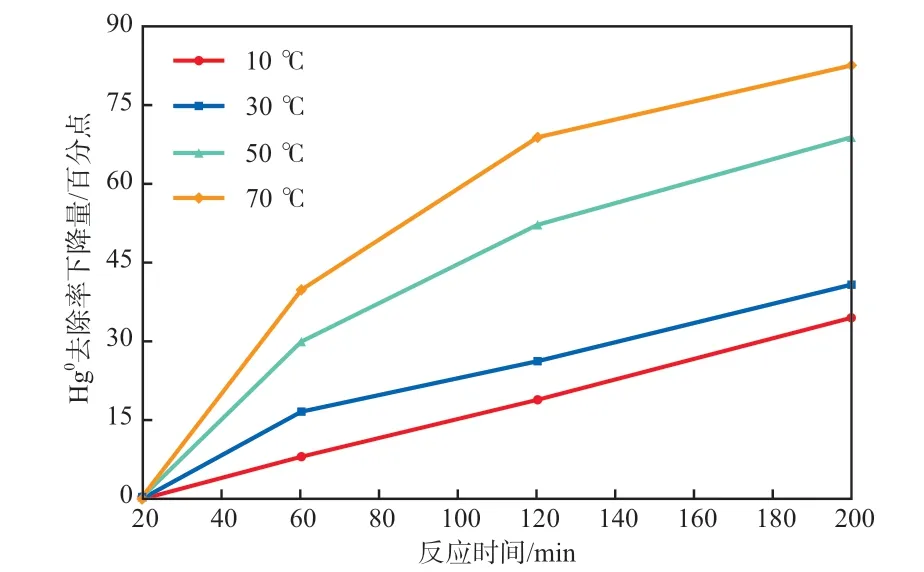
图3 反应温度对Hg0去除率下降量的影响
KClO在酸性条件下可将Hg0氧化成Hg2+,但溶液中KClO可能发生热分解从而抑制吸收反应的进行,见式(1)~(2)。

KClO热分解过程中[O]较难生成,O2大部分会被载气带出。温度越高,热解速率越快,溶液中参与反应的活性组分就越少,Hg0去除率也就越低。此外,Hg0的溶解度随温度增加而减少,Hg0在25 ℃和55 ℃水中的溶解度分别为1.1×10-6g和2.7×10-7g,因此,反应温度从10 ℃提高到70 ℃时, Hg0去除率降低了30.03百分点。同时KClO属于强碱弱酸性质,溶液中的KClO电离形成HClO/ClO-体系,HClO/ClO-体系与Hg0反应产生HgCl2和H2O,见式(3)~(5)。式(5)属于放热反应,提高反应温度不利于反应发生。因此提高反应温度不利于提高脱汞效果。

2.2 汞渗透管温度对脱汞性能的影响
在反应温度为30 ℃、吸收液初始pH为3.00、吸收液KClO质量分数为10%的条件下,汞渗透管温度对Hg0去除率的影响见图4。由图4可见:KClO溶液氧化吸收Hg0的效果受汞渗透管温度的影响,随汞渗透管温度增加,Hg0去除率先升高然后降低;汞渗透管温度从30 ℃升高至50 ℃时,Hg0去除率从27.06%提高到58.22%,提高了31.16百分点;汞渗透管温度增加到70 ℃和90 ℃时,Hg0去除率比50 ℃时分别降低了30.85百分点和40.57百分点。
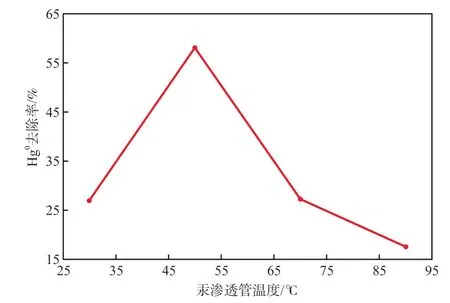
图4 汞渗透管温度对Hg0去除率的影响
汞渗透管的温度控制着Hg0挥发量,决定了气相主体中Hg0的浓度,控制着Hg0从气相到液相的扩散速率。当气相主体中Hg0浓度逐渐上升时,Hg0的气相扩散速率成为整个反应的限速步骤,增大了Hg0在气相主体和气液界面的分压差。同时,根据Fick定律,Hg0扩散通量随浓度差的增大而增大,扩散至气液界面参与反应的Hg0的数量增多,从而提高了Hg0去除率。但由于扩散速率和扩散通量对Hg0去除率的贡献受到反应速率的影响,气相主体Hg0含量的持续增加促使反应限速步骤从气膜移向液膜,因此进一步提高气相主体中Hg0含量,Hg0去除率不再升高反而下降。
2.3 吸收液KClO质量分数对脱汞性能的影响
在反应温度为30 ℃、汞渗透管温度为50 ℃、吸收液初始pH为5.00的条件下,吸收液KClO质量分数对Hg0去除率的影响见图5。

图5 吸收液KClO质量分数对Hg0去除率的影响
由图5可见:Hg0去除率随KClO质量分数增加而增加,KClO质量分数从1%增加至10%时,Hg0去除率相对快速提高了22.51百分点;继续增大KClO质量分数则Hg0去除率增加缓慢,KClO质量分数从10%增大至30%时,Hg0去除率仅提高了6.00百分点。说明吸收液KClO质量分数低于10%时,Hg0和KClO溶液之间气液两相传质反应效率由液相主体控制;KClO质量分数为20%~30%时Hg0去除率的增大可能是反应产物起了促进作用,主要反应产物有KCl、HgCl2和H2O。
2.4 吸收液初始pH对脱汞性能的影响
在反应温度为30 ℃、汞渗透管温度为50 ℃、吸收液KClO质量分数为10%的条件下,吸收液初始pH对Hg0去除率的影响见图6。从图6可见,随着吸收液初始pH的提高,Hg0去除率降低,说明酸性环境更有利于KClO溶液氧化吸收Hg0。其主要原因是因为KClO的氧化还原电势随溶液pH的变化而有较大幅度的变化。KClO的氧化还原电势在pH=1.00时为1.47 V,pH=14.00时为0.84 V,而Hg2+/Hg0的标准电极电势为0.85 V,因此溶液碱性越强则氧化Hg0的能力就越弱,去除率就越低。pH为13.00时,Hg0去除率仅为22.87%,此时去除率主要靠Hg0的扩散作用,KClO已不能氧化Hg0。
反应过程中吸收液pH的变化见图7。
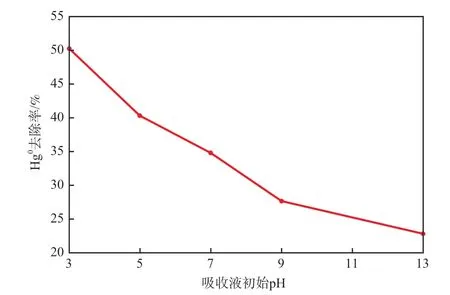
图6 吸收液初始pH对Hg0去除率的影响
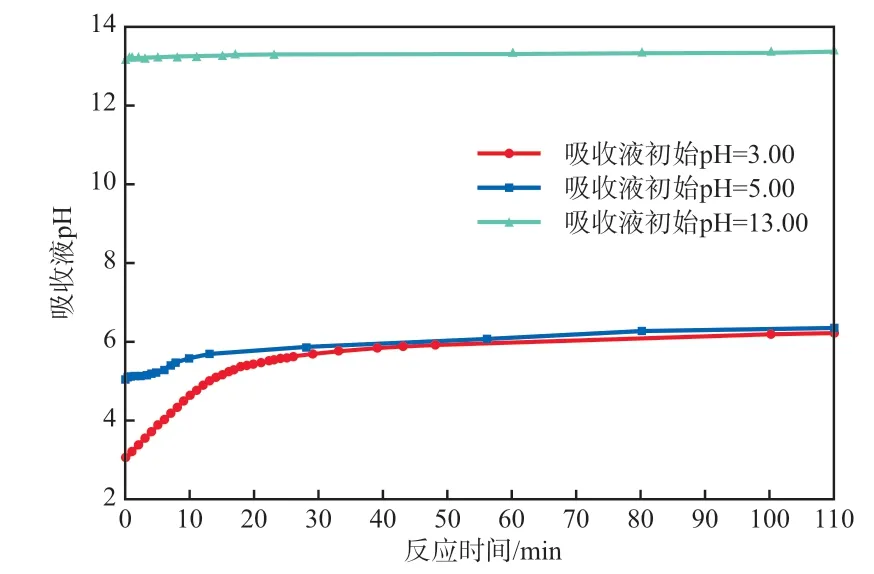
图7 反应过程中吸收液pH的变化
由图7可见:不同初始pH的吸收液随着反应的进行pH均上升,初始pH为3.00,5.00,13.00的吸收液反应110 min后,吸收液pH分别上升至6.22,6.35,13.35,pH增量分别为3.22,1.35,0.35;初始pH为3.00的吸收液在25 min内pH快速上升至5.59,初始pH为5.00的吸收液在8 min内pH快速上升至5.49。说明反应消耗了大量的H+,且酸性条件下Hg0去除效果更好。在酸性环境中氧化Hg0的反应为:ClO-+Hg0+2H+=Cl-+Hg2++H2O。由图7还可知:随着吸收反应的进行,初始pH为13.00的吸收液的pH缓慢上升至13.35,说明反应过程产生了OH-。在碱性环境中氧化Hg0的反应为:ClO-+Hg0+H2O=Cl-+Hg2++2OH-。
3 结论
a)提高反应温度会降低脱汞性能,加快KClO热分解,减小Hg0溶解度,抑制氧化还原放热反应,温度从10 ℃提高到70 ℃时,Hg0去除率下降了30.03百分点。
b)通过汞渗透管温度可提高Hg0浓度,增大Hg0在气相主体和气液界面的分压差,进而提高Hg0的传质速率,使Hg0去除率提高;继续提高Hg0浓度,反应限速步骤从气膜移向液膜,使Hg0去除率下降。
c)KClO质量分数低于10%时,Hg0和KClO溶液的气液两相传质效率由液相控制。
d)Hg0去除率随吸收液初始pH的提高而降低,吸收液pH随反应时间的延长而升高,不同pH下反应机理不同,在酸性环境中氧化Hg0的反应为:ClO-+Hg0+2H+=Cl-+Hg2++H2O,在碱性环境中氧化Hg0的反应为:ClO-+Hg0+H2O=Cl-+Hg2++2OH-。

