绵羊3种胞内寄生原虫感染情况调查
陈雅婕,祝子伏,杨玉荣,刘 群,刘 晶
(1. 中国农业大学动物医学院 国家动物寄生原虫实验室 农业部动物流行病学重点实验室,北京 海淀 100193;2. 河南农业大学牧医工程学院,河南 郑州 450002)
住肉孢子虫(Sarcocystis)、新孢子虫(Neosporacaninum)和弓形虫(Toxoplasmagondii)均是专性寄生于细胞内的顶复亚门原虫,呈世界性分布[1-3]。三者亲缘关系相近,生活史相似,发育阶段需要更换宿主,且宿主范围极为广泛[4-6],绵羊是这3种原虫的常见中间宿主。我国报道的绵羊住肉孢子虫流行株为柔嫩住肉孢子虫(S.tenella)、巨型住肉孢子虫(S.gigantea)和褐犬住肉孢子虫(S.arieticanis)[7]。住肉孢子虫多以包囊形式寄生于绵羊的横纹肌[4],大量寄生可影响肉品质量,严重时导致羊肉制品的废弃;少数住肉孢子虫(如S.tenella)严重时可寄生于绵羊中枢神经系统,导致绵羊出现神经症状甚至死亡[6]。住肉孢子虫存在严格的宿主特异性,虫株不同以及感染数量的差异均会影响其致病性[6]。弓形虫和新孢子虫感染绵羊主要引起孕畜流产、产死胎等繁殖障碍和新生胎儿运动神经系统障碍[2-3]。其中,弓形虫病又是人兽共患寄生虫病,弓形虫容易随着羊肉进入人类食物链,引起食源性弓形虫感染。在实际生产中,住肉孢子虫、新孢子虫和弓形虫常出现混合感染的情况,危害人类健康,给养殖业带来巨大的经济损失。
为研究住肉孢子虫、新孢子虫和弓形虫在绵羊中的感染情况,我们采集了114份心肌样品、61份食道样品和131份血清样品,利用组织压片镜检和间接ELISA的方法对住肉孢子虫、新孢子虫和弓形虫的病原或抗体进行了检测,为进一步了解3种原虫的混合感染情况,有效防控绵羊感染3种寄生虫提供了可借鉴的资料。
1 材料与方法
1.1 主要材料 样品采自河南焦作某地区数家散养户,随机采样114个心脏、61个食道以及131份血清样品;采集的心脏和食道样品冷却至室温后置于4 ℃冰盒中保鲜,血清样本于-80 ℃保存;弓形虫和新孢子虫阳性血清,由国家动物寄生原虫实验室制备并保存;胃蛋白酶,购自Sigma公司;DMEM高糖培养基和新生牛血清,均购自北京迈晨科技有限公司;全血组织细胞基因组DNA快速提取试剂盒,购自北京艾德莱生物技术公司;Donkey anti-goat IgG HRP,购自北京博奥龙免疫技术有限公司。
1.2 主要仪器 倒置荧光显微镜IX70,购自日本Olympus公司;荧光倒置显微镜ECLIPSE Ts2R,购自日本Nikon公司;PCR仪,购自美国BIO-RAD公司;微孔板分光光度计,购自美国Bio-Tek公司。
1.3 试验方法
1.3.1 组织压片 分别观察心肌样品和食道样品有无肉眼可见的住肉孢子虫包囊。在心肌样品和食道肌样品上顺肌纤维方向随机取2处米粒大小的肌肉置于载玻片上,用盖玻片盖住后缓慢轻压,使其变薄。将玻片置于光学显微镜下,利用10×20倍镜和10×40倍镜分别观察住肉孢子虫包囊并通过倒置荧光显微镜IX70拍照留存。
1.3.2 住肉孢子虫的纯化 取心脏和食道样品(约25 g)于搅拌机中搅至肉泥状,加入生理盐水和胃蛋白酶(1∶1混合),放入500 mL锥形瓶中,37 ℃摇床消化50 min。用筛子去除未消化的肌肉组织,滤过的液体4 600 r/min离心4 min,弃去上清。加入5 mL碳酸氢钠溶液摇匀,再加入生理盐水至50 mL, 离心去上清,用生理盐水重悬即获得住肉孢子虫缓殖子悬浊液。参考文献[8]的方法进行密度梯度离心纯化住肉孢子虫缓殖子,置于荧光倒置显微镜ECLIPSE Ts2R下观察。按照全血组织细胞基因组DNA快速提取试剂盒的说明书对纯化的缓殖子提取基因组DNA。剩余虫体加入含2%FBS的DMEM培养基重悬后加入二甲基亚砜,-80 ℃保存。
1.3.3 PCR 根据文献[9]报道,扩增住肉孢子虫18S rRNA,引物序列为Sar-F:5′-GCACTTGATGAATTCTGGCA-3′,Sar-R:5′-CACCACCCATAGAATCAAG-3′。反应体系:2×Taq酶25 μL,DNA模板1 μL,上下游引物各1 μL,ddH2O 22 μL。94 ℃预变性5 min; 94 ℃变性45 s,55 ℃退火1 min,72 ℃延伸1 min, 30个循环;72 ℃延伸7 min。PCR产物经琼脂糖凝胶电泳后观察其条带大小,将大小符合预期的条带切下送检测序。检测结果与NCBI数据库进行比对。
1.3.4 间接ELISA 依据实验室前期建立的间接ELISA方法检测新孢子虫和弓形虫抗体。参考文献[10]的方法进行新孢子虫特异性抗体检测,用分光光度计读取OD450 nm值和OD630 nm值。以OD450 nm/OD630 nm=0.185为临界值,大于或等于临界值为新孢子虫抗体阳性;小于临界值则为阴性;参考文献[11]的方法进行弓形虫特异性抗体检测,用分光光度计读取OD450 nm值。以0.158为临界值,大于临界值为弓形虫抗体阳性;小于或等于临界值则为阴性。
2 结果
2.1 采样情况 羊只均为12月龄左右的公绵羊,统一从内蒙或山西引进。羊群精神状态较好,未见食欲低下,精神沉郁以及神经症状;营养状况普遍良好,体型适中;1只绵羊营养不良,体型消瘦,但经镜检和间接ELISA检测后发现其营养不良与3种原虫寄生无相关性。
2.2 住肉孢子虫感染情况 心脏和食道样品均无肉眼可见的住肉孢子虫包囊,但在镜下观察心脏阳性样本压片时可见与肌肉纤维平行且形态呈纺锤形的住肉孢子虫包囊,内含大量缓殖子,见图1A,箭头所指即为住肉孢子虫包囊。因食道样本中的住肉孢子虫包囊数少,压片镜检时未发现明显包囊,改为采用先组织消化后镜检观察的方法。样本经组织消化和密度梯度离心纯化后可在镜下观察到呈月牙形或香蕉形的缓殖子,见图1B和图1C,箭头所指即为住肉孢子虫缓殖子。对采集的样本镜检统计结果如表1所示,心肌和食道样品中均能检测到住肉孢子虫,心脏检出率为35.96%,高于食道21.31%的检出率。在这些样本中,有13份心肌与食道样品为同一来源,其中4份食道住肉孢子虫阳性样本的羊心脏检测结果为阴性,9份食道阳性样本羊的心脏中也检测到住肉孢子虫的包囊,最终绵羊住肉孢子虫感染率为39.47%(45/114)。检测结果说明住肉孢子虫可同时寄生于心脏和食道,但心脏组织更适于住肉孢子虫寄生且心尖检出率最高。
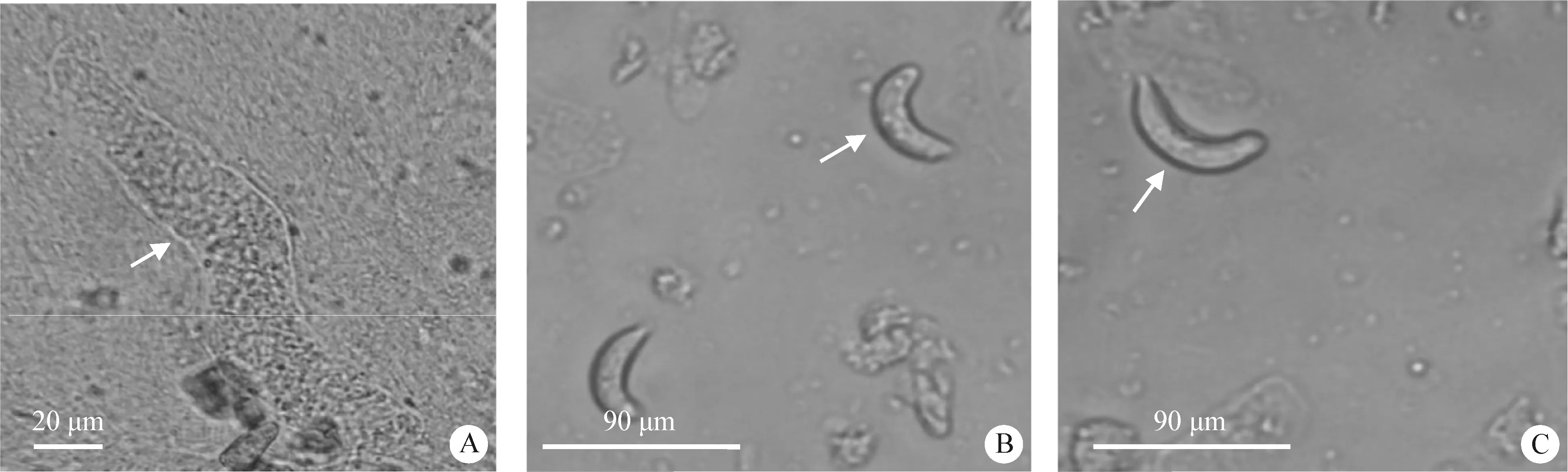
图1 倒置荧光显微镜下观察住肉孢子虫包囊及缓殖子Fig.1 Sarcocystis cysts and bradyzoites are observed by inverted fluorescence microscopesA:心尖组织压片(200×); B:食道样品(400×); C:心肌样品(400×)A: Heart apical tissue compression (200×); B: Esophagus samples (400×); C:Heart samples (400×)

表1 绵羊不同组织住肉孢子虫感染情况Table 1 Infection of Sarcocystis in different tissues of sheep
2.3 住肉孢子虫的种属鉴定 成功分离、纯化的住肉孢子虫为分子生物学研究提供了物质保障。以纯化的缓殖子(不同组织样本中分离)中提取的DNA为模板进行PCR扩增,成功扩增到600 bp左右的18S rRNA 单一条带,见图2。送检测序后的结果与NCBI数据库(https://www.ncbi.nlm.nih.gov/)进行比对并利用Mega进行绘图,发现寄生于食道和心肌的住肉孢子虫基因序列与S.tenella18S rRNA(MF039329.1)基因序列相似性分别为99.65%和99.48%,与巨型住肉孢子虫18S rRNA(L24384.1)基因序列相似性分别为94.93%和95.34%。食道肌和心肌样品中分离到的住肉孢子虫与S.tenella的基因序列相似性极高,且样品中未见巨型住肉孢子虫特征性的肉眼可见的包囊,故判断其为S.tenella。
2.4 新孢子虫和弓形虫感染情况 间接ELISA检测结果显示,此次采集的血清样品中新孢子虫和弓形虫感染率分别为57.25%(76/131)和21.37%(28/131),同时检出弓形虫和新孢子虫抗体的样本有22份,混合感染率为16.79%(22/131)。将心肌和食道肌样本与血清样本一一对应,结合2.1中检测到的住肉孢子虫感染情况,发现新孢子虫和住肉孢子虫、弓形虫和住肉孢子虫的混合感染率分别为21.92%(25/114)和9.64%(11/114)。3种原虫检测结果均为阳性的混合感染样本有9份,感染率为7.89%(9/114),见表2。检测结果表明该地区绵羊3种原虫均有感染,且存在较高的混合感染情况。

图2 18S rRNA的PCR扩增Fig.2 Amplification of 18S rRNA by PCRM:DL-2 000相对分子质量标准; 1~3:心肌样品;4~5:食道肌样品; 6:巨型住肉孢子虫 DNAM: DL-2 000 DNA Marker; 1~3: Heart samples;4~5: Esophageal samples; 6: S. gigantea DNA
3 讨论
住肉孢子虫、新孢子虫和弓形虫是危害养殖业的3种顶复亚门原虫。目前实验室常用PCR法和血清学法对弓形虫和新孢子虫进行检测,但PCR法常受引物、样品处理等影响,国际上未有统一检测标准[3],且其在临床上多呈慢性感染,样品如脑组织采集过于繁琐。考虑2种原虫可垂直传播且感染后一般无法自愈,故应用中更偏向于血清学方法诊断。住肉孢子虫则因尚无特异性血清学诊断方法,多采用组织压片镜检法检测,后者敏感性显著低于前者,易出现漏检。住肉孢子虫基因库尚未公布,应用分子生物学技术存在较大的局限,现主要利用核糖体小亚基(18S rRNA)[12]、核糖体大亚基(28S rRNA)[13]及线粒体细胞色素氧化酶I(Cytochrome C oxidase subunit I,cox1)[12]研究其分型、种系发育以及流行病学调查[6],内转录间隔区(Internal transcribed spacer,ITS)[6]应用较少。

表2 住肉孢子虫、新孢子虫和弓形虫感染情况Table 2 Infection of Sarcocystis,Neospora and Toxoplasma gondii
此次对河南焦作绵羊村绵羊住肉孢子虫、新孢子虫和弓形虫感染情况进行调查,发现3种原虫的感染率较高并存在一定的混合感染。其中新孢子虫和住肉孢子虫感染率(分别为57.25%和39.47%)显著高于弓形虫(21.37%)。同时,此次检测出的住肉孢子虫感染率(39.47%)略高于董辉等[14]报道的河南全省住肉孢子虫感染率(32.48%);新孢子虫感染率(57.25%)显著高于韩方洁[15]报道的河南安阳新孢子虫感染率(37.35%),推测这与饲养管理、绵羊来源等有密切关系。采样地的绵羊宰杀点通常选址在养殖场门口,且养殖场周围多饲养犬只用于管理羊群安全,导致犬只极易接触到屠宰后的生羊肉和内脏而被感染。犬是新孢子虫和柔嫩住肉孢子虫的终末宿主,感染犬排出的粪便含有新孢子虫或柔嫩住肉孢子虫的卵囊,污染养殖场的饮水、器具或饲料,导致绵羊再次感染新孢子虫和柔嫩住肉孢子虫。而猫是弓形虫和巨型住肉孢子虫的唯一终末宿主,接触羊群的机会有限,这也解释了新孢子虫和住肉孢子虫感染率比弓形虫高以及未检测出巨型住肉孢子虫的情况,符合我国住肉孢子虫流行现状[16]。此外该村近年来统一利用高速运输的方式从内蒙古或山西引进5~6月龄的公绵羊(引入前、后并未检测3种原虫),采用圈养的方式育肥至12月龄宰杀,平均养殖密度约100~200头。据现有流行病学调查显示,内蒙古地区住肉孢子虫阳性率高达57.14%[17],新孢子虫阳性率达23%[15],推断该村绵羊住肉孢子虫和新孢子虫感染率偏高可能源于引种地区即内蒙古的高流行率。但鉴于目前尚未有山西绵羊住肉孢子虫和新孢子虫相关流行病学调查,故无法明确引入地与引种地区间住肉孢子虫和新孢子虫流行率的具体关联,还需进一步调查。
不同检测部位的住肉孢子虫检出率也存在差异。此次心肌检出率(35.96%)显著高于食道(21.31%);Minuzzi C E等[16]检测绵羊住肉孢子虫时发现心肌检出率(91.5%)高于食道(81.5%);李春花等[18]对青海省绵羊住肉孢子虫进行检测时发现食道肌(77.23%)检出率比心肌(64.36%)高;Fukuyo M等[19]用压片法检测绵羊住肉孢子虫时发现舌肌检出率最高,推测造成这种现象的原因可能与住肉孢子虫的分型有关。虽然住肉孢子虫可寄生于全身多处肌肉组织,但在组织器官分布中存在特异性[6]。本次分离所得为柔嫩住肉孢子虫,其主要寄生于心肌、舌肌等部位[4]。
国内绵羊住肉孢子虫流行虫株对人无明显致病性[6]且多数绵羊呈隐形感染,故我国对住肉孢子虫的检疫与防控并不重视。然而有报道显示,严重的柔嫩住肉孢子虫感染可导致绵羊流产、早产、神经症状甚至是死亡[6];巨型住肉孢子虫的临床症状不明显,但其形成的包囊可严重影响肉质,包囊破裂后还可导致周围肌肉变性[7]。住肉孢子虫全国各地均有报道,流行率极高且在临床上常与弓形虫、新孢子虫混合感染,给养殖经济造成巨大损害。为控制3种原虫的流行,我们应重视3种疾病的宣传教育;加强终末宿主的管理,不喂犬猫生羊肉、内脏并严禁犬猫出入圈舍,切断传播途径;保持舍内清洁卫生,提高绵羊的免疫力并避免饲料、饮水被污染;定点屠宰,减少犬猫接触生羊肉和内脏的机会;尽量避免从流行率高的地区引种绵羊。
4 结论
该地区绵羊存在住肉孢子虫、新孢子虫和弓形虫3种原虫的感染,且混合感染情况较为普遍。流行的住肉孢子虫虫种为柔嫩住肉孢子虫。

