小麦面筋蛋白含半胱氨酸小麦肽的富集与表征
孙媛,孔祥珍,华欲飞
(江南大学 食品学院,江苏 无锡,214122)
小麦面筋蛋白,又称谷朊粉,蛋白质含量高达75%~85%,是营养丰富的植物蛋白资源,其中的半胱氨酸(Cys)含量大约占2.0%~2.5%,高于常见的植物蛋白。利用蛋白酶酶解小麦面筋蛋白不仅可以增加小麦面筋蛋白的溶解性,还可以获得具有抗氧化性[1-2]、抗高血压性[3]和提高免疫力[4]等多种生物活性的小麦肽。其中,含半胱氨酸的肽具有重要的生理活性如广谱抗菌性(含二硫键)[5]、抗氧化性(巯基)[6]、维持体内巯基平衡[7]、鳌合重金属[8]和促进体内铁的吸收等。半胱氨酸含有游离的巯基,对于含半胱氨酸小麦肽的功能发挥着不可忽视的作用。
检测巯基的方法有很多种,紫外与荧光检测法具有检测限低、灵敏度高、选择性强和使用简便等优点,因此在硫醇检测方面得到普遍应用。GRAZYNA等[9]采用高效液相色谱法(high performance liquid chromatography,HPLC),将化学衍生法和紫外检测相结合,准确测定了黄瓜叶片中半胱氨酸和谷胱甘肽的含量;RUAN等[10]利用单溴二胺(monobromobimane,mBBr)特异性标记硫醇并结合聚丙烯酰胺凝胶电泳(SDS-PAGE)测定了大豆蛋白不同亚基/多肽的巯基含量,研究了巯基的氧化与巯基-二硫键(SH-SS)的交换;KANNAU等[11]用mBBr荧光标记与SDS-PAGE方法对藻红蛋白中的巯基进行检测与鉴定。巯基物质常见的研究一般主要集中于定量检测以及初步分离等,如崔秀云等[12]利用5种树脂对含巯基物质谷胱甘肽进行静态吸附分离;现报道的研究中对于巯基肽的分离纯化大都采用大孔吸附树脂与离子交换树脂结合HPLC进行分析,对于巯基肽主要是利用巯丙基Sepharose 6B树脂进行富集,丁秀臻[13]利用巯丙基树脂对大豆11S制备的巯基肽进行富集,巯基含量大大增加。巯基肽性质研究以期为含半胱氨酸小麦肽的分离与富集提供新的思路与方法。
本文采用胃蛋白酶对小麦面筋蛋白进行酶解制备含半胱氨酸小麦肽,并探究还原处理对含半胱氨酸小麦肽的影响;其次利用巯丙基树脂共价色谱静态吸附法对含半胱氨酸小麦肽进行分离富集,探究其性质;最后采用mBBr对制备的含半胱氨酸小麦肽进行荧光标记与表征。
1 材料与方法
1.1 仪器与试剂
小麦面筋蛋白(蛋白质质量分数75.0%),安徽安特有限公司;
尿素、三羟甲基氨基甲烷(Tris)、盐酸、二硫苏糖醇(dithiothreitol,DTT)、柠檬酸、柠檬酸钠、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、乙二胺四乙酸二钠(ethylenediaminetetraacetic acid disodium salt, EDTA-2Na)、盐酸胍(GuHCl)、二氯甲烷、三氟乙酸(trifluoroacetic acid,TFA),均为分析纯,中国医药集团化学试剂有限公司;乙腈(色谱纯)、胃蛋白酶;还原性谷胱甘肽、4,4-二硫二吡啶(4, 4-dithiopyridine,4-DPS)、单溴二胺(monobromobimane,mBBr),Sigma-Aldrich公司;硫代丙基Sepharose 6B凝胶,GE公司;醋酸纤维素膜、透析袋,北京中生瑞泰科技有限公司。
SC-15型智能节能恒温循环水浴锅,宁波新芝生物科技股份有限公司;超声波清洗仪,昆山市超声仪器有限公司;LGJ-18型冷冻干燥机,北京四环仪器厂;UV2450型紫外分光光度计,日本岛津公司;90型磁力搅拌器、旋涡震荡仪,上海沪西分析仪器厂有限公司;pH计,Mettler-Toledo仪器有限公司;CR21N型高速冷冻离心机,日本Hitachi公司;氮吹仪,无锡久平仪器有限公司;安捷伦高效液相色谱仪;TSK-gel G2000SWXL(300 mm×7.8 mm,5 μm)型色谱柱;YMC-Pack Pro C18(250 mm×4.6 mm,5 μm)。
1.2 小麦面筋蛋白含半胱氨酸小麦肽的制备
1.2.1 胃蛋白酶酶解
配制蛋白质量分数为5%的小麦面筋蛋白溶液,并用盐酸调节溶液的pH至2.0,循环水浴锅提前预热至37 ℃,加入质量分数2%的胃蛋白酶进行酶解,时间为6 h,酶解结束后沸水浴灭酶10 min终止反应。在8 000 r/min条件下离心30 min,上清液为酶解物。
1.2.2 DDT还原后胃蛋白酶酶解
参考陈海桥等[14]的方法制备含半胱氨酸小麦肽。将小麦面筋蛋白以质量分数5%蛋白含量分散于含50 mmol/L二硫苏糖醇的Tris-HCl缓冲液(pH 7.5,0.1 mol/L)中,室温下不断搅拌。采用盐酸溶液调节pH至2.0,采用透析袋(截留相对分子质量为3 000 Da)进行透析。透析结束后,胃蛋白酶进行酶解制备含半胱氨酸小麦肽,酶解条件同1.2.1小节中的方法。
1.2.3 胃蛋白酶酶解后DTT还原
为了探究还原与酶解操作先后顺序对于含半胱氨酸小麦肽的影响,进行如下实验。胃蛋白酶酶解同1.2.1小节中的方法,酶解制备的样品中加入50 mmol/L DTT,进行二硫键的还原,还原时间为2 h,还原结束进行透析处理,装入500 Da透析袋中透析48 h。透析结束后8 000 r/min离心30 min,所得上清液进行干燥,即得酶解还原样。
1.3 巯基含量的测定
采用4-DPS[13]法测定制备的含半胱氨酸小麦肽的巯基含量。配制一定浓度的酶解液样品,取0.45 mL样品溶液,加入188 μL 4 mmol/L 4-DPS溶液,再加入4.05 mL pH 4.5的柠檬酸-柠檬酸钠缓冲液(质量分数1%SDS),混合均匀,室温反应30 min,在波长为324 nm下测定吸光值。
试剂空白:用去离子水代替4-DPS作为试剂空白;蛋白空白:用去离子水代替样品作为蛋白空白。
巯基含量的计算如公式(1)所示:
(1)
式中:x,巯基含量,μmol/g蛋白;A324,样品在324 nm处的吸光值;A324试剂,试剂空白在324 nm处的吸光值;A324蛋白,蛋白空白在324 nm处的吸光值;ε,吸光系数,该实验中取值为21 400[(mol/L)-1·cm-1];b,光程,本处取1 cm;c,蛋白质量浓度,mg/mL。
通过凯氏定氮法测定酶解物中蛋白质浓度,对于体系中二硫键的还原,采用了2种方式,(1)利用还原剂硼氢化钠(NaBH4)还原,NaBH4具有强还原性且分子中没有巯基,因此可以直接还原二硫键后进行巯基含量的测定[9]。(2)采用还原剂二硫苏糖醇,但二硫苏糖醇本身带有巯基,在二硫键还原为巯基之后要进行脱除处理。
1.4 mBBr标记
向0.25 mL 0.1 mol/L Tris-HCl(含8 mol/L GuHCl pH 7.5)缓冲液中加入25 μL 10 mmol/L mBBr(溶解在纯乙腈中),混匀后加入225 μL样品,此时反应体系的体积为0.5 mL,25 ℃黑暗反应90 min。反应结束后加入3 mL二氯甲烷洗涤3次,每次旋涡振荡30 s,去除过量的mBBr。离心去除二氯甲烷层,上层样品用0.22 μm的醋酸纤维素膜过滤,收集下层滤液,分析前4 ℃避光保存。
1.5 共价色谱静态吸附法富集含半胱氨酸小麦肽
用100 mmol/L Tris-HCl缓冲液(pH 7.5,含5 g/L SDS)配制蛋白质量分数为2%的样品,加入微量还原剂DTT,防止巯基被氧化,将样品和制备好的硫代丙基Sepharose 6B凝胶一起置于锥形瓶中,氮吹排除整个体系中的空气,并在氮气流的环境中以m(巯基)∶m(配基)=4∶5将样品与树脂在25 ℃进行2 h键合(置于摇床)反应。
键合结束,用缓冲液将未键合上的含半胱氨酸小麦肽洗去,用100 mmol/L Tris-HCl(含25 mmol/L DTT,pH 7.5)对键合上的含半胱氨酸小麦肽进行洗脱,每次0.5 h,室温置于摇床进行2次洗脱,取解析液。采用透析的方式去除洗脱液中DTT,透析48 h。透析后干燥得到富集的样品。

图1 巯基-二硫键交换示意图Fig.1 Schematic diagram of the exchange reaction of SS and SH
1.6 相对分子质量的测定
采用HPLC测定含半胱氨酸小麦肽的相对分子质量。选择安捷伦液相色谱系统,TSK-gel G2000SWXL(300 mm×7.8 mm,5 μm)型色谱柱,配置有紫外检测器和荧光检测器,流动相为V(乙腈)∶V(水)∶V(三氟乙酸)=45∶55∶0.1,流速:0.5 mL/min,紫外检测波长为214 nm,荧光激发波长390 nm,检测波长476 nm,柱温30 ℃,时间40 min,通过与标准样品出峰时间对比,确定样品的相对分子质量分布。
对于还原的样品,在透析除去还原剂并保持低pH的情况下,体系的巯基比较稳定,并以游离状态存在,用mBBr标记,其出峰的位置即代表含半胱氨酸小麦肽,进而对相对分子质量进行测定。
1.7 亲疏水性测定
采用C18(250 mm×4.6 mm,5 μm)色谱柱,检测器为紫外检测器和荧光检测器,流动相A相:超纯水,含0.1%(体积分数)TFA;B相:乙腈,含0.085%(体积分数)TFA,流速1.0 mL/min,紫外检测波长为214 nm,荧光激发波长390 nm,检测波长476 nm,柱温25 ℃,时间80 min,采用梯度洗脱:0~5 min,5%B→10~60 min,线性变换B的浓度到60%→60~65 min,线性变换B的浓度到100%→65~70 min,线性变换B的浓度到5%→70~75 min,保持B的浓度为5%。根据液相谱图对含半胱氨酸小麦肽的亲疏水性进行分析。
1.8 数据分析
所有实验数据用Origin Pro 8.5和IBM SPSS Statistics V 22.0进行分析处理。
2 结果与分析
2.1 小麦面筋蛋白含半胱氨酸小麦肽的巯基含量
小麦面筋蛋白中总巯基含量为(200±20) μmol/g蛋白(表1)。胃蛋白酶在酶解小麦面筋蛋白的过程中,选择性酶切,因此有一部分较大分子的含半胱氨酸小麦肽会随离心力的作用而进入沉淀中,造成含半胱氨酸小麦肽的损失,所以胃蛋白酶酶解样品(pepsin hydrolysis,Ph)中巯基的含量比其他几种处理方式所得的巯基含量低。经过还原,二硫键被打断,分子内部的结构变得松散,胃蛋白酶能更好地对大分子肽段进行酶解,因此先还原后酶解样品(reduction and pepsin hydrolyzes,RPh)中巯基含量高。对于先酶解后还原样品(pepsin hydrolyzes and reduction,PhR),酶解之后一部分大分子变为小分子,再经过还原剂的作用,使得原本因二硫键连接在一起的大分子肽段转变为小分子肽段,在离心操作中原本进入沉淀的大分子肽段进入上清液,提高了上清液中含半胱氨酸小麦肽的含量与得率,因此巯基含量提高。

表1 小麦面筋蛋白含半胱氨酸小麦肽的巯基含量 单位:μmol/g
由表1可知,除了Ph样品外各组数据之间没有显著性差异(P>0.05),与单纯酶解相比,还原步骤能很好地增强酶解的效果使得酶解过程中进入沉淀的含半胱氨酸小麦肽转入上清液,提高上清液含半胱氨酸小麦肽的含量与得率。对于还原剂DTT而言,先还原或后还原所得的含半胱氨酸小麦肽巯基的含量没有显著差异(P>0.05),2种处理方式都能够很好地将体系中二硫键还原为巯基。
2.2 小麦面筋蛋白含半胱氨酸小麦肽的相对分子质量分布
Ph、RPh和PhR的相对分子质量分布如图2所示。几种处理方式得到含半胱氨酸小麦肽的相对分子质量从300 ~10 kDa均有分布,但相比于小麦面筋蛋白相对分子质量(醇溶蛋白30 k~60 kDa,麦谷蛋白80 000至数百万Da[20])小了很多。对于Ph样品,相对分子质量分布>5 000 Da的组分大约占57.36%;而RPh中,相对分子质量分布>5 000 Da的组分占比降低为29.80%,相对分子质量分布 <300 Da组分占比由原来Ph 中8.85%提高到16.70%,这可能是因为RPh样品先经过还原剂的处理之后,小麦面筋蛋白分子中的二硫键被打断,结构变得比较松散,更有利于酶切位点的暴露,使得胃蛋白酶酶解更加彻底;相比前2种样品PhR样品相对分子质量>5 000 Da组分的占比高达48.34%,相对分子质量 <1 000 Da的组分占比为4.27%,小于还原酶解样16.70%,这与透析该步骤有关,酶解后的相对分子质量比还原后的相对分子质量更小,选择500 Da的透析袋透析,在透析的过程中相对分子质量较小的肽段会损失,所以小分子占比降低。而相比较RPh样品在酶解之前便透析除去了还原剂与较小分子的肽段,再经过酶解之后所产生的小分子肽段主要是胃蛋白酶酶解大分子蛋白所得。
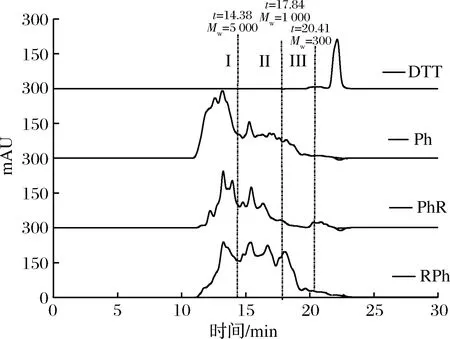
图2 酶解肽段相对分子质量分布Fig.2 Molecular weight distribution of enzymatic peptides
对各个时间段的相对分子质量曲线进行积分,各个相对分子质量段的占比如表2所示。其中I(0~14.38 min);II(14.38~17.84 min);III(17.84~20.41 min)。
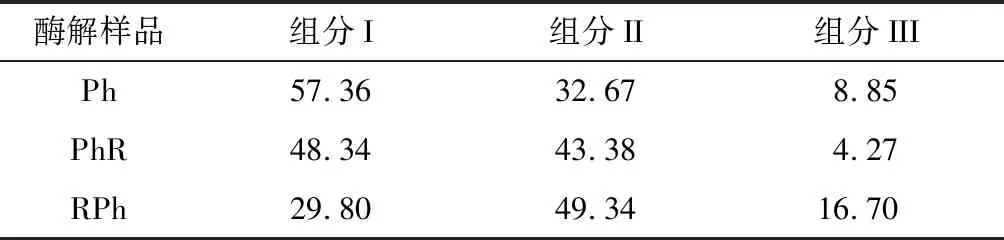
表2 各个组分相对分子质量占比 单位:%
从图1中也可以看出,经过透析之后还原剂DTT的峰消失,说明透析能很好地除去DTT。
2.3 共价色谱静态吸附法富集含半胱氨酸小麦肽
由2.1小节可知小麦面筋蛋白巯基含量为(200±20) μmol/g蛋白,RPh样品中的巯基含量为(195.10±12.79) μmol/g蛋白,采用4-DPS法测定了巯丙基树脂富集后的样品的巯基含量为(994.95±9.31) μmol/g蛋白。说明经过巯丙基树脂的富集,含半胱氨酸小麦肽得到富集,巯基含量上升约为原来的5倍。
对图3-a各个组分的面积进行分析,与未富集的样品相比,经过富集的样品I组分占比明显增大,由29.80%增至48.46%,相对分子质量>5 000 Da的组分相对于其他组分得到了更好地富集,说明巯丙基树脂富集的主要是较大相对分子质量的含半胱氨酸小麦肽,这可能是因为大分子肽段相比于小分子肽段所带的巯基部分更易与树脂上的特异性基团作用;II组分在富集之前与富集之后占比分别为49.34%与41.62%,占比有所下降;III组分由于相对分子质量太小随着洗脱液洗出而损失,所以在3个组分中富集程度最小,仅占7.93%。

a-相对分子质量分布;b-亲疏水性分析图3 巯丙基树脂富集半胱氨酸肽段的HPLC表征Fig.3 Characterization of cysteine peptides enriched with mercaptopropyl resin by HPLC
在20~60 min内随着时间的增加,有机相的比例在不断增加,出峰时间越晚,组分的疏水性越大。由图3-b可知,经过富集的样品疏水性增加,亲水性降低。这与富集样品中相对分子质量大的组分占比较大有一定的关系,相对分子质量越大,出峰时间越晚,疏水性越强。
2.4 小麦面筋蛋白含半胱氨酸小麦肽的表征
2.4.1 mBBr标记含半胱氨酸小麦肽
利用反相高效液相色谱探究酶解生成的含半胱氨酸小麦肽是否具有独特的亲疏水性。对未富集与富集的样品进行mBBr荧光标记(图4),对比没有用mBBr标记的样品,发现未富集与富集的样品在不经过mBBr荧光标记时,在荧光的检测波长下均没有荧光特性的特征峰出现,样品本身不产生荧光性,荧光标记试剂对巯基肽具有特异性。
从图4可以看出,标记之后的含半胱氨酸小麦肽在30~50 min之间均有荧光图谱,亲疏水性并不单一。对比未富集样品与富集样品的荧光谱图,荧光的面积明显增大,说明含半胱氨酸小麦肽达到了富集。将图谱分为3个组分I、II、III,组分I的亲水性最好,组分III疏水性最强。对比富集前后3个组分的占比发现,富集样品中组分I的占比为15.63%,大于未富集3.28%,组分III占比则由61.21%下降为33.52%,说明该树脂对含半胱氨酸小麦肽中亲水性的组分富集程度要大于疏水性组分。
2.4.2 含半胱氨酸小麦肽的表征
含半胱氨酸小麦肽用mBBr标记后的荧光图谱与含半胱氨酸小麦肽本身的紫外图谱如图5所示。
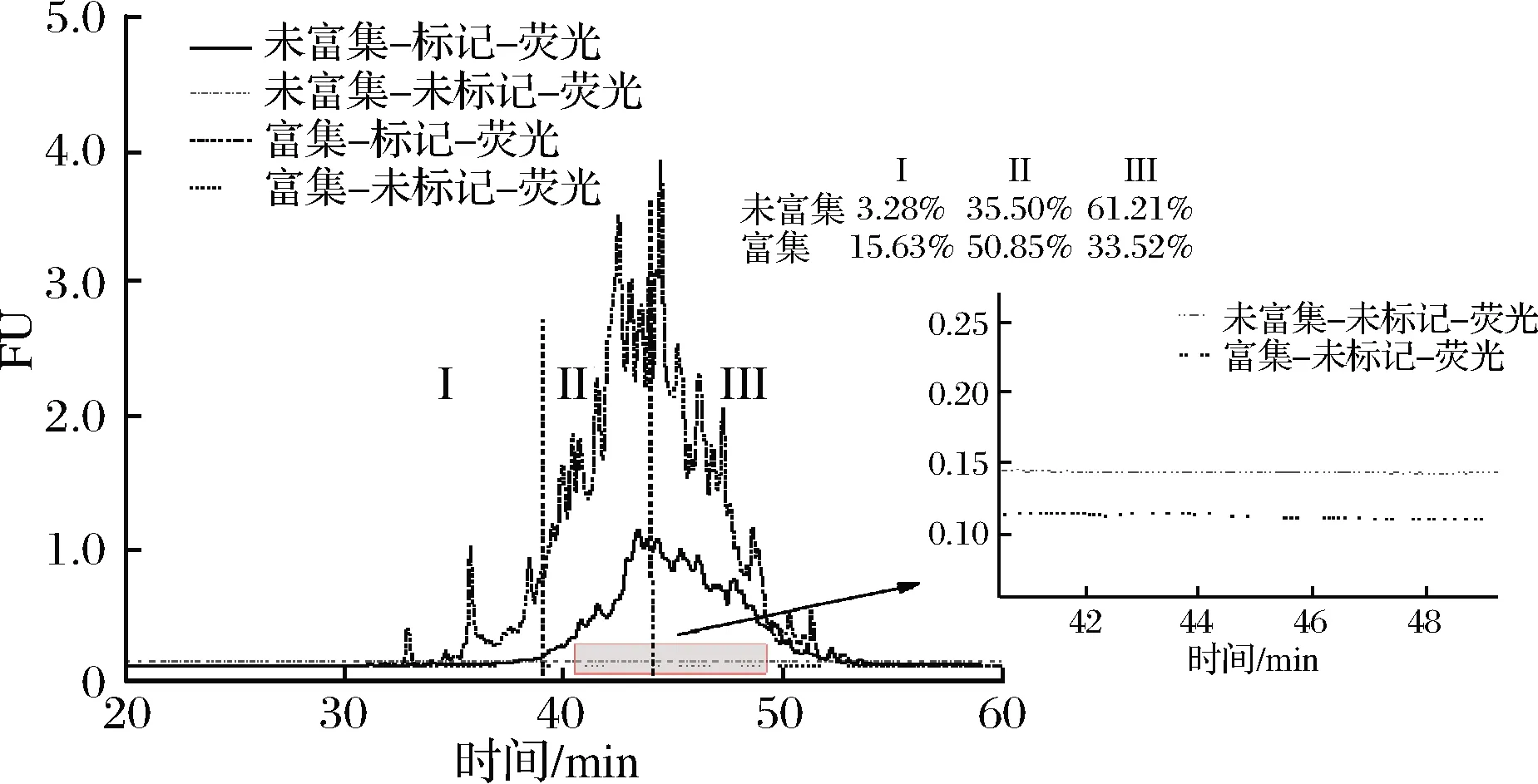
图4 mBBr标记含半胱氨酸肽的HPLC表征Fig.4 Characterization of mBBr labeled cysteine-containing peptides by HPLC
从图5-a可以看出,含半胱氨酸小麦肽的相对分子量在300~10 000 Da均有分布,对比图5-a中紫外图谱与荧光图谱,发现相对分子质量>5 000 Da的组分在紫外图谱中占48.02%,但在荧光谱图中仅占8.97%,而<1 000 Da的组分在荧光谱图中面积的占比为51.92%,远大于在紫外谱图中的面积占比(10.36%),这说明小分子组分对于含半胱氨酸小麦肽标记后的荧光值的贡献高,即相对分子质量<1 000 Da的组分中巯基的含量更高。
用反相高效液相色谱来分析肽段的亲疏水性,出峰时间主要在35~50 min(图5-b),通过标记后的荧光图谱可以看出,标记组分的亲疏水性与富集组分的亲疏水性基本一致。结合相对分子质量分析,含半胱氨酸小麦肽含量高的肽段主要是相对分子质量<5 000 Da中疏水的组分,可以利用该性质指导含半胱氨酸小麦肽的进一步分离富集。

a-相对分子质量分布; b-亲疏水性分析图5 半胱氨酸肽的HPLC表征Fig.5 HPLC characterization of cysteine-containing peptides
3 结论
通过不同的酶解方式制备了含半胱氨酸小麦肽,研究了还原处理对于含半胱氨酸小麦肽制备的影响,采用巯丙基树脂对含半胱氨酸小麦肽进行共价色谱静态吸附并结合mBBr进行标记与表征。结果表明,还原处理能很好地将二硫键转化为巯基,还原的先后顺序对所制备的含半胱氨酸小麦肽中巯基含量影响不大,巯基含量均在(200±20) μmol/g蛋白范围内。经过树脂富集之后巯基含量由原来的(200±20) μmol/g蛋白提高到(994.95±9.31) μmol/g蛋白,富集之后相对分子质量>5 000 Da组分的占比增大,疏水性增大。mBBr能很好地标记含半胱氨酸小麦肽,经标记发现经过富集的肽段中<5 000 Da的组分占比低,但对于荧光的贡献值大,且疏水性组分的贡献要大于亲水性组分。这些发现为含半胱氨酸小麦肽的制备与分离提供了依据。但是,在关于含半胱氨酸小麦肽的研究中,除了改进酶解方法之外,对相对分子质量<5 000 Da疏水性的组分需要进一步的分离与分析。

