合成生物学及其研究进展
严 伟, 信丰学, 董维亮, 周 杰, 章文明, 姜 岷
(南京工业大学 生物与制药工程学院 材料化学工程国家重点实验室, 南京 211816)
合成生物学 (Synthetic biology) 是一门通过合成生物功能元件、装置和系统,对细胞或生命体进行遗传学设计、改造,使其拥有满足人类需求的生物功能,甚至创造新的生物系统的学科[1]。它把“自下而上”的“建造”理念与系统生物学“自上而下”的“分析”理念相结合,利用自然界中已有物质的多样性,构建具有可预测和可控制特性的遗传、代谢或信号网络的合成成分。其研究内容主要可划分为3个层面:1)利用已知功能的天然生物模块构建新型的代谢调控网络使其拥有特定的新功能;2)基因组DNA的从头合成以及生命体的重新构建;3)完整的生物系统以及全新的人造生命体的创建[2]。这种由知识驱动的方法研究能够执行基本生物学现象(如自我组织、自我复制和自我可持续性)的最小生物学系统的重建。此外,目前,人工生物单位(如合成核苷酸或氨基酸)的合成及其在活细胞内部的聚合物中的实现为天然和人工生物系统之间设定了界限。作为一门交叉学科,合成生物学不仅包含基因工程、蛋白质工程等传统学科,同时结合了系统生物学、化学、工程学等其它学科的研究思路,以生物技术和工程化理念为基础,旨在设计与制造以生物为本质的组件与体系,使其达到人类的需求。其研究不仅可以使人们对生命科学中的遗传、发育、疾病、衰老以及进化等现象进行深入探索与解析,同时还可以通过执行一些特殊的生物功能再加工生命系统,从而使得其应用领域更加广阔,加速合成生物系统的工程化进程。
作为一门典型的“汇聚”型新兴学科,近年来合成生物学引起了科学界的高度重视,它的崛起突破了生物学以发现描述与定性分析为主的“格物致知”的传统研究方式,提出了“建物致知”的全新理念,通过生物体系的模拟、合成、简化和再设计,使得人类更加深刻地理解生命的本质。
1 合成生物学的主要研究内容
合成生物学引入工程学理念, 强调生命物质的标准化, 对基因及其所编码的蛋白表述为生物元件或生物积块, 对元件所做的优化、改造或重新设计称为“元件工程”(图1);由元件构成的具有特定生物学功能的装置称为“生物器件”或“生物装置”; 对基因元件组成的代谢或调控通路表述为基因回路、或基因电路、基因线路; 对除掉非必需基因的基因组和细胞表述为简约基因组和简约细胞等[3]。
1.1 元件工程
在合成生物学中,将复杂的生命系统里最基础、功能最简单的单元统称为生物元件。作为最基础的“零件”,生物元件是合成生物学发展的基材,通过进一步改造可以成为标准化生物元件。目前,常见的生物元件主要包括:调控元件、催化元件、结构元件、操控和感应元件等。这些元件基本上是通过挖掘、搜集、表征和标准化后从自然界中获得。近年来,酶的定向进化改造以及高通量筛选等技术的发展为生物元件的扩充提供了条件。定向进化技术可提高天然酶的恶劣环境耐受性、立体 /区域选择性、底物特异性、催化效率及产物抑制性等特征。孙周通团队通过理性选择 3 种氨基酸密码子作为饱和突变的建构单元,开发了三密码子饱和突变策略[4-5],并成功应用于环氧水解酶和乙醇脱氢酶的立体选择性、区域选择性、底物谱拓展及热稳定性等酶参数的定向改造[6-7]。另外,高通量筛选技术是将多种技术方法有机结合而形成的一种新技术体系,其具有微量、快速、灵敏和准确等特点。Jin等在利用假单胞菌产吩嗪-1-羧酰胺(PCN)时,成功分离并鉴定出强群体感应(QS)和温度调节的启动子PrhlI,最终不仅使新菌株UP46中PCN生物合成的最佳发酵温度从28 ℃升高至37 ℃,而且PCN发酵滴度提高了179.5倍,达到14.1 g/L[8]。由于这些人工元件的种类和数量的不断扩大,符合标准化要求的生物元件被美国麻省理工学院收集并入库,这些元件共同构成合成生物学的元件库,建立与扩充元件库可以使利用合成生物学方法解决生物工程问题变得更加高效、更加规模化,从而推动合成生物学的进程[9]。
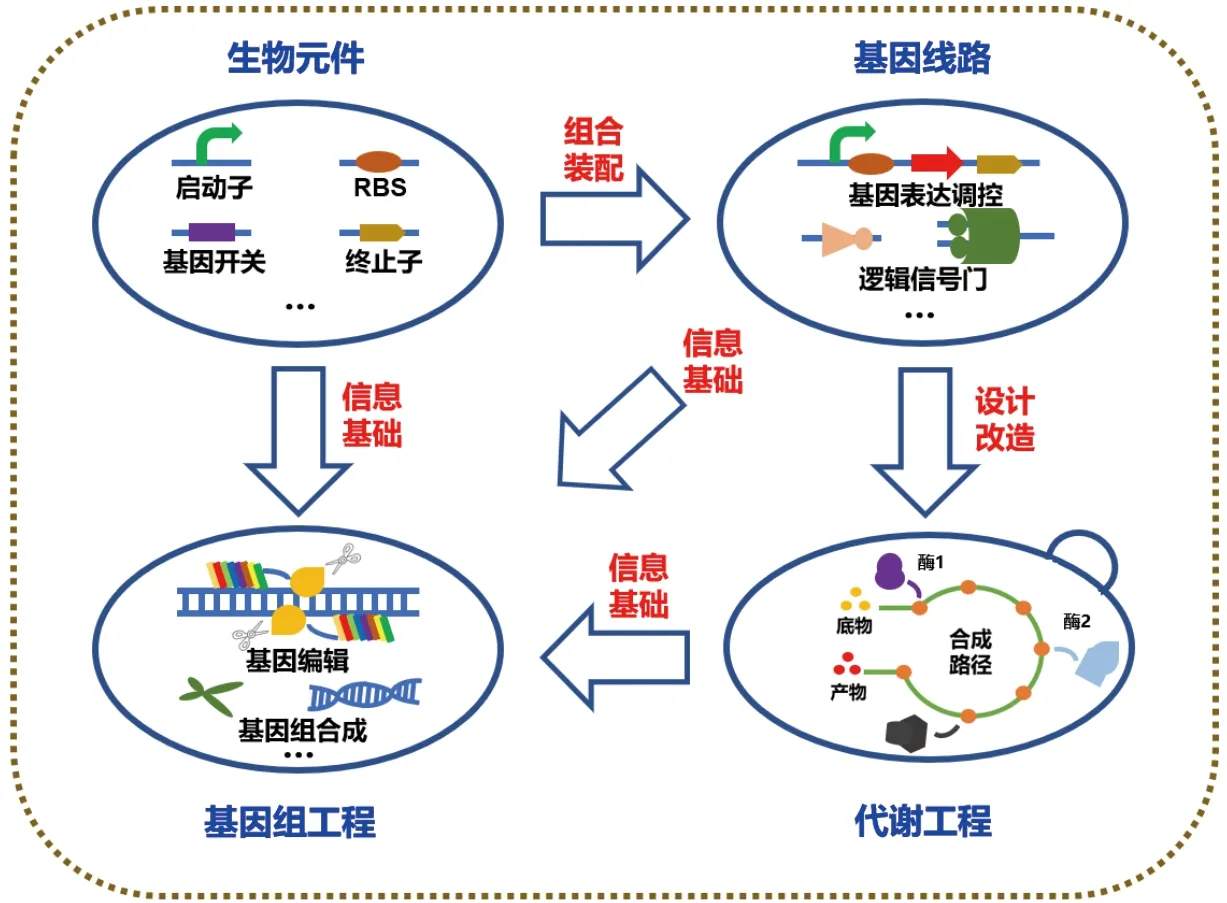
图1 合成生物学研究内容
1.2 遗传线路工程
由启动子、阻遏子、增强子等调节元件及被调节基因构成的遗传装置,同时也是生命体对自身生命过程控制的动态调控系统。人工基因线路通过遗传线路工程合成,主要分为基本型和组合型两类。基本型人工基因线路是依据人类已知的生物学知识,借鉴电路的逻辑控制原理,设计并构建基因开关、放大器、振荡器、逻辑门、计数器等合成器件。它可以在生物中进行定向改造,实现疾病治疗等作用。2000年,Collins 课题组受噬菌体λ开关和蓝藻昼夜节律振荡器的启发,设计出第一个具备生物学特质的转录水平的拨动开关[10]。该开关可以作为基本型遗传开关用于科学研究,并且已经在大肠杆菌中实现了数学模型预测的双稳态效应。此外,Soma等为了使细菌生长和生产的每个发酵阶段的细胞内代谢最优化设计了一个代谢切换开关,通过关闭开关gltA阻止TCA循环消耗过量的碳通量,最终使异丙醇的生产效价和产量分别提高3.7倍和3.1倍[11]。该开关可将负责细菌生长或细胞维持的碳通量重新定向到合成生产途径。组合型人工基因线路是以基本型人工基因线路作为基本元件搭建而成的用于模拟高级生命过程的遗传装置。基于此原理,欧阳颀课题组设计出一种与巴甫洛夫式条件反射类似的可以使细胞只有在条件反射过程后才能对某种刺激作出反应的基因线路[12]。该电路及其合理的设计策略,是实现更复杂的蜂窝计算的关键一步。
1.3 基因组工程
基因组工程是一项能够从头合成或重设计基因组的技术,它的产生主要是由于基因组测序、基因编辑和基因合成等技术的迅速发展。基因组拼装、转移技术等核心技术体系的不断完善有效地加速了合成生物学的发展,同时,新型DNA合成和大规模组装技术的发展,为基因簇甚至全基因组的合成铺平了道路。Venter课题组设计、合成并组装了支原体基因组(JCVI-syn1.0),并将其功能转移到山羊支原体宿主细胞中,产生了新型的具有持续自我复制能力的新支原体细胞,证明了从零开始合成基因组的可能性[13]。自此,人工构建细胞器染色体等基因组重新合成领域不断取得新的进展。从头设计基因组的能力使人们可以根据任意设计原则对基因信息进行工程设计,从而开辟了无需天然基因组作为模板即可构建具有任何所需特性的细胞的可能性。合成基因组技术有潜力提供大量新的和复杂的化学物质。通过设计序列实现设计功能,从而大大拓宽了合成生命的应用范围,推动了其在能源、药物和食品生产中的应用。元英进团队成功实现了酵母5号和10号染色体的化学合成,在人工基因组化学再造方面取得了重大突破。意味着科学界对模式真核生物——酵母的人工基因组建立了精准的化学合成方法,并赋予其持续进化能力,具有重大的学术价值和经济价值[14]。近20年来,随着DNA合成和装配技术的改进,全基因组合成已成为设计和改造整个基因组的替代方法,合成具有与自然发生的基因组相同属性的基因组,可以作为一种验证信息的好方法。但是,基因组等合成仍面临着通量以及成本的极大挑战。
1.4 代谢工程
代谢工程主要是利用分子生物学手段尤其是DNA重组技术对生化反应进行修饰,对已有的代谢途径和调控网络进行合理的设计与改造,以合成新的产物、提高已有产物的合成能力或赋予细胞新的功能。其常用的构建途径是异源表达、细胞代谢反应的构建与调节。通过对代谢网络的解析,可以设计出产品的最佳合成途径,从而提高改造策略应用于合成路径的精确性。代谢工程以设计生物合成途径为基础,产品组合涵盖了简单的化学物质、非天然化合物以及具有复杂立体化学的大型生物分子。多个功能部件之间的协调相互作用,共同构成了一条产品的合成路径。通过整合来自不同生物的部分以构建最佳系统,然后将这些成分转移到所需的宿主细胞中进而设计新型的生物合成途径。周景文团队通过在解脂耶氏酵母中引入异戊烯醇利用途径,使用廉价大宗化学品异戊烯醇为前体,快速产生类异戊二烯合成中间体IPP。同时通过提高胞内脂质含量,增强了类异戊二烯化合物番茄红素的含量[15]。此外,陶勇课题组通过在大肠杆菌中重构鸟氨酸循环,循环利用精氨酸,生产出可析出的胍基乙酸[16]。该研究是首次在大肠杆菌中合成胍基乙酸。重构的鸟氨酸循环有望作为转脒基平台,广泛应用于其他胍基化合物的生物合成。但是,代谢工程仍然存在模块与模块之间,模块与底盘细胞之间不适配的问题,这可能会导致内源性部分的串扰或酶的表达水平不平衡,无法预测性能,可能会阻碍生产过程。因此,需要多个设计-构建-测试-学习周期来有效地引导宿主细胞代谢进入产物合成。例如,可以调节不同酶的基因表达水平以找到最佳平衡,进而改善代谢通量并减少代谢负担或其它副作用[17]。
2 合成生物学的应用研究
随着合成生物学的迅速发展,其拥有的巨大潜力已经引起了全球的争相关注(图2)。目前,从全球研发的产品应用领域来看,其产品已经涉及天然产物合成、生物医药、生物能源、工业等诸多领域(表1)。
图2 合成生物学的主要应用领域

表1 合成生物学的相关应用
2.1 天然产物方面的应用
微生物系统工程用于提高天然产物的生产是合成生物学方法最有效和最普遍的应用之一。Seyedsayamdost和Clardy将天然产物的合成生物学概念划分为3个主要领域。首先,研究已知的药物,如青蒿素或香草,在这些药物中,目标化合物的化学成分及其生物合成途径是众所周知的,代谢工程的主要目标是改进生产,而且往往是在比天然药物更容易控制的宿主体内进行。其次,对存在的未知化合物的研究,这些化合物的存在很容易从细菌基因组的分析中推断出来,但尚未被发现; 在这些情况下,合成生物学的贡献主要是唤醒隐秘代谢物的生物合成,促进它们的化学和功能表征,并最终利用已知的方法实现其过量生产。最后,筛选“未知的未知”,即大量基于当前基因组的发现方法还不能被发现的属于新的化学类别的分子。目前,基于现有的研究成果,在天然产物方面利用合成生物学的技术手段主要有两种:一种是在合适的底盘细胞中异源表达天然产物的合成基因簇[18-20],如番茄红素是一种高价值的类胡萝卜素,在各行各业有着广泛的应用。市场对番茄红素的需求促进了异源宿主对番茄红素代谢工程的研究。Zhang等将来自谷氨酸棒菌ATCC13032的番茄红素合成基因整合到毕赤酵母菌株GS115基因组中以生产番茄红素,通过启动子筛选、前体供给优化和牻牛儿基牻牛儿基二磷酸池扩增,最终在3 L发酵罐中番茄红素产量为9.319 mg/g DCW (0.714 g/L)[21]。Bu等将含有厦门霉素B的生物合成基因ximBCDE的质粒导入缺少天然次生代谢产物的链霉菌中形成苯并杂环衍生物;然后通过使用异戊二烯基转移酶和两种底物混杂酶(XimD和XimE)在厦门链霉菌中成功合成了呋喃香豆素(3.6 mg/L)和吡喃香豆素(3.7 mg/L),首次实现了微生物生产植物代谢产物呋喃香豆素和吡喃香豆素[22]。作为一种天然产物发现与鉴定的有效策略,异源表达不仅成功应用于发现天然产物,同时也为高附加值化合物的过量合成提供了新的策略。另一种是在原始宿主中引入正向调控元件或删除负调控因子等实现相关基因的调控或过量表达[23-25],如张卫文团队在模式蓝细菌Synechocystissp. PCC 6803底盘中成功构建了一条高效的虾青素生物合成途径,通过逐步重构生物合成途径以及合理重构内源性代谢,使虾青素产量增加500倍以上,直接从二氧化碳出发,产生29.6 mg/g(细胞干重)的虾青素。该研究显示了光和蓝藻可作为一种重要的替代底盘实现高效和可持续性地从二氧化碳中生产虾青素[26]。萜烯及其衍生分子在抗肿瘤药物、食品、化妆品及生物燃料方面均有广泛应用,利用工程微生物从可再生原料中生产萜烯可以替代传统的化学法。Liu等通过在酿酒酵母的基因组整合角鲨烯途径,过表达IDP2、IDP3和ANT1,改造乙酰辅酶A代谢途径,并通过杂交细胞质-过氧化物酶体工程酵母提升细胞对角鲨烯的耐受性,最终将角鲨烯的滴度提高到了11.00 g/L,揭示了通过细胞质-过氧化物酶体工程在酿酒酵母过氧化物酶体中过度生产萜烯的潜力[27]。虽然这两种方法是合成天然产物的主要手段,但是由于天然产物的合成路径普遍较长,单菌代谢负荷重、产量仍然较低这一问题始终无法解决。随着科技的进步,多细胞体系的研究为这类复杂代谢路径物质的合成提供了新的思路。通过理性设计与构建人工多细胞培养体系,将代谢路径分配组装到多个独立细胞,可减轻单菌的代谢负担。并且,通过设计与优化单个底盘细胞的代谢能力,可以实现各模块的最佳组合[28]。Zhang等[29]设计了一种新型E.coli-E.coli共培养体系,生产顺,顺粘康酸和4-羟基苯甲酸,这两种化合物都是生产己二酸、对苯二甲酸、肉豆酸和香草醇等高值化合物的重要平台中间体[30-31]。此外,E.coli混合培养系统还被用于合成多种天然产物,如咖啡酰苹果酸等酯化合物[32],α-蒎烯等萜类化合物[33],白藜芦醇等多酚化合物[34]等。除了双菌互作之外,通过构建一个由三株E.coli组成的多细胞系统,可用于迷迭香酸的非线性合成;与单一菌株培养相比,迷迭香酸的产量提高了38倍[35]。将苯丙酸、黄烷酮、黄烷-3-醇和花色苷生产过程中涉及的15个酶转化步骤分配到4个独立的E.coli中,可以实现黄烷-3-醇的首次异源合成[36]。虽然在天然产物研究方面,利用合成生物学的方法取得了一定成果(图3),但是生物合成途径的重新构造随着基因簇的扩大将会变得更加复杂,从而使得新建的表达系统不一定符合预期。因此,设计构建更好的基因编辑系统和选择性能更优的的底盘细胞,将会进一步促进天然产物领域的发展。
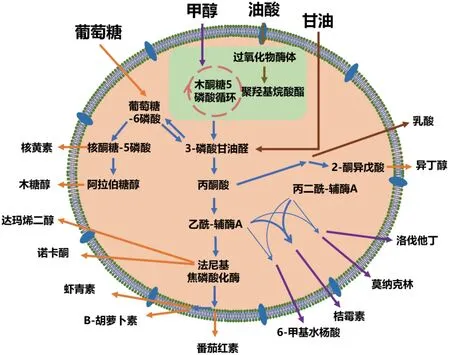
图3 酵母细胞中部分天然产物的合成途径
2.2 医学方面的应用
在医学领域,合成生物学利用人工构建的基因线路实现对人体自身细胞、细菌、病毒等人工生命体的重新改造。这些改造后的生命体可以有效感知各种特殊信号、特异性作用于表现异常的细胞或有问题的区域、表达报告分子或者释放出治疗疾病的针对性药物,从而完成监测人体生理状态和治疗不同疾病的任务。目前,合成生物学已经在感染性疾病、代谢性疾病和癌症等多个领域取得了一定的进展。如通过对大肠杆菌进行基因工程改造可以使其产生特定的化学信号从而干扰霍乱弧菌之间的信息交流,弱化菌株的感染[37];通过在沙雷氏菌属(Serratia)新菌株AS1中表达5个抗疟基因,再利用其能够在按蚊中进行持续跨代传播的特性,使按蚊成为无效的疟疾媒介,可以实现从源头上阻断疟疾传播的目的[38]。张先正课题组设计了一种降解肠道含氮废物的口服微生物组微生态系统,该系统通过不同菌株之间的代谢级联可以有效清除含氮代谢废弃物,有望成为治疗肾衰竭的辅助药物[39]。除此以外,在肿瘤治疗方面,利用合成生物学技术对细菌进行工程化改造也起到了很好的效果。Hasty等在沙门氏菌中植入群体感应系统[40],接着将工程化的沙门氏菌注射进入小鼠体内,随后细菌在体内分裂增殖,当细菌浓度达到一定程度时,死亡程序启动,沙门氏菌开始群体裂解,并释放抗肿瘤毒素杀伤肿瘤。Peng等构建了产生TRIAL蛋白的大肠杆菌,并分离外膜囊泡OMVs作为递送载体,该囊泡αvβ3整合素肽(转移性黑色素瘤标志物)靶向配体(RGP)和ICG修饰,形成具有肿瘤靶向作用的TRIAL和ICG文库(I-P-OMVs),该文库可以诱导皮光-TRAIL-程序化治疗皮肤黑色素瘤,是首个诱导经皮光-TRAIL-程序化治疗黑色素瘤的纳米平台,具有很强的抗肿瘤性能和高安全性[41]。当前的抗血管生成剂普遍缺乏靶向肿瘤的能力,因此会引起与脱靶相关的一系列副作用,包括出血、动脉血栓、高血压、罕见血栓和胃肠道穿孔。Li等通过将筛选得到的血管生成素结合肽通过融合表达展示在fd噬菌体侧面(与噬菌体上的pVIII融合),并将MCF-7乳腺肿瘤归巢肽通过融合表达展示在噬菌体末端,实现了针对乳腺癌的血管生成抑制,藉此实现了针对乳腺癌肿瘤的抑制[42]。除了对细胞进行改造治疗疾病之外,抗生素的使用也是不可或缺的一种手段。利用多细胞发酵法生产抗生素已经被证明是一种有效的方法。共培养Streptomycesclavuligerus和Staphylococcusaureus可以有效合成全霉素[43];共培养Penicilliumpinophilum和Trichodermaharzianum可以合成环孢素C[44];共培养Fusariumtricinctum和F.begonia可以合成对Escherichiacoli、Staphylococcusaureus和Pseudomonasaeruginosa具有抗菌性的抗生素物质SubenniatinsA and B[45]。这些应用充分显示了多细胞体系在抗生素合成方面的潜力。由于具有复杂性、智能性和安全可控性等特点,人工生命体有助于人们对肿瘤、疟疾、菌株感染等疾病的预防、诊断以及治疗,充分发挥合成生物学的作用,引领利用智能生物诊疗的全新时代。
2.3 能源方面的应用
近年来合成生物学的发展使微生物遗传工程得到进一步发展,为生物燃料微生物生产战略的制定提供了强大的动力。利用重组DNA技术,通过修饰特定基因或添加参与生化反应的新基因可以有效改善生物燃料的形成。并且基于代谢组学和13C代谢通量分析得到的通量分布的系统级代谢分析方法已被广泛应用于大肠杆菌和酵母生产生物燃料[46-48]。酿酒酵母是目前利用木质纤维素生产生物乙醇的优良菌株。与实验室培养相比,酵母在工业木质纤维素发酵中受到多种胁迫压力,如高温、高糖和乙酸等。李春团队通过增强酿酒酵母中谷胱甘肽的生物合成途径和乙酸降解途径,增强酵母对活性氧和乙酸升高引起的胁迫的耐受性,其改造后的工程菌株96 h可生产90.7 g/L乙醇。该研究为动态改善酵母鲁棒性的反馈基因线路的合理设计和构建提供了借鉴[49]。Huang等开发了利用重组酿酒酵母在细胞表面展示协同纤维素酶/淀粉酶来克服能量转换限制的整合生物处理(CBP)系统。经过72 h发酵,乙醇生产质量和产量分别达到73 g/L和64%,证明了一种可行的细胞表面展示发酵系统,该系统可用于从色素提取的微藻类材料中直接高密度生产乙醇[50]。由于代谢路径长,菌株代谢负荷重,导致目的产物产量低是目前生物合成普遍存在的问题,针对这一瓶颈,CBP人工多细胞体系目前已被广泛应用于能源物质的生产[51-54]。Patle和Lal利用Zymomonasmobilis和Candidatropicalis的混菌体系转化酶解后的木质纤维素合成乙醇,收率高达97.7%[51];Trichodermareesei,Saccharomycescerevisiae和Scheffersomycesstipitis的混合培养,可实现纤维素酶生产以及己糖和戊糖同时利用,以未经脱毒的稀酸预处理后的麦草浆为底物可直接用于乙醇的生产[55]。另外,近年来,高分子膜材料因其具有良好的力学性质和易于调节的特征引起了国内外研究人员的广泛关注, 通过材料介导固定化技术被成功用于生物乙醇的生产。如利用海藻酸钠-壳聚糖凝胶对S.cerevisiae和Pachysolentannophilus进行包裹共培养生产乙醇,浓度可以达到20.04 g/L[56];将海藻酸钠的固定化技术应用于Clostridiumthermocellum和C.thermolacticum的共培养,可使乙醇的产量提高60%以上[57]。除了生物乙醇之外,多细胞发酵技术和材料介导固定化技术在生物丁醇的生产方面也取得了良好的效果。如生物炭固定的C.beijerinckiiF-6对丁醇的耐受性显著高于游离细胞,并且丁醇的生长强度达到了0.148 g/L·h,提高了20.23%[58]。其次,本课题组通过从自然界天然降解木质纤维素的菌群中筛选和鉴定两株核心功能菌株,成功构建一个偏利共生的人工双菌体系,结合关键功能基因转录水平分析,解析了该人工混菌体系的互作机制,实现直接利用木质纤维素合成燃料丁醇(7.61 g/L);Clostridiumbeijerinckii和Clostridiumcellulovorans组成的人工混菌体系,可转化未经生物处理的麦草生产3.7 g/L乙醇,14.2 g/L丁醇和5.4 g/L丙酮[59]。双菌体系的构建为二代生物燃料和高附加值化学品的合成提供了新思路与技术支持[60]。作为长烷基链组成的高能分子,脂肪酸自然地被细胞利用来储存碳和能量。这些富含能量的分子如今已从植物油和动物脂肪中分离出来。大肠杆菌和酵母中参与脂肪酸生物合成的基因已经得到了很好的挖掘。Liu等设计了一个无细胞体系来系统地识别和了解所有控制乙酰辅酶A转化为脂肪酸的因素,通过敲除fadD、过表达Acc、tesA(来自大肠杆菌)和植物硫酯酶使得工程菌株可产生4.5 g/L脂肪酸[61]。不同于大肠杆菌,酿酒酵母脂肪酸生物合成途径仅涉及编码乙酰辅酶A羧化酶(ACC)和脂肪酸合酶复合物(FAS)的两个基因ACC1和FAS1/FAS2[62]。Weerawat和Jay通过过量表达这两个基因以及消除氧化途径,增加了啤酒酵母天然脂肪酸途径的通量,从而提高了FFAs的产量[63]。另外,酿酒酵母通过过量表达来自不同来源(酿酒酵母、樟脑和大肠杆菌)的ACC1和硫酯酶,以及通过消除氧化途径和醇脱氢酶(ADH)[64],也可以达到过量生产脂肪酸的目的。除了传统的代谢工程手段,在微生物脂质生产方面,Papone等[65]通过共培养Chlorellasp. KKU-S2和TolurasporaglobosaYU5/2,以甘蔗糖蜜为底物时,细胞生物量达到6.90 g/L,油脂产量达到0.33 g/L。虽然利用微生物工程生产生物乙醇、高链醇、脂肪酸和异戊二烯基生物柴油的研究取得了显著进展,但是先进生物燃料的微生物生产仍然需要更多的关注与发展,以达到工业化规模生产。
2.4 工业方面的应用
以绿色环保的途径生产化学品已经是促进经济可持续发展的一个重要趋势。其中,利用合成生物学方法对自然界中微生物进行改造可以提高其利用可再生生物质资源合成不同化学品的能力。通过构建高效的细胞工厂,促进生物制造产业的发展,实现国民经济的绿色环保、可持续发展。在利用微生物发酵合成化学品中存在3个重要指标,分别为转化率、生产速率和产量。对于最优途径进行模块化设计,可以有效提高底物的转化率,减少原料的使用,从而降低生产成本。徐虹团队针对解淀粉芽孢杆菌,首次开发了能够快速基因组无痕修饰的CRISPR-Cas9 Nickase (CRISPR-Cas9n)双质粒系统,利用该系统成功对γ-PGA代谢网络包括底物菊粉水解模块、还原糖代谢模块与γ-PGA合成模块等进行系统代谢改造。最终在7.5 L补料分批发酵罐中γ-PGA的产量高达32.14 g/L。该工作实现了高效炼制菊粉合成γ-PGA的微生物底盘菌株的打造,为后续的γ-PGA多元化分子量调控提供了技术平台,同时为更多高附加值谷氨酸通路生物基产品的开发提供重要研究基础[66]。此外,通过对关键基因进行调控,优化合成途径可以显著提高化学品的生产速率。刘立明团队以大肠杆菌菌株W3110Δ4为模板,通过改变酶的表达水平、利用高效C4-二羧酸转运蛋白增强富马酸向胞外运输能力等方法,最终得到的W3110Δ4-P(H)CAI(H)SC菌株在5 L发酵罐中富马酸产量从原来的3.2 g/L提升至22.4 g/L。该研究优化了完整的非环式乙醛酸代谢途径,为富马酸的高效生产提供了合理的代谢工程和通量优化策略。这些策略在开发生产高附加值化学品的高效微生物细胞工厂方面具有巨大的潜力[67]。Ahn等通过在产琥珀酸曼海姆菌中表达谷氨酸棒杆菌来源的苹果酸脱氢酶,分批发酵产生的琥珀酸产量高达134.25 g/L,生产率高达21.3 g/L·h[68]。与传统的单菌发酵相比,微生物菌群通过在不同细胞间进行“劳动分工”,可完成复杂工作,如复杂底物降解转化、长代谢路径化学品合成等,并对复杂环境具有更强的适应性和稳定性。基于此原理,本团队[69]设计了一种概念验证的偏利共生的CBP双菌共培养体系,可实现直接利用木质纤维素合成琥珀酸(12.51 g/L)。该共培养体系由高效分泌半纤维素酶的嗜热厌氧杆菌M5和合成琥珀酸的放线杆菌130Z组成。嗜热厌氧杆菌M5表达高活性半纤维素酶,可连续将木聚糖转化为木糖供产琥珀酸放线杆菌130Z转化利用,同时木糖的有效转化利用可解除水解底物对半纤维素酶的底物抑制作用。该体系把多个代谢模块分配在不同功能菌株中,有效减轻了菌株代谢负荷,开发了直接利用木质纤维素原料合成化学品丁二酸的技术; 此外,通过共培养T.reesei和Lactobacillisp.可直接利用未解毒的经水蒸气预处理的山毛榉木材,生产19.8 g/L乳酸,相当于理论最高产量的85.2%[70]; Sgobba等[71]设计的E.coli和Corynebacteriumglutamicum混菌体系,实现了从淀粉直接生产L-赖氨酸及其衍生物。E.coli和C.glutamicum菌形成了一个互惠共生的稳定的人工双细胞体系。这些进展预示着人工多细胞体系在木质纤维素等低劣生物质转化利用合成化学品领域的构建也将是未来合成生物学领域发展的一个重要方向。另外,通过材料介导固定化技术同样可以提高这些化学品的产量。用PVA/海藻酸钙混合物制成优良的微球,再采用“冻融”技术将Lactobacillusrhamnosus固定在微球中可进行乳酸生物发酵[72],乳酸的产量为17.6 g/L,达到理论值的97.6%;以芒果提取的木质纤维素/海藻酸钙/聚乳酸复合材料作为Lactobacillusbulgaricus的固定化载体时,可促进乳糖培养基中乳酸发酵[73],其产量和生产强度分别提高了36.4%和36.5%;以聚丙稀微纤维膜作为Actinocacillussuccinogenes固定化载体,葡萄糖为底物发酵产琥珀酸时[74],琥珀酸的收率和生产强度分别达到0.82 g/g和1.04 g/L·h。最后,优化完合成途径,利用进化代谢或者全局扰动等技术对细胞性能进行优化可以进一步提高产量。Lubbers等[75]通过不断提高阿魏酸浓度对黑曲霉进行驯化,6个月后获得的突变体Fa6不仅显示出阿魏酸高耐受能力,同时也提高了将松柏醇转化为阿魏酸的转化率和产量。表明了进化代谢是一种强大的工具,可以改变微生物性能,使其对恶劣条件的耐受性增强,从而有利于各种工业应用。目前,随着合成生物学技术的不断发展,越来越多的大宗化学品可以通过生物法获取,但是能从头合成化学品的全新生物合成途径仍然很少,需要人们进一步地去探索研究。
3 展望
合成生物学的发展正从优化基因元件与模块走向从头设计复杂代谢线路。多细胞体系因可实现代谢功能分工、复杂底物多组分利用及耐受复杂环境等,在医药、食品、化工、环境及能源等领域发挥着不可替代的作用,并已成为合成生物学发展的新方向。而材料介导固定化细胞技术的发展与使用有效地提高了固定化细胞在复杂环境的适应性和生长代谢性能,开发操作简便、效率高、稳定性强及可连续操作的固定化体系将在生物发酵领域内得到更广泛的应用。这些新兴的、热门的技术在各个领域的成功应用充分证明了合成生物学是一项不断发展的技术,已经从非自然部分的简单构造发展成具有可能彻底改变生物医学和生物技术的大规模合成生物系统。目前,在多个领域中已经取得了显著的技术进步,包括DNA的廉价合成,多重、高效和简单的基因工程技术,大量的基因组序列的可用性和新型的化学生物工具的开发,使非自然生物学与自然生物学得到有效结合。越来越多的细胞正在被设计成能够生产各种各样的药物 (包括青蒿素和阿片类药物),以及各种以前只能通过化工炼制生产的化学品。此外,全基因组的体外合成和全基因组介入技术已经开始出现,并产生了可以进一步利用扩大的化学空间来生产蛋白质的大肠杆菌菌株。随着基于web的DNA设计软件和用于管理、工程和分析大型DNA文库的质粒共享工具(如Benchling和Addgene)的发展,定制DNA编码生物系统的设计和合成已经被简化。
在未来,包括先进的基因组编辑、复杂基因网络的组装和计算机辅助设计在内的前沿技术的结合将把合成生物学推向下一个阶段。在细菌、酵母和哺乳动物细胞中设计具有高度复杂的相互连接的、与环境或细胞代谢相结合的合成基因回路和途径,将会提供前所未有的传感器处理和生产能力,为生物制药和细胞疗法带来新的机遇。最终,通过以即插即用的方式结合标准化功能模块设计并通过分子、物理或电子输入编程的全合成细胞将在生物反应器中产生特殊化学物质和药物,或在植入患者体内时诊断和纠正医疗条件。因此,合成生物学必将成为个性化/精准医疗时代的主要支柱。

