肝靶向肽修饰的人内皮抑制素rES-CSP融合蛋白可溶性表达及活性鉴定
余田甜, 张晶晶, 许敏华, 金小宝, 汪 洁, 马 艳
(广东药科大学 生命科学与生物制药学院 广东省生物活性药物研究重点实验室, 广州 510006)
内皮抑制素(Endostatin,ES)是胶原蛋白 XVIII C 末端一个分子质量为20 ku的内源性血管抑制因子[1-2],能够抑制血管内皮细胞增殖、迁移和黏附,以及一些肿瘤细胞增殖和迁移等,具有广谱抗肿瘤作用[3-5]。临床试验发现,ES半衰期短,治疗肿瘤所需剂量较大,又需持续给药[6]。另外,ES在体内各组织均有分布,对正常生理状态下的新生血管形成有潜在的毒副作用[7]。CSP I-plus是疟原虫环子孢子蛋白(Circumsporozoite protein,CSP)N端保守I区;包含保守序列 KLKQP 和硫酸肝素结合序列,是疟原虫子孢子吸附与入侵肝细胞的关键[8],具有肝靶向性。本课题组提出将CSP I-plus与重组人内皮抑制素(Recombinant human endostatin, Endostar, 商品名:恩度)进行融合制备融合蛋白rES-CSP,用于靶向治疗肝细胞癌。
本课题组已成功构建rES-CSP表达载体,并诱导表达出融合蛋白rES-CSP。实验证实该蛋白能够抑制人脐静脉内皮细胞的增殖、迁移、小管形成,抑制鸡胚尿囊膜模型新生血管的形成,同时能与肝癌细胞HepG2靶向结合[9];裸鼠肝癌模型实验表明rES-CSP对肝癌新生血管生成和肿瘤生长具有抑制作用,对裸鼠主要脏器没有明显影响[10]。但此前研究中,诱导表达获得rES-CSP是以包涵体形式存在。包涵体是蛋白质凝聚形成的非常致密颗粒,没有活性,需要经过复杂的变性和复性才能获得有活性的目的蛋白,然而在此过程中容易导致目的蛋白降解而失活[11-12]。本文通过优化诱导表达条件,实现融合蛋白rES-CSP可溶性表达,以便于获得大量的有活性rES-CSP,使该融合蛋白作为药用蛋白大规模生产成为可能。
1 材料与方法
1.1 材料
1.1.1 试剂
恩度(Endostar),山东先声麦得津生物制药有限公司; HisTrap Kit亲和层析填料、XK 16/20层析空柱及HiTrapTM脱盐柱,购自GE healthcare公司;异丙基-β-硫代半乳糖苷(IPTG)、咪唑, 购自Sigma公司;胰蛋白胨、酵母提取物,购自Oxoid公司;Anti-6×His鼠多克隆抗体、山羊抗小鼠IgG HRP标记二抗,购自Santa cruz公司;丙烯酰胺、N,N′-亚甲基双丙烯酰胺和TEMED购自BioRad公司。
1.1.2 载体、菌株和细胞株
表达载体rES-CSP /pET21b、感受态E.coliBL21(DE3)、人肝癌细胞HepG2由广东药科大学广东省生物活性药物研究重点实验室保存。
1.2 方法
1.2.1 rES-CSP/pET21b/BL21重组菌株的诱导表达
将阳性表达载体rES-CSP /pET21b转化到E.coliBL21(DE3)感受态中,涂于含有100 μg/mL Ampicillin的LB平板筛选,挑取单菌落接种到含100 μg/mL Ampicillin LB培养基中,37 ℃,180 r/min,培养过夜。将此菌液按1∶100(V/V)接种到LB培养基中,培养约2.5 h(OD600≈0.6),加入终浓度为0.1 mmol/L的IPTG进行诱导表达。在诱导前、诱导后4 h分别收集菌体进行SDS-PAGE,Bandscan 5.0分析目的蛋白占菌体总蛋白的百分比,选取目的蛋白表达量最高的菌株作为后续试验菌株。
1.2.2 rES-CSP可溶性表达条件的优化
1)诱导温度的优化。按上述方法,将表达量最高的rES-CSP/pET21b/BL21培养至OD600≈0.6,再加入终浓度为0.1 mmol/L的IPTG,分别在20、25、30和37 ℃诱导培养20 h,4 ℃离心收集菌体。用1×PBS洗涤菌体2次,称其湿重,并将菌体按1∶8(W/V)的比例悬浮在裂解缓冲液 (10 mmol/L Tris-HCl,1.0 mmol/L EDTA,pH 8.0) 中,冰上超声裂解,离心,取超声裂解后的总蛋白、离心上清、离心沉淀进行Western Blot检测,确定rES-CSP可溶性表达量最高的诱导温度。
2)诱导时间的优化。方法同1),在rES-CSP可溶性表达量最高的诱导温度下,分别诱导表达5、10、15、20、25和30 h收集菌体,取超声裂解后的离心上清进行Western Blot检测,确定rES-CSP可溶性表达量相对最高的诱导时间。
1.2.3 rES-CSP的纯化及RP-HPLC分析
融合蛋白按优化后确定的诱导温度和诱导时间进行可溶性诱导表达,收集菌体超声裂解,按GE公司KTA purifierTM层析系统UPC 10操作说明,分别采用Ni-NTA亲和层析柱和HiTrapTM脱盐柱对裂解上清纯化和去盐[13],再使用 Millipore Amicon-Ultra-15 10 ku超滤管进行浓缩;最后RP-HPLC检测融合蛋白的纯度。
1.2.4 CCK-8检测rES-CSP对HepG2细胞增殖的影响
将人肝癌细胞 HepG2 5×103个/孔接种于96孔板; 待贴壁后,分别加入终浓度为100、50、25、12.5、6.25 μg/mL rES-CSP或Endostar,5个复孔,培养48 h。加入10 μL CCK-8溶液,继续培养2 h。酶标仪OD450测光吸收值,计算细胞的生长抑制率。抑制率(%)=(1-实验组平均OD/对照组平均OD)×100%。
1.2.5 流式细胞术检测rES-CSP 的靶向性
将含100 μg/mL endostar或rES-CSP的HepG2、Chang’s、A549和HCM细胞,37 ℃培养1 h,不处理组为空白对照。收集各组细胞,4%多聚甲醛固定10 min,加入Anti-ES一抗或同型对照抗体,37 ℃孵育1 h;加入PE标记二抗,37 ℃避光孵育30 min;上流式细胞仪检测细胞表面的荧光强度。
1.2.6 统计学分析
计量资料以平均数±标准差(n=3)表示,数据统计采用SPSS13.0统计软件中的单因素方差分析,以P<0.05作为差异有显著意义。
2 结果与分析
2.1 rES-CSP/pET21b/BL21重组菌株的诱导表达
挑取转化后的3个单菌落进行诱导表达,在诱导前菌体中未出现目的条带,而诱导后的菌体在15 ku和25 ku之间约23 ku处出现目的条带,与融合蛋白分子质量大小相符;Bandscan 5.0分析得知:3株菌表达目的蛋白分别约占总蛋白的32.46%、43.84%和27.41%。因此本实验选用第二个菌株进行可溶性诱导表达(图1)。
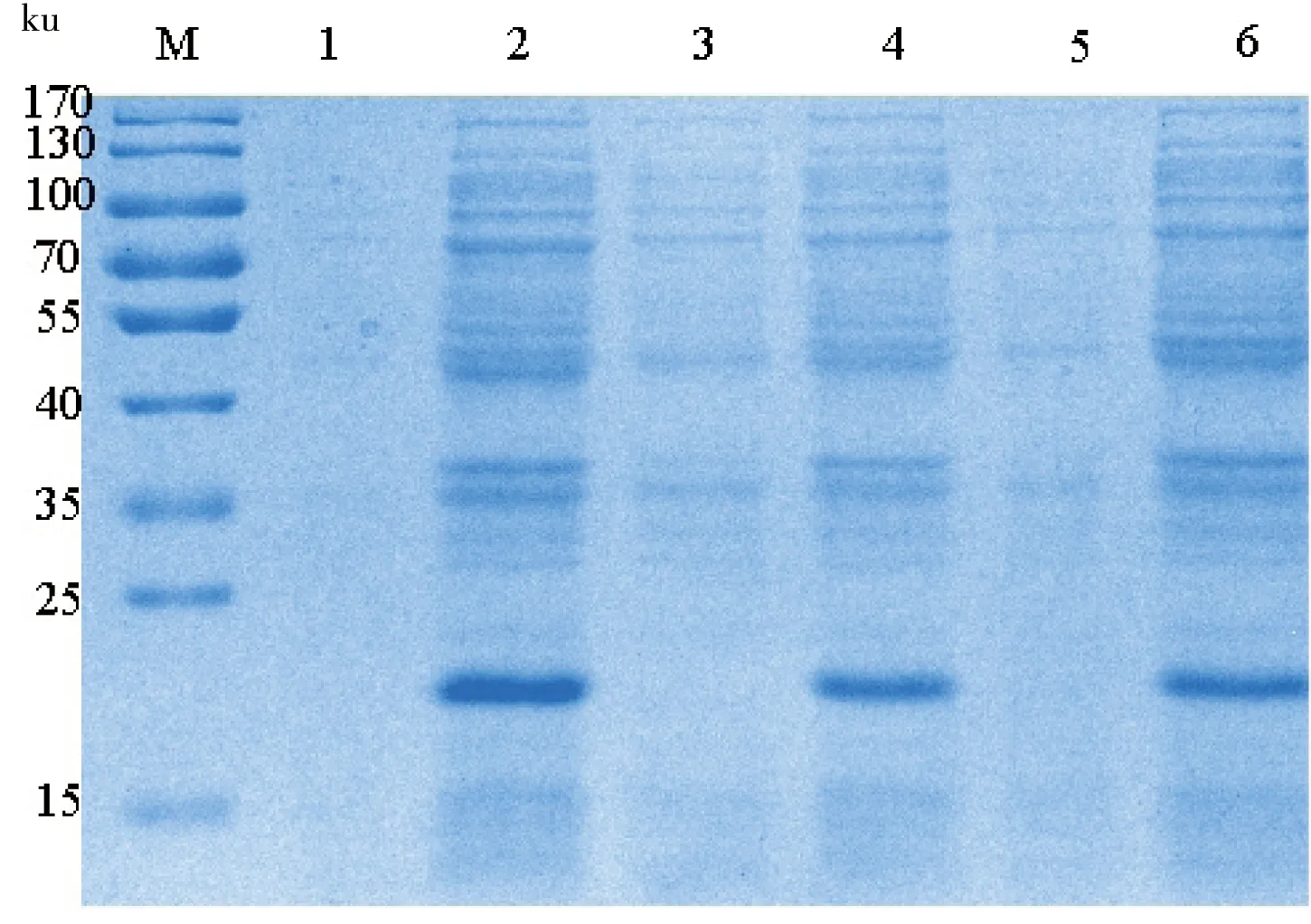
M: Protein Marker; 1、3和5: 诱导前总蛋白;2、4和6: 诱导后总蛋白
2.2 rES-CSP可溶性诱导表达条件的优化
1)诱导温度的优化。温度是影响可溶性诱导表达的主要因素,适当降低温度能有效地增加目的蛋白可溶性比例。为了获得可溶性rES-CSP,考察了20 ℃、25 ℃、30 ℃和37 ℃ 4个诱导温度对目的蛋白可溶性表达水平的影响。Western Blot结果表明,在25 ℃,rES-CSP可溶性表达量最高,且具有统计学差异(P<0.05)。随着温度升高,rES-CSP可溶性表达量降低,在37 ℃时主要为包涵体表达(图2)。
2)诱导时间的优化。诱导时间对目的蛋白的表达量及其活性的影响较大[12]。为了获得更多可溶性目的蛋白,考察了6个诱导时间对融合蛋白可溶性表达水平的影响。Western Blot结果显示,随着诱导时间延长可溶性表达量增加,达到饱和后不利于目的蛋白表达。从统计结果看出在诱导时间为20 h时,rES-CSP可溶性表达量相对较高(P<0.05),具体见图3。
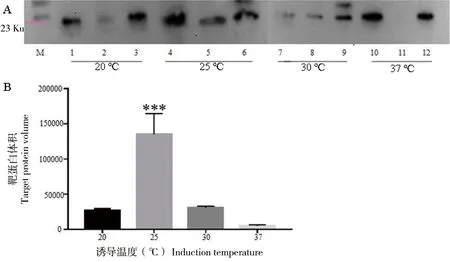
A为Western Blot印迹分析rES-CSP/pET21b/BL21在不同温度下的表达(1、4、7和10裂解总蛋白, 2、5、8和11为裂解上清, 3、6、9和12为裂解沉淀);B为Bandscan 5.0扫描分析裂解上清液中靶蛋白的体积
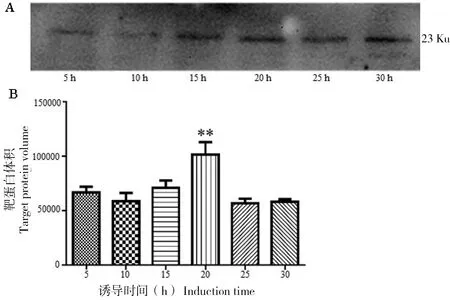
A为Western Blot分析不同诱导时间的裂解上清液中的靶蛋白;B为Bandscan 5.0扫描分析靶蛋白的体积
2.3 rES-CSP可溶性融合蛋白的表达纯化及RP-HPLC分析
可溶性诱导表达的菌体经超声裂解后收集上清,采用Ni-NTA亲和层析柱进行纯化,在洗脱液体积20~30 mL之间,有一特异性洗脱峰,SDS-PAGE结果表明此洗脱峰为rES-CSP可溶性融合蛋白目的峰(图4); RP-HPLC显示 rES-CSP纯度高达98%以上(图5)。

图4 rES-CSP融合蛋白纯化洗脱峰形图(A)和SDS-PAGE分析(B)

柱子规格:Venusil ASB C18(T) 4.6×150 mm;条件:流动相体系水∶乙腈(90∶10);流速0.5 mL/min
2.4 rES-CSP 融合蛋白对HepG2细胞增殖的影响
为了确定可溶性融合蛋白rES-CSP的生物学活性,首先采用CCK-8法检测了rES-CSP对人肝癌细胞HepG2增殖的影响。结果显示,rES-CSP能抑制HepG2增殖,并具有剂量依赖性。与Endostasr相比,rES-CSP对HepG2抑制作用明显增强(图6)。
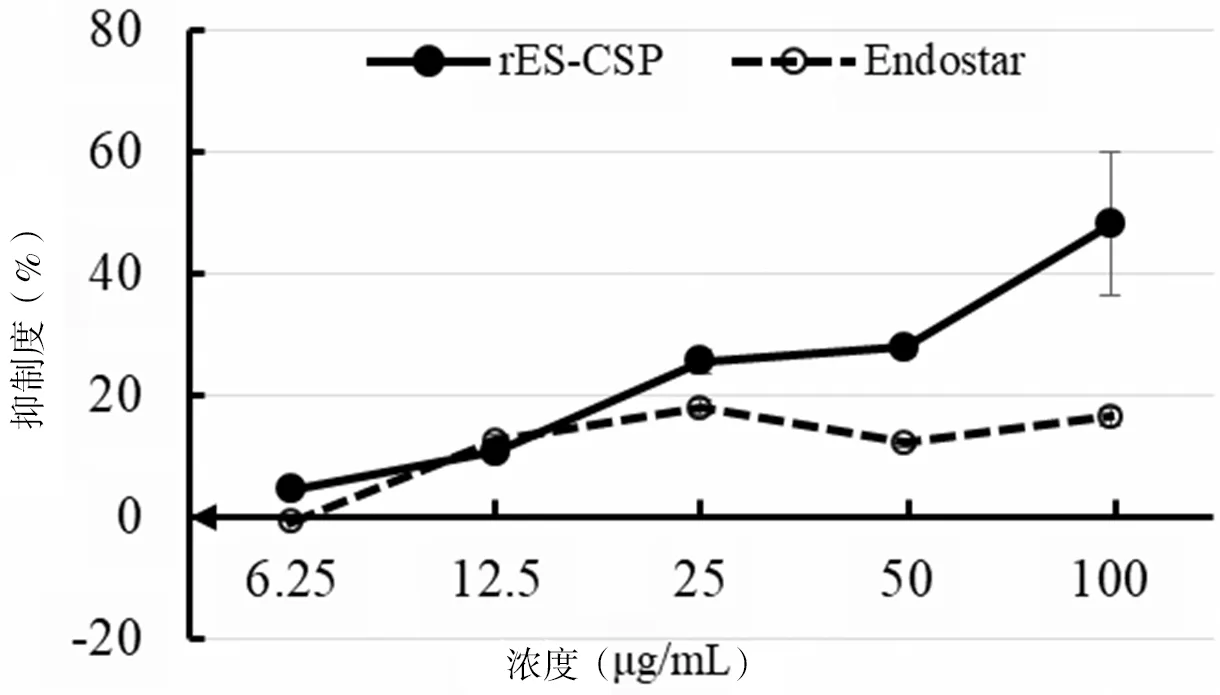
图6 Endostar和rES-CSP对HepG2的48 h作用分析
2.5 流式细胞术检测rES-CSP 的靶向性
流式细胞仪检测结果表明:与Endostar相比,rES-CSP在人肝细胞Chang’s和人肝癌细胞HepG2中的荧光强度显著增强;而rES-CSP在人肺癌细胞A549和人心肌细胞HCM中的荧光强度与Endostar无明显差异。说明CSP I-plus 修饰的内皮抑制素与肝细胞和肝癌细胞结合能力增强,尤其与肝癌细胞结合能力具有显著性差异(P<0.05),见图7。

图7 流式细胞术检测融合蛋白与不同来源细胞的结合能力
3 讨论与结论
蛋白质动力学模型研究表明,蛋白合成速率、蛋白折叠速率和蛋白聚集速率共同决定了活性蛋白的产率。降低重组蛋白合成速率有利于提高重组蛋白的可溶性表达水平。常用的方法有降低培养温度、改变培养基成分、选择合适的诱导条件。一般情况下通过调节培养基pH值,诱导剂IPTG浓度,起始菌的浓度,融合蛋白的等电点,诱导温度和诱导时间等实现目的蛋白的可溶性表达[10-11,13-14]。而大肠杆菌最适生长温度是37 ℃~39 ℃,大肠杆菌表达系统在此温度下诱导表达的外源蛋白含量较高,但极易形成包涵体;而在低温条件下诱导表达,能有效地增加外源蛋白可溶比例,降低可溶性蛋白的降解速率,提高其稳定性[15]。一般大肠杆菌培养下限温度为8 ℃~10℃,此时大肠杆菌将停止表达外源蛋白[16]。诱导时间影响大肠杆菌表达可溶性外源蛋白含量,如果诱导时间过短,会造成目的蛋白产量偏低,如果诱导时间过长,绝大部分目的蛋白往往会以包涵体的形式表达,杂蛋白量也会相对提高[17]。
本研究首先在常规条件下诱导表达,获得目的蛋白分子质量大小约23 ku,与预期的融合蛋白分子质量大小一致。后续对影响融合蛋白可溶性表达的主要因素诱导温度和诱导时间进行优化,Western Blot结果表明:在20 ℃、25 ℃和30 ℃实现目的蛋白可溶性表达,其中在25 ℃,rES-CSP融合蛋白可溶性表达量最高;随着诱导时间延长rES-CSP可溶性表达量增加,当诱导时间为20 h时,rES-CS表达量达到最高;最后确定rES-CSP可溶性诱导表达条件:温度25 ℃,时间20 h。融合蛋白rES-CSP的N端带有6×His标签,能与金属Ni2+特异性结合,采用Ni-NTA亲和层析柱分离纯化,获得高纯度融合蛋白rES-CSP。CCK-8结果显示rES-CSP对HepG2细胞有生长抑制作用且具有浓度依赖性;此外,流式细胞术发现,与Endostar相比,可溶性rES-CSP与肝细胞和肝癌细胞的结合能力增强,说明可溶性rES-CSP具肝靶向性。该研究确定了融合蛋白rES-CSP可溶性表达条件,使其大规模生产成为可能,为进一步研究其生物学活性及药物开发奠定基础。

