滦河秋季大型底栖动物群落结构空间格局与关键环境影响因子识别
沈月含,丁 森,王 慧,代 阳,安瑞永,张晓娇,高 欣*
1.河北师范大学生命科学学院,河北 石家庄 050024 2.中国环境科学研究院,环境基准与风险评估国家重点实验室,北京 100012
河流生态系统是一种典型的空间异质性生态系统,了解其物理、化学与生物要素在纵向、横向、垂向及时间等四维上的变化是解释河流生态系统结构与过程的基础.如河流连续统理论,从生态系统结构(水生生物群落组成)与功能(生产力/代谢率)的角度描述了河流自上而下纵向的变化规律[1].河流生态系统空间异质性研究对于水生生物多样性保护及流域管理有重要意义.通过分析流域水生生物空间异质性格局,有助于识别高生物多样性区域[2],或针对稀有和敏感物种制定专项保护计划[3].此外,异质性格局也是优化河流监测站点的可靠依据.Gomes等[4]基于水体理化指标的空间差异特征,优化了河流水质监测方案.由此可见,研究水生生物空间异质性格局,对水生态监测体系建设具有重要科技支撑作用.
大型底栖动物是河流生态系统的重要组成类群,常被用来指示或评价河流生态健康状况[5-7].大型底栖动物在流域内的空间异质格局,理论上与自然地理分布、环境压力梯度和生物竞争过程有关[8].其中,环境压力作为流域管理对象,对大型底栖动物空间分布的影响机制获得了众多关注[9-10].渠晓东等[11]研究表明,流域土地利用、水污染和河道物理结构是驱动流域大型底栖动物分布的重要因素.李飞龙等[12]分析了不同水生态区内影响EPT敏感类群分布的环境要素.以上研究均明确识别了造成流域大型底栖动物物种空间分布和群落退化的环境要素,为制定目标明确的流域保护恢复策略提供了理论基础.然而,由于流域自然环境特征和环境压力类型和强度不同,造成影响生物分布的环境要素也存在较大差异性[13],因此有必要结合研究区域的环境条件特征分析水生生物和环境要素之间的关系.
滦河属北方季节性河流,是京津冀地区重要的水源涵养区和生态廊道.尽管已有相关研究报道了滦河流域大型底栖动物群落组成和多样性评估[14-16],但尚未开展大型底栖动物空间格局以及同环境要素的响应关系研究.该研究以2016年秋季滦河流域大型底栖动物监测数据为基础,通过分析其群落结构组成与空间分布特征,并结合相关水体理化和生境质量指标,探讨大型底栖动物群落结构与环境因子之间的关系,以期为滦河流域水生态保护修复提供参考.
1 材料与方法
1.1 研究区域概况
滦河是海河流域四大水系之一,也是华北地区第二大独立入海的河流,位于海河流域最北部.滦河发源于河北省张家口市境内的巴彦古尔图山北麓,流经内蒙古自治区、河北省及辽宁省的25个市县(旗),于河北省乐亭县兜网铺注入渤海,全长885 km,流域总面积5.8×104km2.滦河流域在河北省境内(115°30′E~119°45′E、39°10′N~42°40′N)包括滦河水系、冀东沿海诸河及于桥水库上游的州河,流经张家口、承德、唐山、秦皇岛等4市35县.2016年10—11月,调查组在参考国控和省控监测断面的基础上,于滦河流域(河北省)设置了53个调查样点(见图1),样点覆盖滦河干流及一级支流,包括干流13个样点和支流40个样点.

注:不同形状表示根据底栖动物组成的空间聚类分组.●为第1组,表示滦河干流的中下游及支流下游河段的样点;▲为第2组,表示主要分布在支流上游河段的样点;★为第3组,表示主要分布在滦河干流中上游河段的样点.图1 滦河流域(河北省)调查样点分布Fig.1 Location of sampling sites in the Luanhe River Basin of Hebei Province
1.2 样品采集与分析
每个调查样点设置100 m河段作为采样区,对于可涉水的山溪型河段,选取3个不同生境类型断面,使用索伯网(采样面积0.09 m2,孔径0.25 mm,KH055-suber,北京中西华大科技有限公司)采集大型底栖动物;对于不可涉水河段或软底质河段,随机选取3个断面,使用彼得森采泥器(开口面积为1/16 m2,PBS-411,武汉彼得森科技有限公司)采集大型底栖动物.样品经40目(25 mm)筛网筛洗,逐一挑拣所有大型底栖动物,样本保存于95%乙醇中并带回实验室进行形态学分类鉴定.根据相关鉴定资料[17-18],对所有样本进行鉴定,绝大多数物种鉴定到属或种.统计并计算调查样点不同大型底栖动物分类单元的个体数量和密度[19].
为避免大型底栖动物现场采集对水质指标测定干扰,于生物采样点位上游50 m采集水样.采用HORIBA型水质分析仪(D-70,日本株式会社堀场制作所)现场测定水温(WT)、pH、DO、电导率(Cond)和总溶解固体(TDS).采用HACH浊度仪(2100QIS,美国哈希公司)测定浊度(Tur).将采集的水样进行冷藏保存,带回实验室并参照《水和废水监测分析方法》对ρ(TN)、ρ(TP)、ρ(NH4+-N)、ρ(CODMn)等指标进行测定.现场采用人工评分方法对河流生境质量进行评价,评价指标包括底质、栖境复杂性、速度-深度结合、堤岸稳定性、河道变化、河水水量状况、植被多样性、人类活动强度和土地利用类型等10项.单项满分20分,总分200分,得分越高表示样点生境质量越好[20].为减少主观影响误差,所有调查样点均由一人进行评分.
1.3 群落结构指标
选取Shannon-Wiener多样性指数(H′)和Pielou均匀度指数(J)表征大型底栖动物群落结构,计算公式:
(1)
J=H′/ lnS
(2)
式中,Ni为第i种大型底栖动物分类单元个体数,N为样点总数,S为大型底栖动物总分类单元数.
1.4 数据分析
使用离差平方和法(ward′s method)对大型底栖动物数据进行空间聚类分析,以欧式距离描述不同样点间的空间差异.基于聚类分析结果对样点进行分组,并以保留较多剩余信息并得到较少的组为分组原则.采用非度量多维标度法(non-matric multidimensional scaling,NMS)分析样点间大型底栖动物群落结构相似性.距离测定使用Bray-Curtis 指数,采用自动分析法(中速)进行分析.NMS图展示的是对大型底栖动物群落数据解释率最高的2个轴的结果.针对聚类分组,采用指示种分析(indicator species analysis)计算各组的大型底栖动物指示值(indicator value,IV),以IV>40且P<0.001作为指示物种的筛选标准[21],分析工作在PC-ORD 5软件中完成.
为比较不同分组大型底栖动物多样性指数的组间差异,采用箱体图来展现生物群落指数的组间差异,采用Mann-Whitney U非参数性分析检验任意两组间生物群落指数的差异,以P<0.05作为差异显著水平.为比较各组间环境因子的差异,使用单因素方差分析(one-way ANOVA)进行组间比较,分析工作在SPSS 19.0软件中完成.
使用典范对应分析(canonical correspondence analysis,CCA)识别影响大型底栖动物群落结构变化的环境因子.分析前将大型底栖动物偶见种(出现样点≤2个)去除,对生物数据进行lg(x+1)转化,基于蒙特卡洛排列检验(Monte Carlo test)[22]筛选对大型底栖动物群落结果有显著影响的环境因子(P<0.05),分析工作在CANOCO 4.5软件中完成.
2 结果与分析
2.1 滦河大型底栖动物群落结构
共采集鉴定出大型底栖动物206种,隶属于8纲22目70科144属.扁形动物门和线虫动物门各有1纲1目1科1种;环节动物门2纲4目5科12种;软体动物门2纲4目10科20种;节肢动物门种类最多,包含2纲12目53科160种.纹石蚕(Hydropsychesp.)和东方蜉蝣(Ephemeraorientalis)为优势物种,相对多度分别为12.6%和10.8%.其中,东方蜉蝣和霍甫水丝蚓(Limnodrilushoffmeisteri)出现频率最高,均在50%以上的样点出现[13].大型底栖动物分类单元变化范围为4~27个,平均值为14.8个,密度范围为44.4~4 244.4 ind./m2,平均值为892.5 ind./m2.
2.2 滦河大型底栖动物空间分布格局分析
基于大型底栖动物群落结构相似性,所有样点被分为3组(见图2).第1组分布较为广泛,主要为滦河干流中下游及支流下游河段,样点数为24个,根据计算结果无指示物种;第2组分布于支流上游河段,样点数为12个,指示物种为纹石蚕(IV=67,P=0.000 2)、朝大蚊(Antochasp.)(IV=45,P=0.000 6)和中华小长臂虾(Palaemonetessinensis)(IV=62,P=0.000 2);第3组分布于干流中上游河段,样点数为17个,指示物种为东方蜉蝣(IV=56,P=0.000 6)和中华齿米虾(Neocaridinadenticulatesinensis)(IV=63,P=0.000 2).NMS分析表明,第2组与第1组和第3组在空间上基本分开,第1组与第3组有部分样点重叠(见图3).

图2 基于大型底栖动物群落结构相似性的样点聚类分析结果Fig.2 Cluster analysis of sampling sites according to macroinvertebrate communities similarity
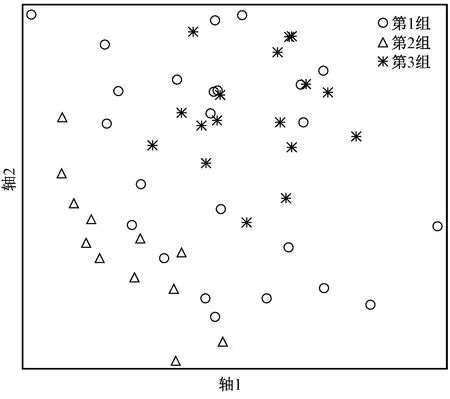
图3 基于聚类分析的大型底栖动物NMS分类结果Fig.3 NMS classification results of macroinvertebrate communities based on cluster analysis
2.3 滦河大型底栖动物群落多样性分析
三组间生物参数的结果表明,分类单元数和密度从第1组至第3组逐渐升高,第2组的Shannon-Wiener多样性指数和Pielou均匀度指数均低于其他两组(见图4).Mann-Whitney U检验结果(见表1)表明:
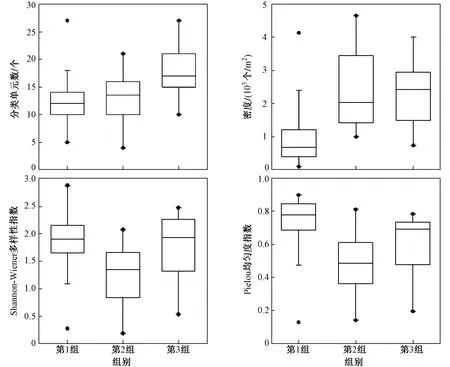
图4 滦河大型底栖动物生物参数组间比较结果Fig.4 Comparisons of macroinvertebrate metrics among different cluster groups in the Luanhe River

表1 滦河不同分组间大型底栖动物生物参数的Mann-Whitney U检验结果Table 1 The results of Mann-Whitney U test of macroinvertebrate metrics among different cluster groups in the Luanhe River
滦河干流中下游、支流下游、支流上游组间大型底栖动物的密度、Shannon-Wiener多样性指数和Pielou均匀度指数均呈显著差异(P<0.05);滦河干流中下游、支流下游、干流中上游组间分类单元数、密度和Pielou均匀度指数均呈显著差异(P<0.05);支流上游、干流中上游组间分类单元数呈显著差异(P<0.05).
2.4 滦河大型底栖动物关键环境影响因子识别
如表2所示,第1组的WT、ρ(TN)、ρ(CODMn)、Tur、Cond、ρ(TDS)较高;第2组的pH、ρ(TP)较高,底质、栖境复杂性、河道堤岸稳定性等栖息地质量状况均较好;第3组的pH、温度、ρ(TDS)等水质状况均较低.单因素方差分析表明,pH、ρ(TN)、底质、河道变化、水质状况和河岸土地利用类型等在第2组和第3组之间差异显著(P<0.05).
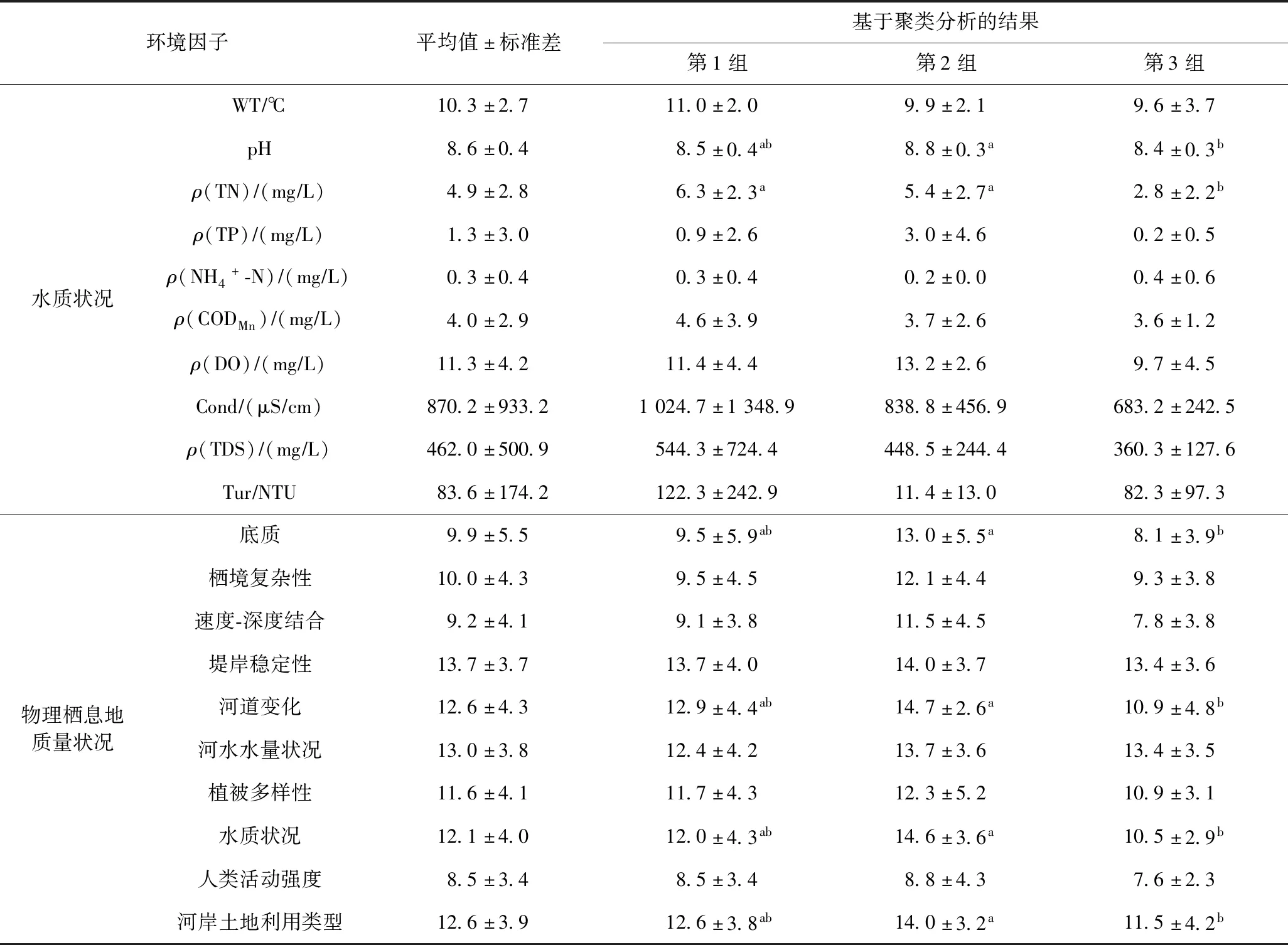
表2 滦河流域水质及物理栖息地状况Table 2 Water quality and physical habitat status in the Luanhe River Basin
CCA结果表明,影响滦河流域大型底栖动物空间分布的是栖境复杂性、河水水量状况和河岸土地利用类型等3个生境质量参数(见图5).3个参数均对第1轴贡献较大.第1组样点较分散,分布于栖境复杂性、河水水量状况和河岸土地利用类型的正方向上;第2组样点主要在第2、3象限,分布于河岸土地利用类型的正方向上;第3组样点主要在第1象限,分布于栖境复杂性的负方向上.该研究结果表明,第3组栖境复杂性较低,土地利用类型在第2组得分较高,生境质量较好,河水水质状况得分较高.猛摇蚊(Chironomusacerbiphilus)、费塔无突摇蚊(Ablabesmyiaphatta)、参差仙女虫(Naisvariabilis)等分布于生境质量较低河段(见图6).

注:riparian land use表示河岸土地利用类型;flow condition表示河水水量状况;habitat complexity表示栖境复杂性.下同.图5 滦河流域环境因子与采样点的CCA排序图Fig.5 CCA ordination diagrams of environmental factors and sampling sites in the Luanhe Rive

注:sp1—格氏星齿蛉;sp2—东方蜉;sp3—奇埠扁蚴蜉;sp4—雅丝扁蚴蜉;sp5—锯形蜉属一种;sp6—长尾锐利蜉;sp7—安图小蜉;sp8—双翼二翅蜉;sp9—假二翅蜉;sp10—四节蜉;sp—11—拟细裳蜉;sp12—细蜉;sp13—暗色细翅石蚕;sp14—纹石蚕;sp15—短线短脉纹石蚕;sp16—小石蚕;sp17—长角石蚕;sp18—黑头原石;sp19—细带斑孔龙虱;sp20—小雀斑龙虱;sp21—豹斑龙虱;sp22—日假爱菲泥;sp23—七纹尾蟌;sp24—二色瘦蟌;sp25—青纹瘦蟌;sp26—赭细蟌;sp27—条纹色蟌;sp28—白扇蟌;sp29—白尾灰蜻;sp30—异色多纹蜻;sp31—梅拉亚春蜓;sp32—雅大蚊A种;sp33—大蚊;sp34—朝大蚊;sp35—短柄大蚊;sp36—双叉巨吻沼蚊;sp37—毛头瘤虻;sp38—长跗摇蚊属A种;sp39—苔流长跗摇蚊;sp40—溪流摇蚊;sp41—猛摇蚊;sp42—喙隐摇蚊;sp43—三段二叉摇蚊;sp44—德永雕翅摇蚊;sp45—绿倒毛摇蚊;sp46—小云多足摇蚊;sp47—云集多足摇蚊;sp48—双线环足摇蚊;sp49—白色环足摇蚊;sp50—三轮环足摇蚊;sp51—三束环足摇蚊;sp52—长铗无突摇蚊;sp53—费塔无突摇蚊;sp54—花翅前突摇蚊;sp55—划蝽属一种;sp56—横纹划蝽;sp57—斑;p58—参差仙女虫;sp59—霍甫水丝蚓;sp60—苏氏尾鳃蚓;sp61—八目石蛭;sp62—苇氏巴蛭;sp63—腹平扁蛭;sp64—宽身舌蛭;sp65—宁静泽蛭;sp66—椭圆萝卜螺;sp67—直缘萝卜螺;sp68—耳萝卜螺;sp69—卵萝卜螺;sp70—狭萝卜螺;sp71—大脐圆扁螺;sp72—赤豆螺;sp73—纹沼螺;sp74—光滑狭口螺;sp75—东北田螺;sp76—中华圆田螺;sp77—梨形环棱螺;sp78—闪蚬;sp79—河蚬;sp80—湖球蚬;sp81—中华小长臂虾;sp82—日本沼虾;sp83—中华齿米虾;sp84—淡水涡虫.图6 滦河流域环境因子与物种的CCA排序结果Fig.6 CCA ordination diagrams of environmental factors and species in the Luanhe River Basin
3 讨论
该研究发现滦河流域大型底栖动物空间分布可分为3组.第1组栖境复杂性较高;第2组生境质量最好,生物多为相对清洁指示物种;第3组栖境复杂性较低,反映了生境质量对生物多样性的支撑作用.影响滦河流域大型底栖动物分布的主要是生境质量参数,包括栖境复杂性、河水水量状况和河岸土地利用类型,这反映出滦河流域大型底栖动物多样性保护的重点是生境质量的恢复.
3.1 大型底栖动物空间异质性分析
水生生物空间格局受自然分布和环境压力的共同影响[8].该研究也证实了这一点,发现滦河大型底栖动物的空间格局体现了自然地理环境和人类活动干扰的差异[23].第1组因涉及流域范围较广,样点生境类型多样,物种组成复杂,未筛选出代表性指示种.整体来讲,第1组的电导率(Cond)、浊度(Tur)较高,生境质量处于中等水平.第2组包含样点较少且集中分布在几条支流上游,指示种为纹石蚕、朝大蚊和中华小长臂虾.纹石蚕和朝大蚊主要分布于高溶氧的急流河段,中华小长臂虾属于中度耐污种,多在山地流水中栖息,而第2组生境质量评分较高,河道生境质量较好、河岸干扰破坏较小(见表2),说明指示种生态特征与河流生境质量吻合.第3组指示种为中华齿米虾和东方蜉蝣,属于中等耐污类群[24],前者栖息于滦河下游干流缓流河段,后者栖息于沙质底急流河段.该区域栖境复杂性较低,生境质量破坏较为严重,生境评分结果相对较低.滦河流域下游大部分是平原地区,比上游的人类活动较强烈[25].Shannon-Wiener多样性指数和Pielou均匀度指数的分析结果显示,第1组Shannon-Wiener多样性指数高于第2组,第1组Pielou均匀度指数高于第2组和第3组,生境类型的多样化可以为底栖物种提供更丰富的栖息地条件,从而Shannon-Wiener多样性指数和Pielou均匀度指数也相对较高,这与Bronmark等[26]研究结果基本一致.NMS的结果可以看出,第2组与第3组以及第1组与第3组均明显分离,说明第2组的物种组成更为独特;第1组和第3组部分重叠,表明群落组成方面有更多的相似性,而第3组分布相对集中,与上述生境和指示物种的分析结果相一致.另外,底栖动物的种类、数量等与采样季节也有很大关系,该次采样为秋季,水文条件稳定,收集的底栖动物类型较为完整[27].与同属海河流域的黑龙港运东水系相比,滦河大型底栖动物的种类较多,数量变化较为明显.随着工农业的逐渐发展,南运河、支漳河等黑龙港运东地区污染较为严重,人类活动导致大型底栖动物生物多样性降低,寡毛类和摇蚊类分布较多[28].与淮河流域的河流相比,滦河水质较好.淮河干流受人为干扰较小,从上游到下游受污染较为严重,闸坝、采砂等导致底栖动物的物种多样性逐渐减少,蜉蝣仅在淮河上游有分布,软体动物在中、下游分布较多.滦河较淮河及海河其他支流河流的水质相对较好.
3.2 大型底栖动物空间分布的环境影响因子
典范对应分析表明,影响滦河大型底栖动物空间分布的关键环境要素是栖境复杂性、水量状况和河岸土地利用类型,该研究结果同其他环境特征较为相似的河流具有一致性[29-30].河岸土地利用类型与栖境复杂性体现了人类干扰强度,河岸带自然植被的开发利用强度会影响河道和底质变化,开发强度的增加会加重水土流失程度,进而影响河流形态、流速、水质等,从而影响底栖动物生存[31-33];栖息地结构越复杂,为底栖动物提供的微生境越多,在城市和工农业生产地,人类活动干扰大,影响水质进而对大型底栖动物的生存产生影响[34].滦河是海河流域水质条件相对较好的河流,生态旅游是当地经济开发特色,因此人类干扰造成的生境质量下降成为影响底栖动物的主要约束条件.调查中发现滦河干流泥沙含量高、生境类型单一、导致底栖动物多样性下降.此外,研究表明河岸土地利用开发会导致栖境复杂性下降、生境消失,间接导致生物多样性降低[35].充足的水量能够保证水生生物正常生存及生态系统稳定[36],滦河中下游属于平原地区,工农业用水和城市用水量较大,加之区域降水条件有限,也对大型底栖动物分布存在影响.
4 结论
a) 滦河大型底栖动物空间分布异质性较高,由于生境质量维持较好,上游支流河段大型底栖动物多样性显著高于中下游河段.
b) 滦河大型底栖动物空间分布主要受栖息地复杂性、河岸带土地利用类型和河道水量状况影响.
c) 滦河生物多样性保护修策略应当以生境质量提升为重点,减少河岸带干扰、恢复河道生境多样性及保障生态流量是未来重要的恢复手段.

