表没食子儿茶素没食子酸对强直性脊柱炎大鼠Th1/Th2免疫平衡、软骨细胞凋亡的影响
郭洪録,郭晓利,李力毅,许永涛
1)长江大学第二临床医学院骨科 湖北荆州 434020 2)阜阳市人民医院肛肠外科 安徽阜阳 236000 3)东部战区南京空军医院骨科 南京 210000 4)荆州市中心医院骨科 湖北荆州 434020
强直性脊柱炎(ankylosing spondylitis, AS)是一种慢性炎症和自身免疫性疾病,主要影响骶髂骨关节和脊柱[1]。尽管该病的主要症状明确,但是AS中促进关节强直的机制尚不明确。推测Th1/Th2细胞因子紊乱导致的炎症可重塑形成新的骨骼,而此过程会导致骶髂骨关节和脊柱强直。AS的本质是一种变态反应性脊柱炎症,软骨细胞在此种炎症反应中起着关键作用[2]。软骨细胞的凋亡现象和特征可在AS患者的软骨组织中出现,这可能是由于关节滑膜组织释放炎症介质导致脊柱软骨组织损伤,从而引起关节软骨的凋亡和炎症[3]。表没食子儿茶素没食子酸(epigallocatechin gallic acid, EGCG)已被证实可改善自身免疫疾病中Th1/Th2细胞因子的失衡[4],在骨关节炎中同样具有抗炎和抗软骨细胞凋亡作用[5]。本研究分析了EGCG对AS小鼠关节中Th1/Th2细胞因子及软骨细胞凋亡的影响,报道如下。
1 材料与方法
1.1动物与试剂雌性SD大鼠,7只,鼠龄42~56 d,体重216~235 g,由中山大学医学院实验动物中心提供,SPF级。纯度为95%的EGCG购于大连美仑生物技术有限公司(货号:MB1672),Trizol试剂购于美国Sigma公司,SYBR Green PCR试剂盒购于上海索宝生物科技有限公司,PCR仪购于美国Bio-Rad公司,IL-2、TNF-α、IFN-γ、IL-4、IL-10、IL-13检测试剂盒均购自美国R&D公司,TUNEL细胞凋亡检测试剂盒由南京建成生物工程有限公司提供,Caspase-3、Bax、Bcl-2、GAPDH抗体均购于美国Abcam公司,BCA试剂盒、HE染色试剂盒以及封片剂均购自上海碧云天生物科技有限公司,番红O购自美国Sigma公司。
1.2动物分组及处理把人类HLA-B27基因DNA导入SD大鼠受精卵中,并移植到7只假孕母鼠输卵管内,21 d后出生128只原代大鼠,HLA-B27转基因过程由赛业(广州)生物科技有限公司完成。经基因检测,确认13只原代大鼠为携带HLA-B27基因的转基因大鼠(其中9只转基因大鼠出生后90 d出现外周关节炎及脊柱强直表现),115只为未携带HLA-B27基因的大鼠。9只转基因大鼠中5只入AS组,4只入EGCG组。EGCG治疗:EGCG组大鼠从出生后第90天开始,每日1次灌胃EGCG(1.0 g/kg),持续20 d。选择未携带HLA-B27基因的大鼠6只入正常对照组。AS组和正常对照组每日灌胃等体积生理盐水,共20 d。
1.3脊柱软骨组织和外周血采集第20天,使用戊巴比妥腹腔注射麻醉各组大鼠,麻醉成功后将其固定于操作台上。行颈正中切口剪开皮肤,游离颈动脉,经颈动脉穿刺放血5 mL,3 000 r/min离心10 min,取血清-80 ℃保存备用。在显微镜下分离脊柱,切除颈椎间盘,完全分离椎软骨终板并用预先冷却的PBS冲洗,去除附着在表面的红细胞以及附着在软骨表面的骨组织和椎间盘纤维组织,将软骨组织于-80 ℃保存备用。
1.4脊柱软骨组织HE、番红O染色将获取的脊柱软骨组织用40 g/L多聚甲醛固定24 h,然后使用TBD-2进行脱钙处理48 h,石蜡包埋,4 μm厚切片。HE染色:将切片置于二甲苯及梯度乙醇进行脱蜡处理,严格按照说明书对切片进行HE染色。番红O染色:切片经体积分数0.5%番红O染液滴染1 min,体积分数95%乙醇分化数秒,风干,二甲苯透明,中性树胶封固。
1.5血清中Th1/Th2细胞因子的检测取大鼠血清,用ELISA法检测IL-2、TNF-α、IFN-γ、IL-4、IL-10、IL-13水平。实验过程参照试剂盒说明书操作。
1.6软骨组织中IL-2、TNF-α、IFN-γ、IL-4、IL-10、IL-13mRNA的检测取大鼠软骨组织,使用Trizol试剂按照说明书提取总RNA,反转录合成cDNA,使用SYBR Green PCR试剂盒进行PCR。反应条件:95 ℃ 2 min;95 ℃ 15 s,60 ℃ 1 min,40个循环。以GAPDH为内参,以2-ΔΔCt方法计算目的基因mRNA相对表达量。IL-2、TNF-α、IFN-γ、IL-4、IL-10、IL-13以及GAPDH引物序列见表1。

表1 引物序列
1.7软骨组织中细胞凋亡率的检测取各组大鼠软骨组织,采用TUNEL法检测凋亡情况,具体步骤参照试剂盒说明书操作。染色后选择10个400倍视野,使用Image J 1.8.0进行图像分析,共计数500个细胞中的凋亡细胞(以细胞核染成棕褐色为凋亡细胞),计算软骨细胞凋亡率。
1.8软骨组织中Caspase-3、Bax、Bcl-2蛋白表达的检测取大鼠软骨组织,提取总蛋白,并用BCA试剂盒检测总蛋白浓度,经过SDS-PAGE电泳分离蛋白质,并将蛋白质转移到硝酸纤维素膜,分别用Caspase-3(1∶400)、Bax(1∶500)、Bcl-2(1∶800)一抗孵育18 h,随后使用二抗(1∶1 000)孵育4 h,加入化学发光液处理后拍照观察,采用Image J 1.8.0进行分析。使用GAPDH作为内参,目的蛋白相对表达量以目的蛋白条带与内参条带灰度值的比值表示。
1.9统计学处理采用 SPSS 17.0进行数据分析。3组大鼠血清IL-2、TNF-α、IFN-γ、IL-4、IL-10、IL-13水平,软骨组织中上述因子mRNA的表达水平,软骨细胞凋亡率,软骨组织中Caspase-3、Bax、Bcl-2蛋白表达水平的比较均采用单因素方差分析,两两比较采用LSD-t检验;血清、软骨组织中IL-4、IL-10、IL-13水平和软骨组织中Caspase-3表达水平的关系采用Pearson相关进行分析。检验水准α=0.05。
2 结果
2.1 3组大鼠脊柱软骨组织的病理表现大鼠脊柱软骨组织番红O和HE染色结果见图1。正常对照大鼠脊柱软骨组织中几乎看不到炎性细胞和纤维细胞浸没;AS大鼠呈现炎性细胞浸润特征,软骨边缘受损,纤维化特征明显。
2.2 3组大鼠血清及软骨组织中Th1/Th2细胞因子表达水平的比较结果见表2、3。可知AS组大鼠血清及软骨组织中IL-2、TNF-α、IFN-γ表达水平高于正常对照组,IL-4、IL-10、IL-13表达水平低于正常对照组;EGCG组大鼠血清及软骨组织中IL-2、TNF-α、IFN-γ表达水平低于AS组,IL-4、IL-10、IL-13表达水平高于AS组。
2.3 3组大鼠软骨细胞凋亡率、软骨组织中Caspase-3表达水平及Bax、Bcl-2的比较结果见图2、3和表4。与正常对照组相比,AS组大鼠软骨细胞凋亡率、软骨组织中Caspase-3蛋白表达水平和Bax/Bcl-2升高;与AS组相比,EGCG组大鼠软骨细胞凋亡率、软骨组织中Caspase-3蛋白表达水平和Bax/Bcl-2降低。
2.4AS组、EGCG组大鼠血清、软骨组织中IL-4、IL-10、IL-13表达水平与软骨组织中Caspase-3表达水平的相关性分析结果见表5、6。
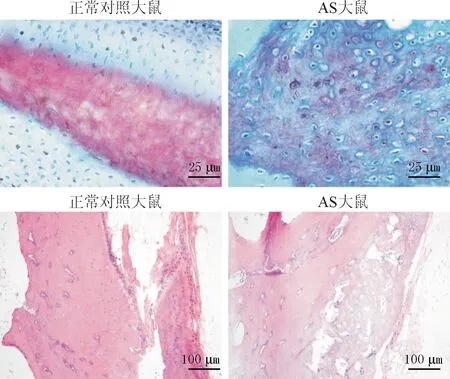
图1 正常对照和AS大鼠脊柱软骨组织番红O(上排)和HE(下排)染色结果

表2 3组大鼠血清IL-2、TNF-α、IFN-γ、IL-4、IL-10、IL-13水平的比较 ng/L

表3 3组大鼠软骨组织中IL-2、TNF-α、IFN-γ、IL-4、IL-10、IL-13 mRNA相对表达量的比较
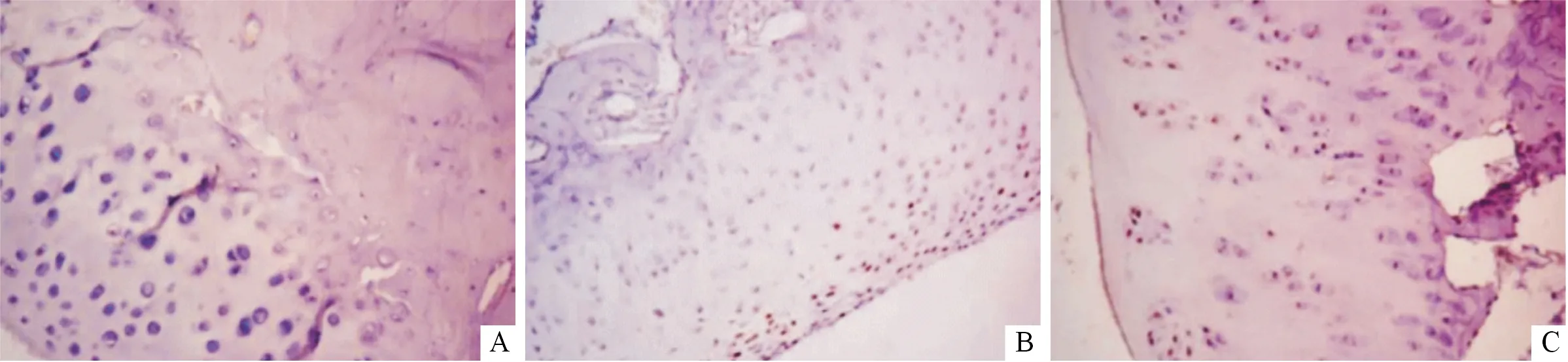
图2 正常对照组(A)、AS组(B)和EGCG组(C)大鼠软骨细胞凋亡情况(TUNEL,×200)
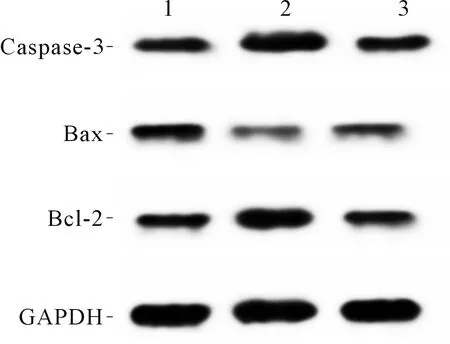
1:正常对照组;2:AS组;3:EGCG组
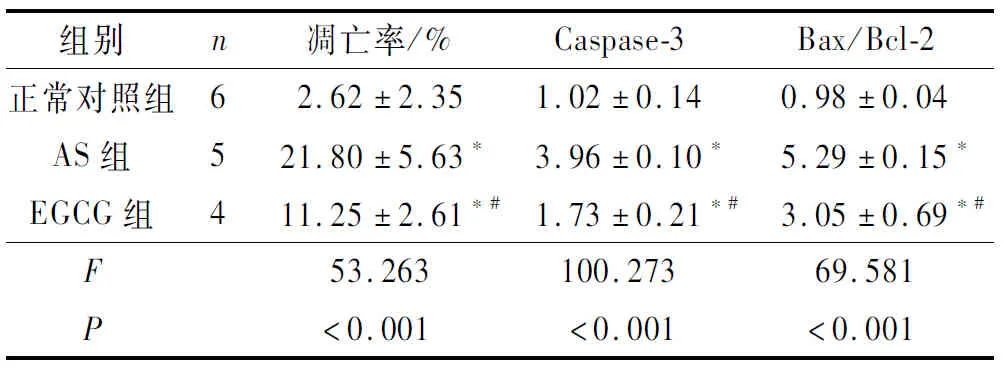
表4 3组大鼠软骨细胞凋亡率、Caspase-3表达水平及Bax/Bcl-2的比较

表5 AS组大鼠血清、软骨组织中IL-4、IL-10、IL-13水平与软骨组织中Caspase-3表达水平的相关性

表6 EGCG组大鼠血清、软骨组织中IL-4、IL-10、IL-13水平与软骨组织中Caspase-3表达水平的相关性
3 讨论
AS患者骨、关节及滑膜组织内有大量炎性T细胞、单核-巨噬细胞浸润,直接导致T细胞应答,T细胞亚群中Th1及Th2的比例发生平衡偏移[6]。研究[7]证实,炎症通路关键调节因子IL-23与AS的发病有关,IL-23/IL-23R的靶向治疗有望成为预防AS的有效方法,而多项研究[8-10]证明IL-23影响自身免疫炎症中的Th1细胞因子水平。另外,IL-6和IL-10等Th2相关细胞因子与AS发病相关[11]。Th1/Th2细胞因子失衡是AS的关键特征之一,寻找有效的调节Th1/Th2药物可能对AS治疗具有帮助。
本研究发现AS大鼠表现为明显的Th1/Th2免疫失衡,即Th1细胞因子(IL-2、TNF-α、IFN-γ)表达明显增加,而Th2细胞因子(IL-4、IL-10、IL-13)表达明显减弱。EGCG组Th2炎症因子的表达水平较AS组增加,而Th1炎症因子的表达降低,但Th1和Th2炎症因子的水平均未恢复至正常对照组水平,表明EGCG具有部分恢复AS大鼠软骨组织和外周血Th1/Th2免疫失衡的作用。
在AS疾病中,关节重塑导致的关节强直与软骨融合有关。AS关节重塑是由软骨的两个表面融合引发的软骨变性所引起,此变性与软骨细胞凋亡和蛋白多糖丢失密切相关。另外,AS患者会表现出软骨退化特征,如组织修复相关基因Sox9的表达降低,BMP-2和BMP-7的表达降低[4]。与之类似,本研究发现AS大鼠软骨细胞凋亡率升高,而且Caspase-3表达水平上调,Bax/Bcl-2也升高,表明AS的发展过程中伴随着明显的软骨细胞凋亡、退化。经EGCG治疗后,AS大鼠的Th1/Th2免疫失衡得到明显的改善,同时脊柱关节中软骨细胞的凋亡率降低,提示调节软骨细胞凋亡和改善Th1/Th2免疫失衡是EGCG改善AS疾病的重要机制[12]。
该实验中还发现大鼠外周血及软骨组织中Th2细胞因子表达水平与软骨细胞中凋亡标志物Caspase-3的表达存在负相关关系。这提示Th1/Th2免疫失衡可能是AS软骨细胞凋亡的免疫学基础。本研究证实,EGCG不仅可以抑制Caspase-3的表达,而且能下调Bax/Bcl-2的比值,发挥抗凋亡的作用[13]。可见Th1/Th2免疫失衡时,可能主要通过细胞因子网络调节细胞凋亡基因的表达,从而起到促进软骨细胞凋亡并促进脊柱炎症形成的作用,而EGCG对此具有一定的改善作用。
综上所述,AS大鼠表现为明显的Th1/Th2免疫失衡和软骨细胞凋亡,Th2细胞因子和凋亡之间存在明显的负相关关系。通过调整Th1/Th2免疫平衡,进而抑制软骨细胞凋亡,是EGCG治疗AS重要机制之一。