婚姻状态对肾癌患者预后的影响:基于SEER数据库分析
罗 培 ,马 虎
(1.遵义医科大学 肿瘤学教研室,贵州 遵义 563099;2.遵义医科大学第二附属医院肿瘤医院 胸部肿瘤科,贵州 遵义 563099)
肾细胞癌(RCC)是泌尿生殖系统常见的恶性肿瘤之一,全球每年约有新发病例335,000例,占全球总病例数的2.4%。因其早期临床症状隐匿,缺乏有效的早期诊断方法,病情进展迅速,致使肾癌成为第三大致命的泌尿生殖系统恶性肿瘤。高血压、吸烟、肥胖等是肾细胞癌的独立预后因素[1-3]。此外,据报道,婚姻状态可能会影响多种肿瘤的预后,包括乳腺癌[4]、前列腺癌[5]、结直肠癌[6-7]等。目前,婚姻状态究竟是通过何种因素来影响肿瘤患者的预后尚不得知。有研究显示临床决策受包括婚姻状态在内的多种因素影响,不同的临床决策可能会导致不同的预后[8]。基于婚姻状态与肾癌患者临床病理特征的关联尚不清楚,我们设计了此研究,通过分析Surveillance,Epidemiology and End Results (SEER)数据库肾癌患者的相关数据,根据婚姻状态,选取性别、种族、婚姻状况、年龄、组织学类型及诊断年份的生存时间来评估生存预后,探讨婚姻状态与肾癌患者预后的关系,以期为临床实践提供参考。
1 资料与方法
1.1 研究对象 选取Surveillance,Epidemiology and End Results(SEER)数据库中 2010 年1月至 2015年12月间诊断为肾癌患者,符合以下条件入组:年龄≥18岁;具有完整的婚姻状态、生存状态、生存时间、组织学分级数据;排除标准:生存时间为0月的患者;婚姻状态、生存状态、生存时间、组织学分级数据缺失的患者。最终43 392例患者纳入本研究。
1.2 方法 采用回顾性队列研究的方法,根据患者的婚姻状态将患者分为已婚组、未婚组和 SDW 组(离异、分居、丧偶);观察的终点指标为总生存时间(Overall survival,OS)。
1.3 统计学处理 应用 Perl 5.26.2软件进行数据提取及处理,应用SPSS24.0软件对资料进行处理;临床频数资料的统计分析使用卡方检验,使用 Kaplan-Meier生存分析(Log-rank 检验)单因素分析及绘制生存曲线,多因素使用 Cox 模型。P≤ 0.05 为差异有统计学意义。
2 结果
2.1 肾癌患者基本资料 本入组患者43 392例,年龄 18~108 岁,平均 (61.17 ± 12.27) 岁;白人占35 716例。4 830例为黑人,2 846为其它种族,组织学分级Ⅰ、Ⅱ、Ⅲ、Ⅳ分别有4 936、22 909、12 812、2 728例(见表 1)。
未婚组中位年龄为56岁,平均(55.28 ± 12.76)岁。 已婚组和 SDW 组分别为中位年龄为62岁,平均(61.46 ± 11.66)岁,中位年龄为66岁,平 均 (65.35 ± 11.94)岁,差 异 有 统 计 学 意 义 (P< 0.05)。 在就诊年份中,2010~2011年段与其他两组差异有统计学意义(P< 0.05),在组织学类型,SDW组中II级的比例最大,与其它两组差异具有统计学意义(P< 0.05)。
2.2 婚姻状态与总体生存期的关系 见表2单因素及多因素Cox回归分析表明相比于已婚组,未婚组肾癌患者总生存期显著性缩短(单因素:HR=1.32,95%CI=1.22~1.42,P< 0.05;多因素:HR=1.03,95%CI=0.94~1.12,P< 0.05),SDW组肾癌患者总生存期与已婚组无明显差别(单因素:HR=0.99, 95%CI=0.91~1.08,P= 0.78;多因素:HR=1.03,95%CI=0.94~1.13,P= 0.61)。
进一步的Kaplan-Meier 生存分析提示:在性别方面,与男性相比,女性组的OS有显著性差异(见图1);在婚姻状态方面,与已婚组相比,未婚组和SDW组的OS显著性降低(见图2);在种族方面,与黑人相比,白人及其他人种的OS无显著性差异(见图3);在患者年龄方面,与1~39岁相比,80+组OS显著性降低(见图4);组织学类型方面,与I类相比,II~IV类的OS均有显著性降低(见图5);在就诊年份方面,在2010~2015年期间,不同的就诊年份组的OS差异有统计学意义(见图6)。具体的单因素及多因素结果见表2。

1:男性组;2:女性组。图1 不同性别对肾癌总生存期的影响

1:未婚组;2:SDW组;3:已婚组。图2 不同婚姻状态对肾癌总生存期的影响

1:黑人组;2:白人组;3:其他人种组。图3 不同种族对肾癌总生存期的影响
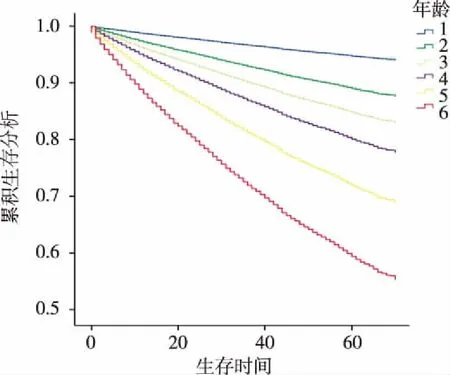
1:1~39组;2:40~49组;3:50~59组;4:60~69组;5:70~79组;6:80+组。图4 不同年龄组对肾癌总生存期的影响
Cox回归也用于在多变量分析中调整上述变量,并且发现婚姻状况是总体生存的独立预后因素(已婚,参考;未婚,单因素HR = 0.75,95%CI0.69~0.81,P<0.05;多因素HR = 1.32,95%CI1.22~1.42,P<0.05)。根据单变量分析判断,存活率较低的重要危险因素(P<0.05)涉及以下类别:男性,各个年龄组,肿瘤组织学分级较高以及各个就诊年份。当进行Cox回归的多变量分析时,这些风险因素被确信为独立的预后因素(见表2)。

1:Ι组;2:II组;3:III组;4:IV组。图5 组织学分级对肾癌总生存期的影响
1:2010~1011组;2:2012~2013组;3:2014~2015组。图6 就诊年份对肾癌总生存期的影响

表2 影响肾癌患者生存时间的单因素和多因素 Cox 分析
2.3 评估婚姻状况对OS影响的亚组分析 进一步根据SEER数据库结果探索婚姻状况对OS的影响。在单变量和多变量分析中,婚姻状况仍然是每个阶段的独立预后因素(P<0.05)。此外,我们发现与其他组相比,SDW患者在低级别分级组和高级别分级组的OS较差,与在低级别肿瘤分级的已婚组相比,SDW组与死亡风险相关(HR=1.51,95%CI1.36~1.67,P<0.05)和远期(HR=1.22,95%CI1.08~1.37,P<0.05)。未婚组和已婚组之间的生存差异在低级别肾癌不明显(P=0.68)。
3 讨论
在本研究中,我们根据SEER数据库探讨了婚姻状态对肾癌患者生存时间的影响。结果显示良好婚姻状态的肾癌患者较SDW和未婚组患者相比有较长的总生存期及较低的死亡风险,同时,我们发现在调整性别、年龄、种族、肿瘤组织学类型及不同就诊年份后,多变量Cox分析得出结果显示:未婚组的生存预后较已婚组差,SDW组分别与未婚组、已婚组相比死亡风险显著增加。良好的婚姻状态被认为是最有效的社会支持,其主要来源于配偶,肿瘤患者易受情感因素影响,配偶能为患者及时提供有效的情感安抚和社会环境支持,减轻患者面对罹患肿瘤带来的心理压力[9-11]。多项研究表明心理因素在肿瘤治疗中占据重要地位,合并抑郁症的癌症患者与无抑郁症的癌症患者的总体存活率降低。在口腔癌、前列腺癌、结直肠癌及妇科肿瘤等的相似研究中[5-7,12],也得到了与本研究一致的结果,婚姻和谐的肿瘤患者有较好的预后,提示是这类患者在配偶的陪伴下,可能拥有更好的心理健康状况、得到更多的经济支持,因此更容易完成有效地临床诊疗计划,从而改善这类患者生存预后[13-15]。此外,之前的一项研究表明,肾癌的预后与年龄增长有关[16]。因此,我们根据年龄进一步分析了存活率和危害,已婚患者在每个年龄组的生存率总是更高,这与本研究结果一致。然而,在SDW和未婚患者中未发现生存差异。我们还按性别进行了进一步的分层分析。SDW和未婚患者显示出具有无论是在男性组和女性组的生存率总是更低,这与本研究结果一致。
本研究表明,SDW组患者死亡风险都较未婚组、已婚组高,该风险独立于基线因素,可能影响患者的心理健康及得到有效治疗措施的机会。故认为,SDW组患者预后差可能是肾癌患者远期预后差的独立因素,医务人员对在这类患者诊治过程中可提供更多的关心和帮助,以改善这类患者因缺失伴偶陪伴所带来的心理健康问题,以期实现更好的临床诊疗措施,改善远期预后。
本研究分析可能存在一定局限性:①本研究为回顾性研究,尚不能完全证实两者具有必然因果关系;②SEER数据库只提供了基线时的婚姻状态,暂无法评估婚姻状态动态变化与肿瘤预后的关系,针对这一问题可进一步研究。总的来说,本研究基于大数据研究婚姻状态对肾癌患者预后的影响,婚姻状态可能是肾癌患者远期预后的独立影响因素,强调了社会支持对癌症患者在治疗期间的重要性。

