三甲基苯基锡烷中苯环的核磁化学位移
毛金山,连 畅,邱 頔
(1.天津师范大学化学学院,天津300387;2.天津师范大学无机-有机杂化功能材料化学教育部重点实验室,天津300387;3.天津师范大学天津市功能分子结构与性能重点实验室,天津300387)
芳基锡化合物,特别是高活性的芳基三甲基锡试剂,在有机合成化学及其他研究领域具有重要的应用价值[1-5].其中,采用有机锡试剂作为偶联组分的钯催化的交叉偶联反应,即Stille 偶联反应,在有机合成中被广泛应用于构建多种类型的C—C 键[6-8],该方法已成为一种高效的构筑生物活性分子[9]以及实现复杂天然产物全合成[10]的重要方法和策略.除了可以高效普遍地构筑C—C 键之外,芳基三烷基锡还被用来进行一系列的官能团转化,通过C—Sn 键的断裂在芳香环上引入C—B、C—N、C—F 和C—OCF3等官能团[11-15].合成芳基三烷基锡化合物的方法主要有:①通过芳基金属试剂,如格氏试剂、锂试剂、锌试剂,直接和三烷基氯化锡发生亲核取代过程而获得,该方法是最经典和传统的合成芳基锡的途径[16-17];②以芳基卤化物、酚类衍生物或者芳基季铵盐为原料,通过和三烷基锡负离子的自由基亲核取代反应来合成芳基三烷基锡化合物[18];③过渡金属催化的芳基卤化物或者类卤素与联锡烷进行交叉偶联反应[19-22];④无过渡金属参与的芳香胺经由重氮化过程与联锡烷的类Sandmeyer 反应[23-24].这些途径分别从不同类型的芳香底物出发,高效制备芳基三烷基锡.近年来,芳基锡的合成研究也不断被报道.如Yue 等[25]利用镍催化的芳香羧酸酯的锡化反应合成了芳基锡;Zhao 等[26]基于芳基硫鎓盐的SNAr反应合成了芳基锡;Kayumov 等[27]基于钯催化的芳基酰基氟化物的脱羰基锡化反应合成了芳基锡烷;Lian 等[28]基于钯催化的芳香亚磺酸钠的脱硫锡化反应合成了芳基锡.
2019 年,本课题组首次报道了可见光催化条件下无光敏剂参与的芳基三甲基锡烷的合成[29].该反应选择芳香偶氮砜化合物作为一种新型的芳基自由基前体,无需昂贵的过渡金属或者有机光敏剂的参与,在可见光的照射下直接发生化学键的均裂产生芳基自由基,进一步与联锡试剂通过自由基反应途径实现芳香碳锡键的构筑.与芳香胺和芳基重氮盐相比,偶氮砜作为前体具有更好的官能团容忍性,给电子取代基的存在不影响反应结果,并且杂环也能够给出较高的产率.该工作为可见光催化的经由自由基中间体合成芳基三甲基锡烷提供了新思路.
鉴于芳基三甲基锡烷在有机合成中的重要性和应用价值,芳基三甲基锡化合物的谱学表征和快速结构鉴定成为有机锡化学的一个重要且关键的技术.从结构鉴定的角度看,某个取代基对于苯环中各位置的化学位移影响是该取代基基础且重要的核磁共振参数.常见的烷基、卤素、含氮和含氧基团的取代基化学位移变化参数已列入了教材和参考书[30-31]. Bruns 等[32]和Qiu 等[33]报道了硼酸、硼酸频哪醇酯作为取代基时芳香环的核磁共振氢谱和碳谱化学位移变化,这些研究为芳香硼化合物的合成与结构表征提供了重要的谱学参考依据.
芳香锡化合物的核磁共振化学位移变化规律的研究未见文献报道.本课题组采用核磁共振氢谱和碳谱的测试方法,通过研究三甲基苯基锡烷化合物在氘代氯仿的核磁共振氢谱和碳谱数据,发现了三甲基锡基(-SnMe3)对于芳香环各位置的化学位移变化的规律.研究结果可用以评估和预测官能化的苯基锡化合物的化学位移.
1 材料与方法
1.1 仪器与试剂
仪器:400 MHz 核磁共振波谱仪,CDCl3为溶剂,四甲基硅烷(TMS)为内标,德国Bruker 公司.
试剂:所用溶剂(1,2-二氯乙烷、石油醚、乙酸乙酯)由天津化学试剂六厂生产,其他化学药品均采购于安耐吉化学有限公司和天津希恩思生化科技有限公司.所有试剂均为分析纯级.
1.2 实验方法
芳香胺、亚硝酸叔丁酯与六甲基二锡烷合成取代芳基三甲基锡烷的化学反应如图1 所示.
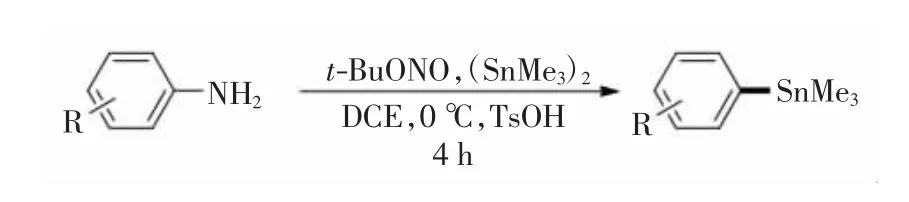
图1 芳基三甲基锡烷的合成路线Fig.1 Synthetic route of aryl trimethylstannanes
取代的苯基三甲基锡烷的通用合成方法[23]:氮气保护条件下,在10 mL 反应管中加入0.3 mmol 芳香胺衍生物和0.36 mmol 一水合对甲苯磺酸(TsOH).氮气保护下脱气3 次后,依次加入溶剂1,2-二氯乙烷(DCE,1.5 mL)、亚硝酸叔丁酯(t-BuONO,0.6 mmol)和六甲基二锡烷((SnMe3)2,0.33 mmol).反应体系在0 ℃下搅拌4 h. 经减压旋干溶剂得到粗产品,经过柱层析分离,用石油醚与乙酸乙酯的体积比为100 ∶1 ~5 ∶1 的混和液洗脱,得到目标产物芳基三甲基锡烷1~22.
1.3 芳基三甲基锡烷的结构表征
使用400 MHz 核磁共振波谱仪,以CDCl3为溶剂,测定合成的22 种取代的苯基三甲基锡烷的1H NMR 和13C NMR谱.
1:产率53%,无色液体.1H NMR(400 MHz,CDCl3)δ 7.50~7.48(m,2H),7.35~7.30(m,3H),0.28(s,9H);13CNMR(100 MHz,CDCl3)δ142.2,135.8,128.2,128.0,-9.6.[16]
2:产率76%,淡黄液体.1H NMR(400 MHz,CDCl3)δ 7.98(d,J=7.2 Hz,2H),7.57(d,J=7.2 Hz,2H),4.37(q,J=6.7 Hz,2H),1.39(t,J=6.7 Hz,3H),0.31(s,9H);13C NMR(100 MHz,CDCl3)δ 166.9,149.4,135.7,130.2,128.5,60.9,14.4,-9.5;IR(film):2982,1717,1276,1110,1066,908,753,731 cm-1;HRMS (ESI)calcd forSn[M+H]+315.04033;found 315.03995.
3:产率86%,淡黄液体.1H NMR(400 MHz,CDCl3)δ 8.14(d,J=8.4 Hz,2H),7.67(d,J=8.4 Hz,2H),0.36(s,9H);13C NMR(100 MHz,CDCl3)δ 153.1,148.1,136.4,122.0,-9.4.[17]
4:产率45%,无色液体.1H NMR(400 MHz,CDCl3)δ 7.41~7.38(m,1H),7.31(dt,J=1.6,8.0 Hz,1H),7.13(t,J=7.2Hz,1H),7.00(t,J=7.5Hz,1H),0.34(s,9H);13C NMR(100 MHz,CDCl3)δ 167.4(d,J = 235 Hz),136.7(d,J=15.0 Hz),130.6(d,J=7.4 Hz),127.1(d,J=44.0 Hz),124.2,114.2(d,J=27.6 Hz),-9.2.[29]
5:产率61%,无色液体.1H NMR(400 MHz,CDCl3)δ 7.32(m,2H),7.21(m,1H),7.13(d,J=7.2 Hz,1H),2.34(s,3H),0.28(s,9H);13C NMR(100 MHz,CDCl3)δ142.1,137.4,136.5,132.8,128.9,127.9,21.5,-9.6.[23]
6:产率74%,无色液体.1H NMR(400 MHz,CDCl3)δ 7.23(dd,J=7.2,8.1 Hz,1H),7.07(d,J=7.2 Hz,1H),7.02(m,1H),6.85(dd,J = 2.0,8.1 Hz,1H),3.85(s,3H),0.33(s,9H);13C NMR(100 MHz,CDCl3)δ 159.1,143.7,129.0,128.0,121.4,113.4,55.0,-9.6.[29]
7:产率52%,黄色液体.1H NMR(400 MHz,CDCl3)δ 7.76(d,J=7.5 Hz,2H),7.51(d,J=7.6 Hz,2H),1.34(s,12H),0.28(s,9H);13C NMR(100 MHz,CDCl3)δ 146.6,135.2,134.0,83.6,24.8,-9.6;IR(film):2980,1594,1359,1144,1056,908,859,732 cm-1;HRMS(ESI)calcdforC15H25BNaO2120Sn[M+Na]+391.08666;found 391.08707.
8:产率49%,无色液体.1H NMR(400 MHz,CDCl3)δ 7.44(dd,J=6.5,8.3 Hz,2H),7.05(dd,J=8.6,9.3 Hz,2H),0.28(s,9H);13C NMR(100 MHz,CDCl3)δ 163.3(d,J=246.5 Hz),137.3(d,J=6.7 Hz),137.1(d,J=4.4 Hz),115.2(d,J=19.1 Hz),-9.4.[23]
9:产率50%,无色液体.1H NMR(400 MHz,CDCl3)δ 7.41(d,J=8.0 Hz,2H),7.31(d,J=8.0 Hz,2H),0.29(s,9H);13C NMR(100 MHz,CDCl3)δ 140.3,137.0,134.5,128.1,-9.4.[23]
10:产率51%,淡黄液体.1H NMR(400 MHz,CDCl3)δ 7.47(d,J=7.7 Hz,2H),7.34(d,J=7.8 Hz,2H),0.29(s,9H);13C NMR(100 MHz,CDCl3)δ 140.9,137.3,131.0,123.0,-9.4.[23]
11:产率53%,无色液体.1H NMR(400 MHz,CDCl3)δ 7.39(d,J=7.5 Hz,2H),7.17(d,J=7.5 Hz,2H),2.34(s,3H),0.27(s,9H);13C NMR(100 MHz,CDCl3)δ 138.2,138.0,135.8,128.9,21.4,-9.5.[29]
12:产率49%,淡黄液体.1H NMR(400 MHz,CDCl3)δ 7.41(d,J=8.4 Hz,2H),6.92(d,J=8.4 Hz,2H),3.80(s,3H),0.26(s,9H);13C NMR(100 MHz,CDCl3)δ 159.9,136.9,132.4,114.0,55.0,-9.5.[24]
13:产率48%,淡黄液体.1H NMR(400 MHz,CDCl3)δ 10.00(s,1H),7.81(d,J=7.9 Hz,2H),7.68(d,J=7.9 Hz,2H),0.34(s,9H);13C NMR(100 MHz,CDCl3)δ 192.8,152.5,136.4,136.1,128.6,-9.5.[22]
14:产率60%,无色液体.1H NMR(400 MHz,CDCl3)δ 7.89(d,J=7.9 Hz,2H),7.61(d,J=7.9Hz,2H),2.60(s,3H),0.32(s,9H);13C NMR(100 MHz,CDCl3)δ 198.4,150.1,136.7,135.9,127.1,26.5,-9.5.[21]
15:产率60%,淡黄液体.1H NMR(400 MHz,CDCl3)δ 7.40(d,J=8.1 Hz,2H),7.24(d,J=8.0 Hz,2H),2.47(s,3H),0.28(s,9H);13C NMR(100 MHz,CDCl3)δ 138.6,138.1,136.1,126.1,15.6,-9.5.[25]
16:产率55%,无色液体.1H NMR(400 MHz,CDCl3)δ 7.61~7.56(m,4H),0.33(s,9H);13C NMR(100 MHz,CDCl3)δ 150.2,136.2,130.7,119.0,111.7,-9.5.[23]
17:产率64%,无色液体.1H NMR(400 MHz,CDCl3)δ 7.51(d,J=1.0 Hz,1H),7.39(d,J=7.7 Hz,1H),7.28(dd,J=1.0,7.7 Hz,1H),0.31(s,9H);13C NMR(100 MHz,CDCl3)δ 142.8,137.2,134.8,132.5,132.4,130.0,-9.4.[29]
18:产率36%,淡黄液体.1H NMR(400 MHz,CDCl3)δ 6.97(s,2H),6.72(t,J=9.3 Hz,1H),0.32(s,9H);13C NMR(100 MHz,CDCl3)δ 162.7(dd,J=9.9,253.9 Hz),146.9,117.58(dd,J=4.9,15.6Hz),103.53(t,J=24.9 Hz),-9.4.[21]
19:产率59%,淡黄液体.1H NMR(400 MHz,CDCl3)δ 7.90(s,1H),7.59(d,J=7.8 Hz,1H),7.49(d,J=7.8 Hz,1H),0.36(s,9H);13C NMR(100 MHz,CDCl3)δ 147.8,143.5,140.2,131.8,130.9,126.7,-9.2;IR(film):1577,1530,1352,1140,1048,907,773,731 cm-1;HRMS (ESI)calcd for[M+Na]+343.94651;found 343.94753.
20:产率52%,黄色油滴.1H NMR(400 MHz,CDCl3)δ 7.81(dd,J=1.8,7.7 Hz,1H),7.59(d,J=1.6 Hz,1H),7.50(d,J=7.7 Hz,1H),3.89(s,3H),0.32(s,9H);13C NMR(100 MHz,CDCl3)δ 164.3,150.0,141.0,136.5,115.6,103.2,55.8,-9.1.[29]
21:产率61%,橙色液体.1H NMR(400 MHz,CDCl3)δ 7.93~7.91(m,2H),7.87(d,J = 8.0 Hz,2H),7.65(d,J=8.1 Hz,2H),7.53~7.49(m,3H),0.34(s,9H);13C NMR(100 MHz,CDCl3)δ 152.7,152.6,147.1,136.4,130.8,129.0,122.8,121.9,-9.4;IR(film):2980,1482,1381,1067,1013,907,766,732 cm-1;HRMS(ESI)calcd for[M+H]+347.05671;found 347.00250.
22:产率45%,淡黄液体.1H NMR(400 MHz,CDCl3)δ 7.67~7.65(m,1H),7.58~7.57(m,1H),7.53~7.49(m,1H),7.41~7.37(m,1H),0.44(s,9H);13C NMR(100 MHz,CDCl3)δ 148.0,136.4,132.7,131.5,128.5,120.3,120.0,-9.0;IR(film):2220,1256,1191,1112,907,763,731 cm-1;HRMS(ESI)calcd for C10H13NNa120Sn[M+Na]+289.99636;found 289.99726.
1.4 数值计算
-SnMe3为取代基时,它对苯环中各位置的氢谱化学位移变化量的计算公式为
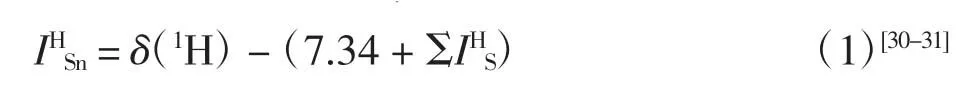
-SnMe3为取代基时,它对苯环中各位置的碳谱化学位移变化量的计算公式为
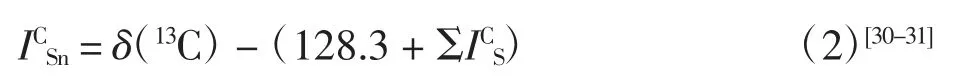
表1 公式(1)中的取代基氢谱化学位移变化值常数IHSTab.1 Substituent constant of 1H NMR chemical shift in Eq.(1)
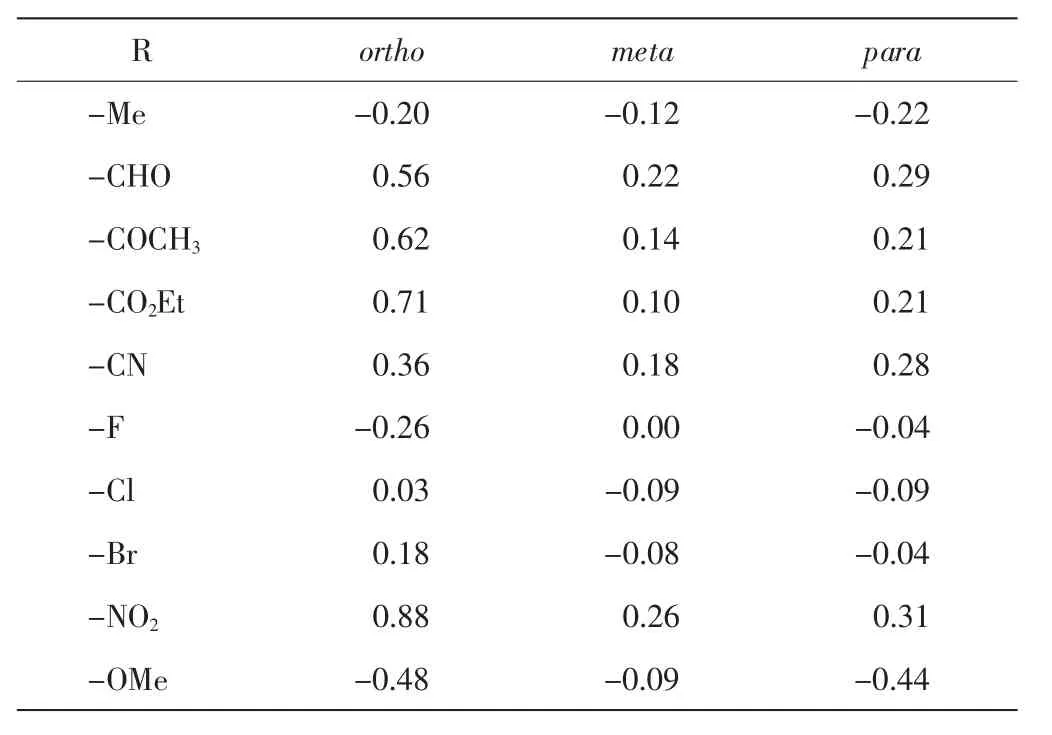
表1 公式(1)中的取代基氢谱化学位移变化值常数IHSTab.1 Substituent constant of 1H NMR chemical shift in Eq.(1)
R ortho meta para-Me -0.20 -0.12 -0.22-CHO -0.56 -0.22 -0.29-COCH3 -0.62 -0.14 -0.21-CO2Et -0.71 -0.10 -0.21-CN -0.36 -0.18 -0.28-F -0.26 -0.00 -0.04-Cl -0.03 -0.09 -0.09-Br -0.18 -0.08 -0.04-NO2 -0.88 -0.26 -0.31-OMe -0.48 -0.09 -0.44
表2 公式(2)中取代基的碳谱化学位移变化值常数Tab.2 Substituent constant of 13C NMR chemical shift in Eq.(2)
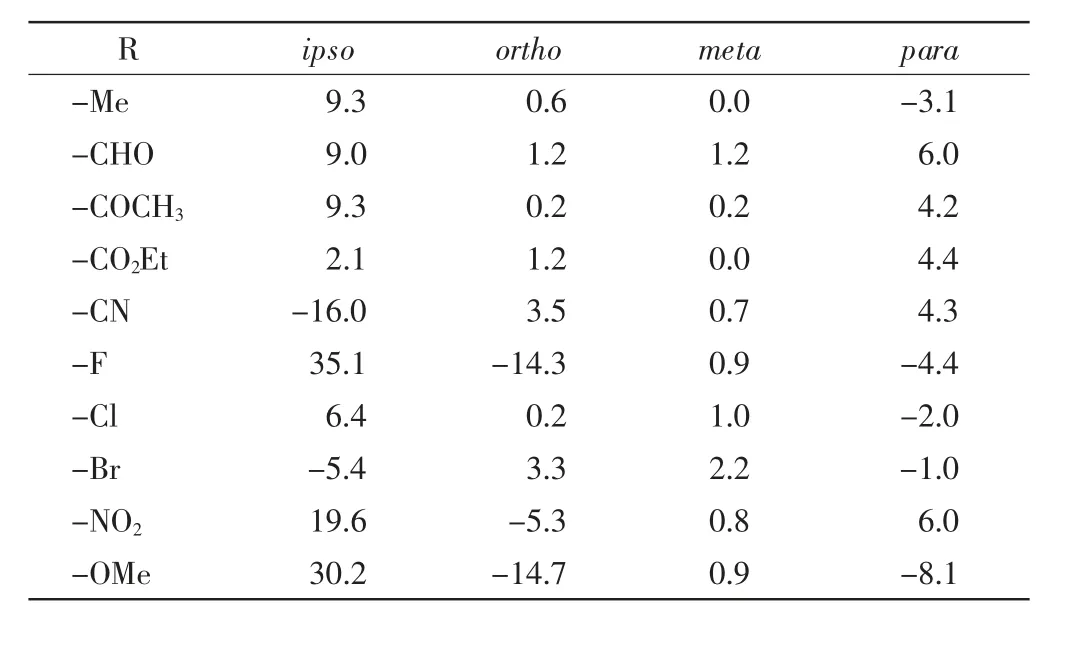
表2 公式(2)中取代基的碳谱化学位移变化值常数Tab.2 Substituent constant of 13C NMR chemical shift in Eq.(2)
R ipso para-Me -09.3 -3.1-CHO -09.0 -6.0-COCH3 -09.3 -4.2-CO2Et -02.1 -4.4-CN -16.0 -4.3-F -35.1 -4.4-Cl -06.4 -2.0-Br 0-5.4 -1.0-NO2 -19.6 -6.0-OMe -30.2 -8.1 ortho 0-0.60-1.20-0.20-1.20-3.5-14.30-0.20-3.30-5.3-14.7 meta 0.01.20.20.00.70.91.02.20.80.9
2 结果与分析
本研究合成了一系列取代的芳基三甲基锡烷化合物.以苯基三甲基锡烷1 和若干单取代的芳基三甲基锡烷2~6 作为参照化合物,计算三甲基锡基对于芳香环氢谱的化学位移变化量.芳基三甲基锡烷1~6 的结构如图2 所示,所选化合物涵盖了不同的给电子和吸电子效应的取代基.
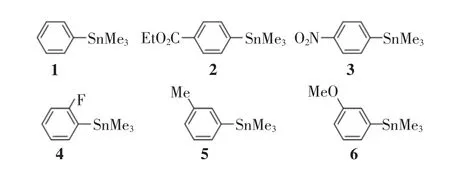
图2 作为参照化合物的芳基三甲基锡烷Fig.2 Aryl trimethylstannanes as the reference compounds
通过测定化合物1~6 的氢谱化学位移δ(1H),结合公式(1),可以计算得到芳香化合物中三甲基锡基作为取代基时,它对于苯环中各位置的氢谱化学位移变化量其中,7.34 为苯在氘代氯仿作为核磁溶剂时的1H NMR 化学位移实测值.实验结果如表3 所示.
通过分析表3 中化合物1~6 的氢谱化学位移,可以得到不同取代位点的平均和对应的标准差:= 0.14 ± 0.02;= -0.03 ± 0.02;= -0.03 ± 0.01. 由以上数据可知,三甲基锡基作为取代基时,它对于芳香环邻位的氢谱化学位移变化量为+0.14,间位为-0.03,对位为-0.03.从数据分析来看,三甲基锡基与叔丁基相比,是一个更弱的给电子基团(叔丁基(ortho)=0.02(meta)=-0.08,(para)=-0.21)[10].它对于氢谱的化学位移变化量类似于卤素取代基中的溴原子(溴取代基的(ortho)==-0.04)[30-31].总体上,芳香环邻位的氢原子主要受到了电子效应和三甲基锡基空间效应的影响,而间位和对位主要受到了三甲基锡基电子效应的作用.
表3 苯基三甲基锡烷的氢谱化学位移(δ)和由于三甲基锡取代基产生的氢谱化学位移变化量Tab.3 1H NMR(δ)of aryl trimethylstannanes and increments for the 1H chemical-shift differences()caused by the trimethylstannyl group
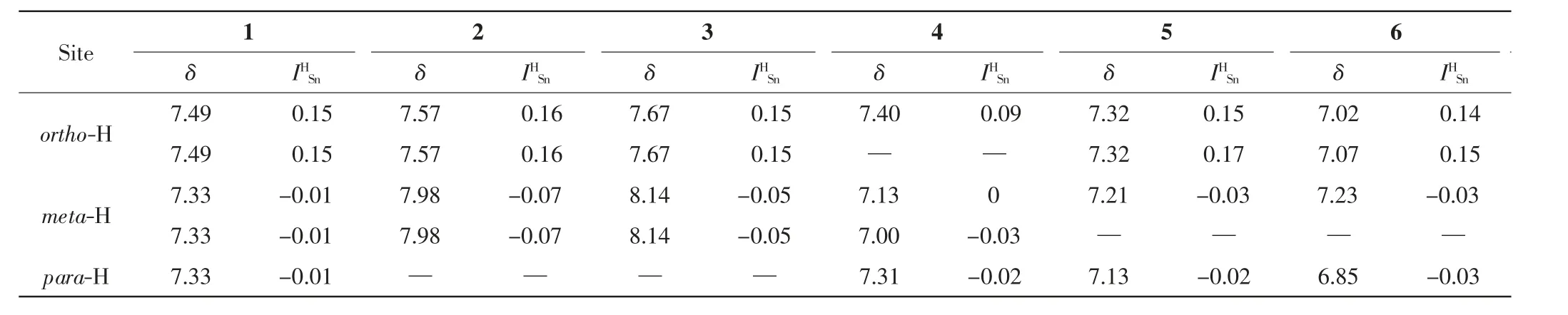
表3 苯基三甲基锡烷的氢谱化学位移(δ)和由于三甲基锡取代基产生的氢谱化学位移变化量Tab.3 1H NMR(δ)of aryl trimethylstannanes and increments for the 1H chemical-shift differences()caused by the trimethylstannyl group
Site 1 2 3 4 5 6 δIHSnδIHSnδIHSnδIHSnδIHSnδIHSn ortho-H 7.49 -0.15 7.57 -0.16 7.67 -0.15 7.40 -0.09 7.32 0.15 7.02 -0.147.49-0.157.57-0.167.67-0.15— —7.320.177.07-0.15 meta-H 7.33 -0.01 7.98 -0.07 8.14 -0.05 7.13 0 7.21 -0.03 7.23 -0.037.33-0.017.98-0.078.14-0.057.00-0.03— —para-H7.33-0.01— —7.31-0.027.13-0.026.85-0.03
通过测定芳基三甲基锡烷1~6 的碳谱化学位移δ(13C),结合公式(2),可以计算得到芳香化合物中三甲基锡基作为取代基时,它对于苯环中各位置的碳谱化学位移变化量ICSn,结果如表4 所示.其中,128.3 为苯在氘代氯仿作为核磁溶剂时的13C NMR 化学位移实测值.
表4 苯基三甲基锡烷的碳谱化学位移(δ)和由于三甲基锡取代基产生的碳谱化学位移变化量Tab.4 13C NMR(δ)of aryl trimethylstannanes and increments for the 13C chemical-shift differences()caused by the trimethylstannyl group
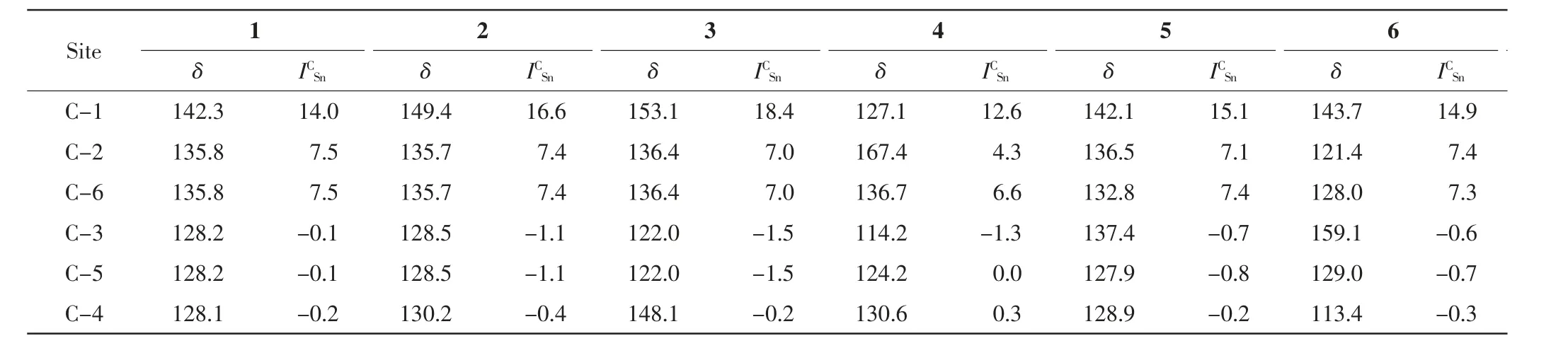
表4 苯基三甲基锡烷的碳谱化学位移(δ)和由于三甲基锡取代基产生的碳谱化学位移变化量Tab.4 13C NMR(δ)of aryl trimethylstannanes and increments for the 13C chemical-shift differences()caused by the trimethylstannyl group
Site C-1123456 δICSnδICSnδICSnδICSnδICSnδICSn 142.3 -14.0 149.4 -16.6 153.1 -18.4 127.1 -12.6 142.1 -15.1 143.7 -14.9 C-2 C-6 135.8 0-7.5 135.7 0-7.4 136.4 0-7.0 136.7 0-6.6 132.8 0-7.4 128.0 0-7.3 C-3 128.2 0-0.1 128.5 0-1.1 122.0 0-1.5 114.2 0-1.3 137.4 0-0.7 159.1 0-0.6 C-5 128.2 0-0.1 128.5 0-1.1 122.0 0-1.5 124.2 0-0.0 127.9 0-0.8 129.0 0-0.7 C-4 128.1 0-0.2 130.2 0-0.4 148.1 0-0.2 130.6 0-0.3 128.9 0-0.2 113.4 0-0.3135.8 0-7.5 135.7 0-7.4 136.4 0-7.0 167.4 0-4.3 136.5 0-7.1 121.4 0-7.4
通过分析表4 中的苯基三甲基锡衍生物1~6 的碳谱化学位移,可以得到不同取代位点(本位(ipso)、邻位、间位、对位)的平均碳谱化学位移变化量和对应的标准差(ortho)=6.9±=-0.2±0.2.
图3 作为验证化学位移变化量有效性的芳基三甲基锡烷Fig.3 Aryl trimethylstannanes for verifying the efficacy of chemical shift increments
根据公式(1)和公式(2),对图3 中的芳基锡化合物7~22 的各个位置的氢与碳原子的化学位移值进行理论上的计算和预测,并且与实际测量值进行比对,结果分别如表5 和表6 所示.氢谱和碳谱的实测数据用Bruker 400 MHz 核磁共振仪器进行测试获得,其他各种取代基的和根据文献[30-31]获得.
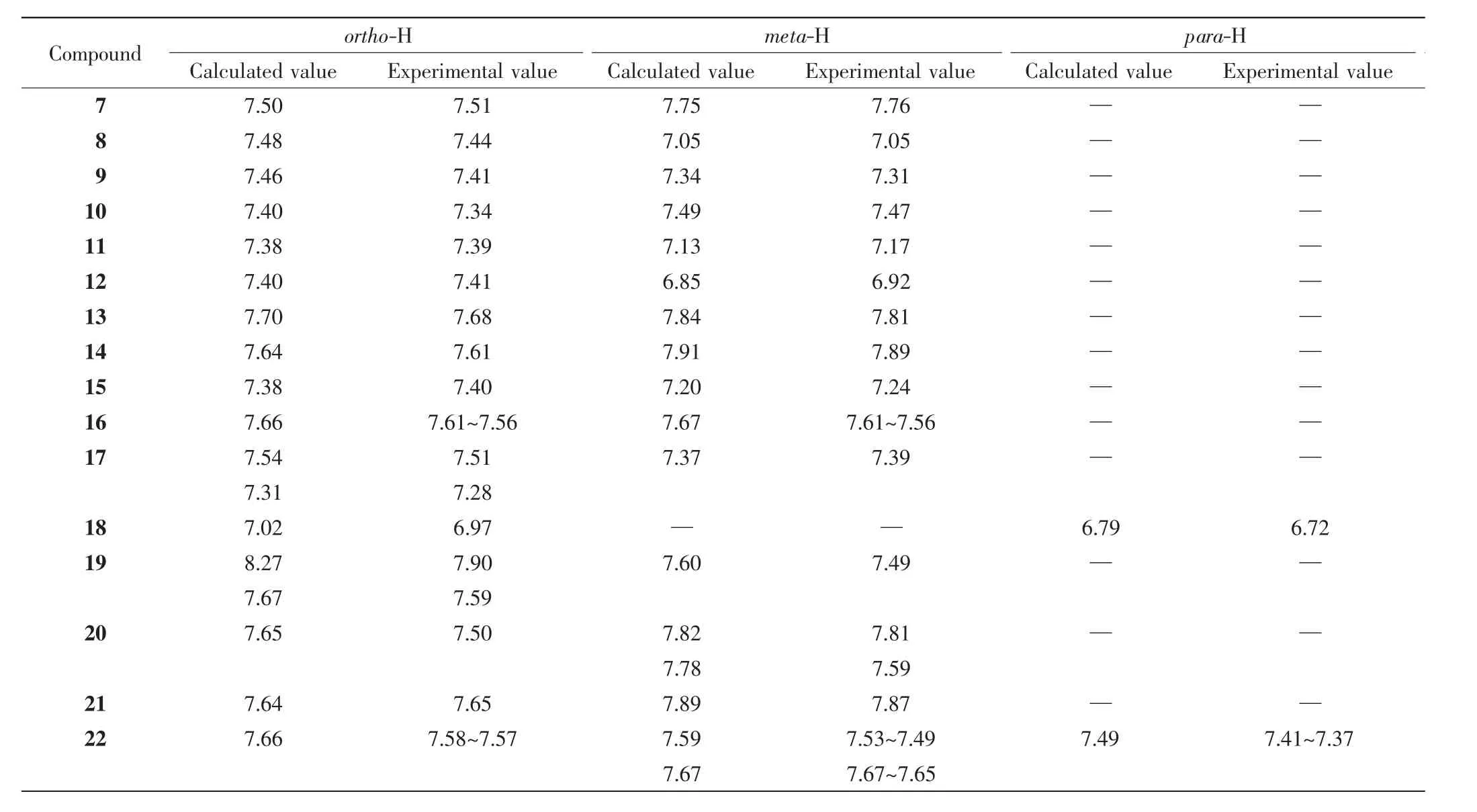
表5 芳基三甲基锡烷7~22 的氢谱化学位移(δ)的理论计算值和实际测量值的比较Tab.5 Comparison of calculated and experimental 1H NMR chemical shifts(δ)of the aryl trimethylstannanes 7-22
根据表5 和表6 的数据结果可得,芳基三甲基锡烷的氢谱与碳谱数据的理论计算值和实测值的标准偏差分别为= -0.3 ± 0.9.由此可知,根据总结得到的与经验值来进行理论预测的芳基三甲基锡烷化合物的氢谱与碳谱化学位移与实际测量值具有较好的符合程度.其中,三甲基锡取代基的对位的氢谱理论预测数据与实际测量值具有相对较大的偏差,可能是因为对位的氢谱数据样本量较小造成的.由于从芳香胺出发经重氮盐转化的合成方法的原因,采用的官能化的芳基三甲基锡烷很多都是对位取代的.值得注意的是,当芳香环上带有多个取代基时,例如化合物19 和20,其氢谱和碳谱核磁数据具有较大的误差(如19 的C-4 理论值和计算值数据).
3 结论
本研究通过测定一系列的苯环衍生的芳基三甲基锡烷化合物的核磁共振氢谱与碳谱化学位移,得到了采用氘代氯仿作为核磁溶剂、三甲基锡基作为取代基时,它对于苯环上各个位点的氢谱和碳谱的化学位移变化量.实验结果表明,不同取代位点(邻位、间位、对位)的平均氢谱化学位移变化量和对应的标准差= -0.03 ± 0.02;=-0.03±0.01.不同取代位点(本位、邻位、间位、对位)的平均碳谱化学位移变化量及其对应的标准差=6.9±0.9;= -0.2 ± 0.2. 这些数据结果可用来有效地评估和预测官能化的芳基锡化合物的氢谱与碳谱化学位移,为合成芳基锡与确定未知的芳基锡衍生物的结构提供参考数据和佐证.该化学位移变化量数值可以作为三甲基锡基的核磁参数列入核磁教材和工具书中,具有潜在的合成和结构鉴定价值.

