罗氏沼虾不同育种群体遗传多样性研究
唐琼英 谢巨洪 夏正龙 蔡缪荧 吴云明 白鹿淮 杜厚宽李景芬 杨国梁,
(1. 湖州师范学院浙江省水生生物资源养护与开发技术研究重点实验室, 中国水产科学研究院水生动物繁育与营养重点实验室, 湖州 313000; 2. 江苏数丰水产种业有限公司, 高邮 225654)
罗氏沼虾(Macrobrachium rosenbergii)原产于东南亚的热带和亚热带地区, 是淡水虾类养殖中个体最大的品种[1]。中国大陆自1976年引进以来, 已产生了可观的经济效益并拥有良好的发展前景。但长期以来, 由于人工养殖中亲本管理不严谨(如近交等)导致种质衰退严重(如生长缓慢、病害频发等)[2], 尤其是近年来发生的长不大、性成熟提前的“铁虾”, 使罗氏沼虾产业遭受了巨大危害。因此,进一步培育满足产业与市场需求的经济性状优良的罗氏沼虾新品种或新品系迫在眉睫。遗传多样性是物种进化的基础, 与进化潜力和适应力呈正相关, 遗传多样性越高的群体, 其生产性状如活力、生长速度、产卵量、环境适应力及抗病性能等提高的潜力越大[3]。因此, 遗传多样性水平不仅制约着生物的适应性进化, 也是选择育种的前提。
微卫星(Microsatellite)即短串联重复序列(Short tandem repeats, STRs)或简单重复序列(Simple sequence repeats, SSR), 是一种广泛应用于群体遗传多样性检测及亲缘关系鉴定的分子标记[4,5]。线粒体DNA (mitochondrial DNA, mtDNA)是一种核外的遗传物质, 因具有结构简单、进化速度适中、易扩增等优点, 被认为是研究群体遗传多样性和遗传结构的有力工具[6,7]。目前, 针对罗氏沼虾不同野生或养殖群体, 已有一些采用微卫星标记[3,8—12]或线粒体基因[13—15]进行遗传多样性的研究报道, 但这些研究多集中在不同的养殖群体上, 亲本来源背景未知, 且部分研究采用的群体较少, 如钟丹丹等[3]仅研究了2个群体。另外, 在已有的线粒体基因研究中, 各群体覆盖的个体数极少, 如杨学明等[13]3个群体仅17个个体, 姚茜等[14]3个群体仅16个个体, 且研究采用的基因片段大多数较短, 约400—500 bp, 提供的信息量有限。目前罗氏沼虾中还未见将微卫星和线粒体基因相结合对群体遗传多样性进行研究的报道。微卫星和线粒体分别是细胞核和细胞质遗传, 将二者相结合进行研究, 能更全面地反映生物的遗传多样性, 应用较为广泛, 如东北林蛙(Rana dybowskii)[16]、中华蜜蜂(Apiscerana cerana)[17]、梨小食心虫(Grapholita molesta)[18]等物种的遗传多样性研究等。
本研究将微卫星和线粒体基因相结合, 对罗氏沼虾不同种质资源的育种群体进行遗传多样性研究, 期望全面了解国内已有种质资源的遗传背景,为优良品种选育提供参考资料。
1 材料与方法
1.1 实验材料
实验材料为取自罗氏沼虾育种基地(江苏数丰水产种业有限公司)培育及收集的不同来源的4个育种群体, 包括: 选育3代的数丰核心群体(SF)、引进的正大群体(ZD)、正大和数丰杂交的群体(ZDS)、正大子代和数丰杂交的群体(ZD2S)。数丰核心群体因群体数量较大选取60个个体, 其他每个群体各取30个个体, 分别剪取虾尾肌肉组织, 用95%的乙醇保存, 并冻存于-20℃冰箱, 供后续DNA提取。
1.2 基因组DNA提取、PCR扩增和测序
肌肉组织基因组DNA提取采用高盐抽提法,用1.2%琼脂糖凝胶电泳检测提取DNA的完整性,微量分光光度计检测浓度和纯度后, 用灭菌水稀释至50 ng/μL供后续PCR扩增实验。
采用7对荧光修饰标记(HEX或FAM)的微卫星引物对各群体进行PCR扩增。微卫星引物来自文献[3, 8]及本团队开发的引物。引物序列、目的片段大小及扩增条件见表 1。PCR反应体系为20 μL,包括: 2×TaqMix (TaKaRa) 10 μL、10 μmol/L的上下游引物各1 μL、灭菌水 7 μL和DNA 1 μL。PCR反应程序为: 95℃预变性3min, 然后94℃变性30s、54—62℃退火30s、72℃延伸45s, 重复35次循环, 最后72℃延伸10min。
线粒体COⅠ和12S rRNA基因的引物根据罗氏沼虾GenBank中的线粒体基因组全序列(登录号为AY659990和NC006880)进行设计。PCR反应体系为50 μL, 其中包括: 灭菌水31 μL、10×buffer 5 μL、2.5 mmol/L的dNTP(TaKaRa) 4 μL、25 mmol/L的MgC12(TaKaRa) 3 μL、10 μmol/L的上下游引物分别为 1 μL、5 U/μL的Taq酶(TaKaRa) 0.2 μL和DNA 4.8 μL。PCR反应采用Touchdown程序: 95℃预变性5min; 然后95℃变性30s、56—62℃退火30s、72℃延伸30s, 重复10次循环, 每次循环降低1℃; 然后再95℃变性30s、52℃退火30s、72℃延伸30s, 重复25次循环; 最后72℃延伸20min。

表1 用于本研究的微卫星引物相关信息Tab. 1 Primers used in the present study
PCR扩增产物用1.5%琼脂糖凝胶进行电泳检测。微卫星分型使用ABI3730XL全自动DNA测序仪进行, 获得每个个体在不同微卫星位点的等位基因数据, 采用软件GeneMarker V2.2.0对扩增产物片段大小进行读取。线粒体基因采用与PCR扩增相同的引物进行双向测序。以上测序工作均由武汉天一辉远生物科技公司完成。
1.3 数据处理
对获得的微卫星位点分型数据进行校正。利用Genepop 4.0软件进行哈迪温伯格平衡(Hardy-Weinberg equilibrium, HWE)检验。采用Cervus 3.0软件计算等位基因数(Na)、观测杂合度(Ho)、期望杂合度(He)和多态信息量(PIC)。利用Arlequin 3.5软件来估计各种群间遗传分化指数(FST), 进行分子变异分析(AMOVA), 包括群体内以及群体间变异。
线粒体基因序列用Clustal X2.1软件进行比对,并在Seaview中进行手工校正。采用MEGA7.0.26对序列的基本信息进行统计, 如序列长度、碱基组成、变异位点的数目和简约信息位点数目等。利用软件DnaSP 5.0和Arlequin进行单倍型数目(Number of haplotype,H)、单倍型多样性(Haplotype diversity,Hd)和核苷酸多样性(Nucleotidae diversity,π)等参数估计, 并采用最大似然 (ML)法对单倍型序列进行聚类分析。
2 结果
2.1 基于微卫星位点的罗氏沼虾育种群体遗传多样性
经检验, 7个微卫星位点都极显著偏离哈迪温伯格平衡(P<0.01)。所有群体所有微卫星位点的等位基因数(Na)为14—24个, 平均每个位点为19.43个等位基因, 平均观测杂合度(Ho)、期望杂合度(He)和多态信息含量(PIC)分别为0.615、0.898和0.887。在7个位点中, 座位29AG62的He和PIC都最高, 分别为0.919和0.910; 座位27AG62的He和PIC值均最低, 分别为0.878和0.864。4个群体中, SF群体平均每个座位的He和PIC都最高, 分别为0.874和0.854; ZD2S的其次,He和PIC分别为0.863和0.834;而ZDS群体的平均He和PIC都最低, 分别为0.798和0.761 (表 2)。
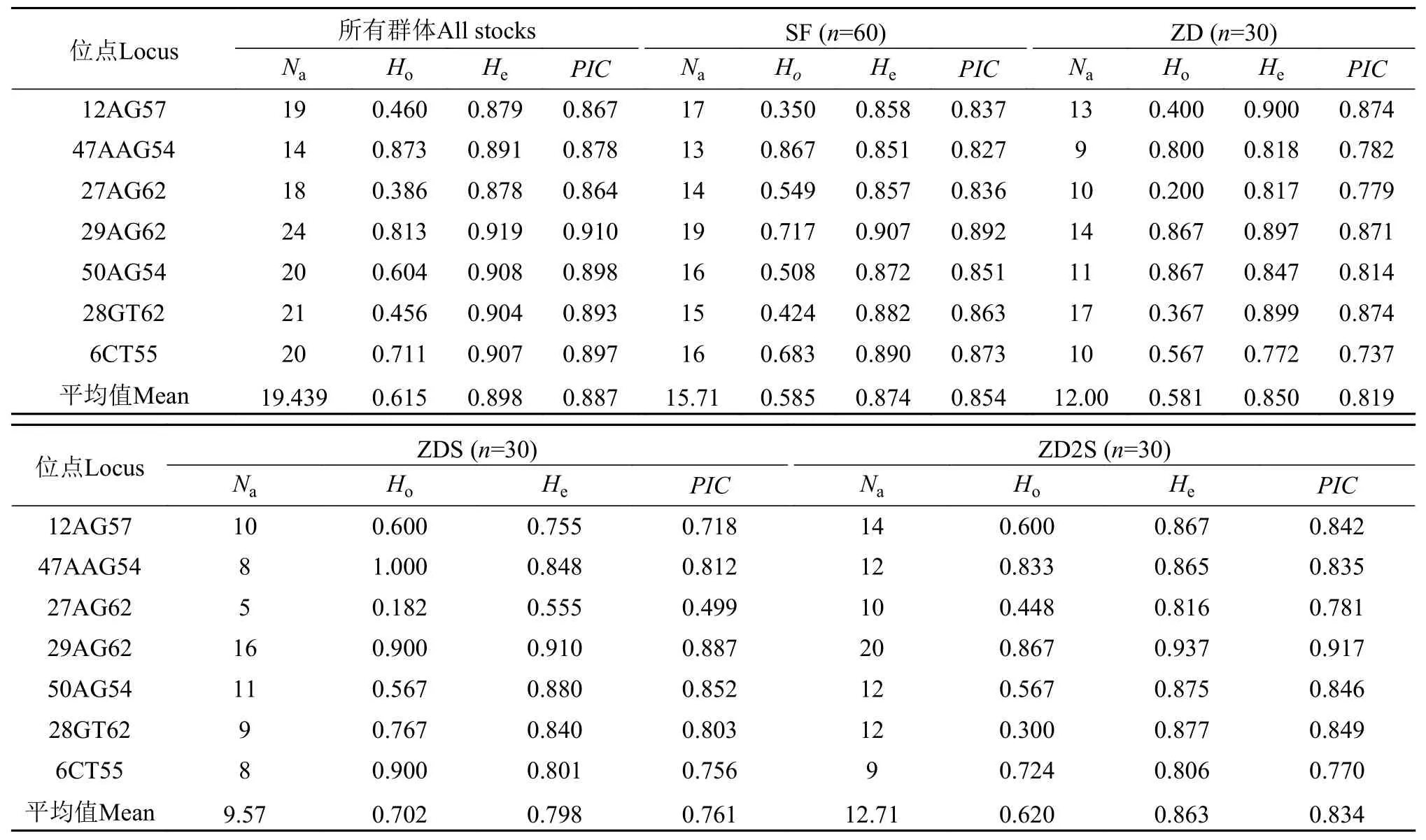
表2 各微卫星位点在4个罗氏沼虾育种群体中的遗传多样性参数Tab. 2 Genetic diversity parameters of each microsatellite locus in the four breeding populations of Macrobrachium rosenbergii
各育种群体间及群体内分子变异分析(AMOVA)结果表明, 罗氏沼虾各育种群体的变异主要来自群体内的变异, 占总变异的93.59%, 而来自群体间的变异较小, 仅占总变异的6.31% (表格未列出)。各群体间的遗传分化指数(FST)见表 3, 群体间的遗传分化均达极显著水平。其中, ZD和ZDS群体间的遗传分化最大,FST值为0.10438, 而SF和ZD2S间的分化最小,FST值为0.04166。ZD和ZD2S间及ZD和SF群体间的FST值分别为0.06539和0.07281。

表3 基于微卫星位点的罗氏沼虾各育种群体间遗传分化指数Tab. 3 Genetic differentiation index (FST) of the breeding populations of Macrobrachium rosenbergii based on SSR
2.2 基于线粒体基因的罗氏沼虾育种群体遗传多样性
共获得4个群体117个个体的线粒体COⅠ基因及137个个体的12S rRNA基因序列。COⅠ基因比对长度为1247 bp, 12S rRNA基因比对长度为798 bp。COⅠ基因共检测到21个变异位点, 其中14个为简约信息位点; 117个个体共享9个单倍型, 单倍型多样性(Hd)为0.425, 核苷酸多样性(π)为0.00371(表 4)。在798 bp的12S rRNA基因中, 共检测到10个变异位点, 其中9个为简约信息位点; 137个个体共识别12个单倍型,Hd为0.660,π为0.0023(表 4)。
将两个基因进行组合分析, 获得149个个体2045 bp的组合序列, 含31个变异位点, 其中27个为简约信息位点; 共识别27个单倍型,Hd值和π值分别为0.846和0.00313; 在4个群体中, ZD2S的Hd值最高(0.876), 其次为SF群体(0.835), ZDS的Hd值最低(0.594); 对于π值, SF群体的最高(0.00422), 其次为ZD2S(0.00349), ZD群体的最低(0.00044, 表 4)。

表4 罗氏沼虾育种群体线粒体COⅠ、12S rRNA基因及两个基因组合序列的遗传多样性参数Tab. 4 Genetic diversity parameters of mitochondrial COⅠ, 12S rRNA and their concatenated gene sequences in each breeding populationof Macrobrachium rosenbergii
在两个基因组合序列获得的27个单倍型中,Hap6包含的个体数最多, 有46个, 出现频率为30.87%, 分布于ZD2S、SF和ZD三个群体中; 其次为单倍型Hap2, 包含29个个体, 出现频率为19.46%,涵盖了所有4个群体。Hap1和Hap9分别包含15和13个个体, 其他23个单倍型包含的个体数在1—9个,有17个单倍型只包含1个个体, 为特有单倍型。在各群体中单倍型数量不一, 其中ZDS群体29个个体定义了5个单倍型, ZD2S群体30个个体定义了11个单倍型, SF群体60个个体定义了19个单倍型, ZD群体30个个体定义了7个单倍型。各群体单倍型分布情况见表 5。
基于最大似然法构建的27个单倍型聚类关系见图 1。所有单倍型聚为两个分支, Clade A和Clade B。Clade A包含16个单倍型, 主要是来自SF群体的个体, 同时有部分ZD2S的个体及个别ZD和ZDS的个体; ZD群体的单倍型主要聚类在Clade B, 该分支也包含较多的SF和ZD2S群体及部分ZDS群体的单倍型。所有单倍型间的遗传距离介于0.001—0.014,两个分支Clade A和Clade B间的平均遗传距离为0.009。从整体上看, 单倍型间的遗传差异较小。
基于COⅠ和12S rRNA基因组合序列的各群体两两间遗传分化指数(FST)结果表明, 群体间遗传分化较小,FST值为-0.02226—0.07310。ZD2S群体和ZDS群体间遗传分化最大,FST值为0.07310, 且分化显著; ZDS和ZD群体间及ZDS和SF群体间的FST值分别为0.03899和0.01419, 遗传分化较小, 且分化不显著; ZD和ZDS群体间、ZD和SF群体间及ZD2S和SF群体间的FST值为负值(表 6), 暗示群体间几乎不存在分化。
3 讨论
3.1 基于微卫星位点的多态性及群体遗传分化
在本研究中哈迪温伯格平衡(HWE)检验结果显示, 7个微卫星座位都显著偏离哈迪温伯格平衡(P<0.05), 这与罗氏沼虾的其他微卫星研究结果类似[3]。这可能是因为研究对象为人工选育群体, 群体间存在非随机交配等导致偏离哈迪温伯格平衡[19]。另一方面, 这也可能与无效等位基因相关[20]。

表5 罗氏沼虾各育种群体COⅠ和12S rRNA基因组合序列单倍型在各群体中的分布Tab. 5 Distribution of combined COⅠ and 12S rRNA sequence haplotypes in each breeding population of Macrobrachium rosenbergii
多态信息含量(PIC) 能反映群体的遗传变异程度和位点多样性等[21]。根据Botstein等[22]的划分标准,PIC≥0.5为高度多态性; 0.25≤PIC<0.5为中度多态性;PIC< 0.25为低度多态性。在本研究结果中, 7个微卫星位点的PIC值除ZDS群体27AG62位点为0.499外, 其余各群体每个位点的PIC值均大于0.5, 为高度多态性。在4个群体中, SF群体平均每个座位的PIC最高(0.854), ZD2S的其次(0.834)。
杂合度是衡量群体遗传多样性的重要参数。本研究中的4个罗氏沼虾群体均表现出较高的杂合度, 其中SF群体平均每个位点的期望杂合度(He)最高, 为0.874, ZD2S群体的其次, 为0.863。从整体上,所有群体所有位点的平均观测杂合度(Ho0.615)小于平均期望杂合度(0.898), 表明这4个群体可能因选育丢失了部分杂合子。杂合子缺失将导致纯合子增加, 提高有害等位基因纯合的几率, 近交衰退几率升高, 从而降低物种对环境变化的适应性[23]。因此, 在缺乏外来优势野生型群体作为育种亲本时,选择杂合子较多的群体进行育种可以降低近交衰退几率。
遗传分化指数(FST)是反映各群体间遗传分化的重要指标[24]。本研究基于7个微卫星位点分析的结果表明, 除SF与ZD2S群体的FST值稍低于0.05外,其余两两群体间,FST值都在0.05—0.15, 为中度分化[24], 且分化均达极显著水平, 这与孙成飞等[8]的研究结果类似。选择遗传分化指数大的群体间进行杂交, 可发挥杂种优势, 减缓育种群体之间近亲繁殖带来的影响。
3.2 基于线粒体基因的遗传多样性及群体遗传分化
在本研究中, 线粒体COⅠ、12S rRNA及两个基因的组合序列分析结果一致表明, 罗氏沼虾SF群体的核苷酸多样性(π)和ZD2S群体单倍型多样性最高(Hd), 与微卫星位点分析的结果较为一致。4个育种群体COⅠ基因的单倍型多样性(Hd)为0.080—0.603, 核苷酸多样(π)为0.00006—0.00512, 12S rRNA基因的Hd为0.500—0.637,π为0.00078—0.00293,两个基因组合序列的Hd为0.594—0.876,π为0.00044—0.00422, 均高于Thanh等[15]中罗氏沼虾越南2个野生种群及中国10个养殖群体16S rRNA基因的Hd(0—0.303)和π(0—0.0008), 但类似于其COⅠ基因的Hd(0.129—0.694)和π(0.0003—0.0073)。在本研究中, SF群体是通过收集国内包括罗氏沼虾“南太湖2号”在内的不同种质资源进行选育3代的群体, 亲本来源较为丰富。引进的ZD群体与SF群体杂交后也获得较高的遗传多样性, 这在本研究的微卫星和线粒体基因分析结果中得到进一步证明。另一方面, Thanh等[15]的研究采用的16S rRNA及COⅠ基因片段较短(分别仅395和498 bp), 提供的信息量有限。
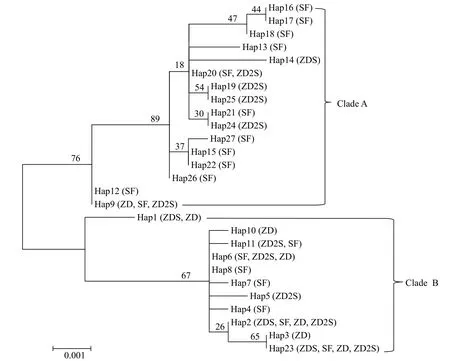
图1 罗氏沼虾COⅠ和12S rRNA基因组合序列单倍型间的聚类分析Fig. 1 Phylogenetic tree for the combined COⅠ and 12S rRNA sequence haplotypes of Macrobrachium rosenbergii

表6 基于COⅠ和12S rRNA基因组合序列的罗氏沼虾育种群体间遗传分化指数Tab. 6 Genetic differentiation index (FST) of the breeding populations of Macrobrachium rosenbergii based on the combined COⅠand 12S rRNA sequences
从两个基因组合序列的单倍型分布来看, 27个单倍型中具有优势单倍型Hap6, 包含46个个体, 出现频率为30.87%, 分布于除ZDS群体以外的3个群体; 其次占优势的单倍型为Hap2, 包含29个个体, 出现频率为19.46%, 4个群体中均有出现; 其他各单倍型包含的个体数1—15不等。由此说明, 单倍型在各群体中分布不均, 优势单倍型与其他单倍型包含的个体数量相差极大。从各群体的单倍型多样性来看, SF群体包含的单倍型数目最多, 共有19个单倍型, ZD2S群体次之, 共11个。通常来说, 优势单倍型的个体适应能力强, 拥有更大的繁殖群体, 而低频率的单倍型则因环境适应能力差, 拥有的繁殖群体较小, 更容易对整个种群的遗传多样性造成不利影响[25]。另一方面, 优势单倍型体现了前期人工选择过程中的育种方向, 定向选育过程中保留了成活率高、生长性状优良的个体, 从而使优势单倍型包含的群体数量逐渐扩大。另外, 单倍型的聚类分析结果显示, SF和ZD2S群体拥有的单倍型, 在两个分支中均有较多的分布, 也体现出这两个群体具有丰富的多样性。
3.3 微卫星和线粒体基因的群体遗传多样性及遗传分化比较
本研究基于微卫星位点的等位基因数目(Na)、期望杂合度(He)和多态信息含量(PIC)等遗传多样性参数估计结果表明, 在4个育种群体中, SF群体的遗传多样性最高, 其次为ZD2S群体。该结果与基于线粒体COⅠ和12S rRNA基因组合序列的单倍型多样性(Hd)、核苷酸多样性(π)及单倍型聚类分析等结果较为一致, 均表明SF和ZD2S群体的遗传多样性较为丰富, 具有进一步选育的潜力。
从群体间的遗传分化来看, 微卫星位点分析结果显示各群体两两间均存在极显著的遗传分化, 且几乎均为中等程度分化, 而两个线粒体基因组合序列分析则显示群体间的遗传分化较小, 除ZD2S群体和ZDS群体的FST值(0.07310)大于0.05属于中度分化外, 其余均较小或为负值, 几乎不存在分化。这表明微卫星标记用于检测近缘种群间的遗传分化时比线粒体基因具有更高的灵敏度。
综合微卫星和线粒体基因分析结果, 在罗氏沼虾4个育种群体中, SF和ZD2S两个群体具有较高的遗传多样性, 可作为良好的选育材料。但已有的这4个群体间遗传分化不大, 若能引进遗传多样性更为丰富的、与这4个群体具有高度分化的种质资源,将更有利于优良品种的选育。

