miR-26b-3p对乳腺癌细胞生物学行为的影响及作用机制研究
邢台市人民医院检验科,河北 邢台 054001
乳腺癌是女性常见的恶性肿瘤之一。2018年的统计学数据显示,乳腺癌占全球女性恶性肿瘤发病率的24.2%,占女性恶性肿瘤死亡率的15.0%[1]。在中国,乳腺癌发病率也逐年上升,且呈现年轻化的趋势。近年来,随着分子生物学技术的发展,越来越多的非编码RNA分子被发现与乳腺癌的发生、发展密切相关,其中miRNA在乳腺癌研究领域中占据着重要地位。
miRNA是一类长度为21~23个核苷酸的单链非编码RNA分子,其作用机制主要为靶向于mRNA的3’非翻译区(3’ untranslated region,3’UTR)从而抑制其靶基因的表达[2]。越来越多的研究[3]证实,miRNA在肿瘤的发生、发展过程中发挥着关键作用。有研究[4]证实,miR-26b-3p可靶向于泛素化特异性蛋白酶39(ubiquitin-specific protease 39,USP39),在鼻咽癌的进展中发挥重要作用。然而,关于miR-26b-3p在乳腺癌中的研究尚未见报道,本研究探讨miR-26b-3p在乳腺癌细胞中的表达及对乳腺癌细胞生物学行为的影响,为乳腺癌的防治提供新的线索。
1 材料和方法
1.1 细胞系及主要试剂
人乳腺癌细胞系MCF-7、MDA-MB-231和MDA-MB-453均购自武汉普诺赛生命科技有限公司。RPMI-1640培养基、胰蛋白酶和胎牛血清均购自美国Gibco公司,青链霉素双抗混合液购自上海翊圣生物科技有限公司,Hiperfect Reagent转染试剂购自德国Qiagen公司,TRIzol Reagent购自美国Invitrogen公司,实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQ-PCR)Mix购自美国Promega公司,Hiperfect转染试剂购自德国Qiagen公司,细胞计数试剂盒(cell counting kit-8,CCK-8)购自美国MCE公司,双荧光素酶报告试剂盒购自美国Promega公司,transwell小室购自美国Corning公司,Matrigel购自美国BD公司,BALB/c裸小鼠购自北京华阜康生物科技股份有限公司。
1.2 RTFQ-PCR检测miR-26b-3p在乳腺癌细胞系中的表达
采用RTFQ-PCR检测3种乳腺癌细胞系MCF-7、MDA-MB-231和MDA-MB-453中miR-26b-3p的表达水平。使用TRIzol提取细胞的总RNA,使用美国Promega公司反转录和扩增试剂盒制备cDNA模板,并进行RTFQ-PCR扩增,条件为95 ℃ 5 min;95 ℃ 15 s,58 ℃ 30 s,72 ℃ 30 s,40个循环。miR-26b-3p和内参基因U6的特异性反转录和扩增引物购自广州锐博生物技术有限公司。采用2-△△Ct法计算miR-26b-3p的平均相对表达量。
1.3 miR-26b-3p mimics的转染
阴性对照(negative control,NC)和miR-26b-3p mimics质粒购自广州锐博生物技术有限公司。MDA-MB-453细胞长至对数生长期,以1×106个细胞/孔种植于6孔板中培养24 h,按照Hiperfect Reagent推荐的转染方法,每孔中分别加入10 μL的miR-26b-3p mimics或NC质粒和50 μL不含胎牛血清的RPMI-1640培养基。另将4 μL Hiperfect Reagent加至50 μL不含胎牛血清的RPMI-1640培养基中,分别混匀静置5 min。再将质粒与转染试剂混匀,室温静置20 min,加至每孔使终体积达到2 mL。转染6~8 h后,更换新鲜的完全培养基,继续温育24~48 h。
1.4 CCK-8实验检测细胞增殖
MDA-MB-453细胞长至对数生长期,按照5×103个细胞/孔接种于96孔板中,每孔加入100 μL细胞悬液。分别于第0、24、48、72和96 h时在每孔中加入10 μL CCK-8试剂,轻轻摇匀后置于37 ℃、CO2体积分数为5%的细胞培养箱中温育1~2 h。使用酶标仪测量细胞于450 nm处的吸光度(D)值。
1.5 Transwell迁移和侵袭实验
将低温融化的Matrigel与无血清RPMI-1640培养液按照1∶7稀释,混匀后加20 μL到24孔板中,放置在37 ℃、CO2体积分数为5%的培养箱中过夜凝固。选取对数生长期的MDA-MB-453细胞重悬于200 μL不含胎牛血清的RPMI-1640培养基中,按照2×105个细胞/孔的密度接种于transwell小室上,在24孔板的每孔中加入800 μL带胎牛血清的RPMI-1640完全培养基。注意向24孔板中加Matrigel时检测细胞的侵袭能力,不加Matrigel时则检测细胞的迁移能力。在细胞培养箱中温育48 h后,用4%多聚甲醛溶液固定20 min,然后结晶紫染色10 min,在普通光学显微镜下观察计数穿膜的细胞数目并拍照。
1.6 动物实验
所有动物实验均经邢台市人民医院实验动物委员会批准。选用4周龄BALB/c裸小鼠,随机分为2组(每组5只)。荧光素酶标记的MDAMB-453细胞(Luc-MDA-MB-453)转染miR-26b-3p mimics或NC 24 h后分别皮下注射BALB/c裸小鼠(每只裸小鼠注射0.2 mL浓度为1×107个细胞/mL的细胞悬液)建立人乳腺癌细胞裸小鼠移植瘤模型,每隔3 d通过皮下注射miR-26b-3p agomir和NC agomir,采用小动物活体成像技术检测移植瘤的大小。对于裸鼠的转移瘤模型,选用4周龄BALB/c裸小鼠,随机分为2组(每组5只)。MDA-MB-453细胞株转染miR-26b-3p mimics或NC后分别经尾静脉注射裸小鼠(每只裸小鼠注射0.2 mL浓度为1×105个细胞/mL的细胞悬液),每隔3 d通过尾静脉注射miR-26b-3p agomir和NC agomir,12周后处死,解剖肝组织计数转移瘤的结节数目,然后将肝组织固定于4%多聚甲醛溶液中,作H-E染色检测病理学改变。
1.7 双荧光素酶报告基因分析
将miR-26b-3p mimic和锌指E盒结合同源盒基因1(zinc finger E-box binding homeobox 1,ZEB1) 3’UTR野生型(wild-type,WT)或突变型(mutant,MUT)同时转染到HEK-293T细胞中,转染后48 h收集细胞,用双荧光素酶报告系统进行分析。
1.8 统计学处理
采用SPSS 22.0软件进行数据分析。计量资料的数据用x±s表示,组间的两两比较采用Student’st检验。P<0.05为差异有统计学意义。
2 结果
2.1 miR-26b-3p在乳腺癌细胞系中的表达
本实验选取3种人乳腺癌细胞系MCF-7、MDA-MB-231和MDA-MB-453,采用RTFQ-PCR检测这3种细胞系中miR-26b-3p的表达水平。结果显示,乳腺癌细胞系MCF-7、MDA-MB-231和MDA-MB-453中miR-26b-3p的相对表达量分别为1.01±0.08、4.57±0.28和8.37±0.29(图1)。其中,MDA-MB-453细胞中miR-26b-3p的表达水平最低,因此选用MDA-MB-453细胞进行miR-26b-3p的过表达实验。
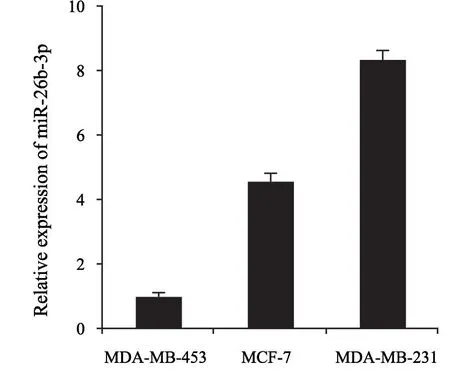
图1 miR-26b-3p在3种乳腺癌细胞系MCF-7、MDA-MB-231和MDA-MB-453中的表达Fig.1 miR-26b-3p expression in three human breast cancer cell lines MCF-7,MDA-MB-231 and MDA-MB-453
2.2 转染miR-26b-3p mimics对乳腺癌细胞MDA-MB-453中miR-26b-3p表达的影响
本实验利用miR-26b-3p模拟物miR-26b-3p mimics转染乳腺癌细胞MDA-MB-453后,通过RTFQ-PCR检测细胞中miR-26b-3p的转染效率。miR-26b-3p mimics转染组的MDA-MB-453细胞中miR-26b-3p的表达水平与NC组相比显著升高,差异有统计学意义(1 206.00±23.12vs1.00±0.05,P<0.05,图2)。这表明MDAMB-453细胞中miR-26b-3p过表达成功。

图2 RTFQ-PCR检测miR-26b-3p mimics转染后MDAMB-453细胞中miR-26b-3p表达的变化Fig.2 The expression of miR-26b-3p in MDA-MB-453 cells transfected with miR-26b-3p mimics or NC control was detected by RTFQ-PCR
2.3 miR-26b-3p抑制乳腺癌细胞的增殖
将miR-26b-3p mimics转染至乳腺癌细胞MDA-MB-453后,采用CCK-8法检测miR-26b-3p对乳腺癌细胞增殖能力的影响。在转染72、96 h后,miR-26b-3p过表达组中MDA-MB-453的增殖能力与NC组相比显著降低,差异有统计学意义(P<0.05,图3)。
2.4 miR-26b-3p抑制乳腺癌细胞的迁移和侵袭能力
采用transwell迁移和侵袭实验检测miR-26b-3p对乳腺癌细胞MDA-MB-453迁移和侵袭能力的影响。转染miR-26b-3p mimics组中细胞的迁移和侵袭数目与NC组相比显著减少,差异有统计学意义(P<0.05,图4)。

图3 通过CCK-8法检测miR-26b-3p对乳腺癌细胞MDAMB-453增殖能力的影响Fig.3 The effect of miR-26b-3p on the proliferation of breast cancer cell MDA-MB-453 was measured by CCK-8 assay

图4 Transwell实验检测转染miR-26b-3p mimics后乳腺癌细胞MDA-MB-453的迁移和侵袭能力Fig.4 The migration and invasion abilities of MDA-MB-453 cells after transfection with miR-26b-3p mimics were detected by transwell migration and invasion assay
2.5 miR-26b-3p抑制乳腺癌细胞裸鼠移植瘤的生长和转移
小动物活体成像结果显示,转染miR-26b-3p mimics后,乳腺癌细胞裸鼠移植瘤的生长显著降低,差异有统计学意义(P<0.05,图5)。乳腺癌裸小鼠肝转移模型结果显示,转染miR-26b-3p agomir后,乳腺癌细胞肝转移的能力显著降低,差异有统计学意义(P<0.05,图6)。

图5 小动物活体成像结果显示,转染miR-26b-3p mimics后,乳腺癌细胞裸鼠移植瘤的生长显著降低Fig.5 In vivo imaging system results revealed that enforced expression of miR-26b-3p inhibited tumor growth of breast cancer xenografts

图6 裸鼠肝转移模型结果显示,转染miR-26b-3p mimics后,乳腺癌细胞肝转移能力显著下降Fig.6 Liver metastatic model results revealed that enforced expression of miR-26b-3p inhibited breast cancer metastasis
2.6 miR-26b-3p靶向调控ZEB1
TargetScan在线数据库预测发现,ZEB1是miR-26b-3p的靶基因之一,其结合位点见图7A,双荧光素酶报告基因分析结果显示,miR-26b-3p显著抑制野生型ZEB1 3’UTR荧光素酶活性(P<0.05),而对突变型ZEB1 3’UTR荧光素酶活性无影响(图7B)。RTFQ-PCR和Western检测结果显示,过表达miR-26b-3p后显著下调MDA-MB-453细胞中ZEB1基因和蛋白的表达水平(P<0.05,图7C~D)。结果表明,ZEB1是miR-26b-3p的直接靶基因,且miR-26b-3p可负调控ZEB1的表达。

图7 ZEB1是miR-26b-3p的靶基因Fig.7 ZEB1 is a target gene of miR-26b-3p
3 讨 论
miRNA是近年来研究较为广泛的一类非编码RNA分子,其在真核细胞内普遍存在,其作用机制主要为靶向于mRNA的3’UTR,从而抑制下游靶基因的表达[5]。多项研究[6-9]表明,miRNA在恶性肿瘤的发生、发展中发挥至关重要的作用,其参与肿瘤细胞的多种生物学功能,包括细胞的增殖、凋亡、侵袭、转移、自噬及化疗耐药等。然而,关于miR-26b-3p在肿瘤中的研究还较少,尤其在乳腺癌中的研究尚未见报道。
本研究采用RTFQ-PCR检测了3种乳腺癌细胞系中miR-26b-3p的表达水平,发现miR-26b-3p在乳腺癌细胞系MDA-MB-453中的表达水平最低。因此,本研究采用MDA-MB-453转染miR-26b-3p mimics,采用CCK-8实验、transwell迁移和侵袭实验检测miR-26b-3p对乳腺癌细胞增殖、迁移和侵袭能力的影响。本研究结果表明,miR-26b-3p能够抑制乳腺癌细胞的增殖、迁移和侵袭能力。体内裸小鼠移植瘤和转移瘤实验表明,miR-26b-3p能够抑制乳腺癌裸小鼠移植瘤的生长和转移。为进一步探究miR-26b-3p影响乳腺癌功能的分子机制,本研究采用TargetScan在线数据库对miR-26b-3p的下游靶基因进行预测,结果发现miR-26b-3p与ZEB1存在结合位点。
ZEB1是一种具有锌指结构域的转录因子,其在乳腺癌中广泛表达且调节多种生物学功能,包括细胞的增殖、分化、血管生成、化疗耐药、干细胞活性、上皮-间充质转化及肿瘤转移等[10-16]。ZEB1在细胞中的调控机制目前还未完全阐明,miRNA有可能参与了肿瘤发展过程中ZEB1的调控。本研究结果表明,miR-26b-3p能通过直接结合ZEB1从而抑制乳腺癌细胞中ZEB1的表达,从而抑制乳腺癌细胞的增殖、迁移和侵袭能力。本研究初步阐明了miR-26b-3p作为非编码RNA在乳腺癌细胞中发挥的生物学功能及其潜在的分子机制,为今后进行深入研究奠定了必要的基础。

