外泌体作为靶向治疗载体的研究进展
复旦大学附属公共卫生临床中心,上海201508
外泌体特指通过晚期多泡体(multivesicular bodies,MVB)与质膜融合后分泌的磷脂双分子层包裹的直径为80~150 nm的囊泡,形态特征为“cup”状,最初是在体外培养的绵羊红细胞的上清中发现,当时被认为是细胞消除不必要蛋白的机制[1]。后来研究[2]发现,外泌体可以传递功能分子如核酸、蛋白、脂质等到靶细胞并发挥功能。2013年诺贝尔奖颁给了在囊泡运输领域有重大贡献的科学家。外泌体作为细胞间交流方式的发现,不仅为很多生理或疾病过程提供了新解释[3],而且还被开发为载体治疗和疾病诊断的工具。
1 外泌体的生理过程
虽然外泌体也有质膜来源的大小和功能相同的细胞外囊泡[4],但是目前的研究主要集中在以CD63和CD9为标志物的内体来源的外泌体,专门研究质膜来源的细胞外囊泡的研究较少。外泌体的产生过程:由鞘磷脂酶(sphingomyelinase,SMase)和内体分选复合物(endosomal sorting complex required for transport,ESCRT)产生的神经酰胺促进MVB内部的囊泡形成,之后MVB与细胞膜融合分泌外泌体。外泌体的分泌需要二磷酸腺苷核糖基化因子6(adenosine diphosphate ribosylation factor 6,ARF6)[5]、Rab27a/b[6-7]和肌动蛋白细胞骨架的解聚[8-9],液泡三磷酸腺苷(adenosine triphosphate,ATP)酶介导的MVB酸化可能是外泌体分泌的特异性控制机制[10]。外泌体被摄取和运输内容物到靶细胞的过程还没有确切的定论。外泌体与靶细胞之间特异性的、非特异性的和随机的结合甚至跨物种的结合有结论支持[2]。虽然对外泌体的生命过程还未完全阐明,但是基于外泌体的各种研究和应用发展迅速。
2 外泌体的应用
目前外泌体的应用有许多。在诊断领域,Goldie等[11]研究发现,在所有的小RNA中,miRNA在外泌体中所占的比例比它们的来源细胞更高。血清中长链非编码RNA HOTAIR可作为多形性胶质母细胞瘤的新型诊断和预后标志物[12];外泌体与癌症相关的研究[13]发现,来自鼻咽癌的外泌体携带转移相关的miR-23a通过抑制全新的靶基因TSGA10来介导血管生成。吉西他滨抗性细胞通过外泌体传递miRNA-222-3p转移其恶性特征[14]。最近的研究[15]也表明,化疗药物紫杉醇和多柔比星,可以促进肿瘤释放外泌体,改变肺的微环境,促进乳腺癌肺转移。还有研究[16]发现,肿瘤细胞分泌的外泌体膜表面表达程序性死亡[蛋白]配体-1(programmed death ligand-1,PD-L1)抑制免疫反应,保护肿瘤细胞的生长。与免疫相关的研究[17]显示,T细胞通过转移外泌体DNA启动树突状细胞(dendritic cell,DC),支持抗原依赖性接触和在保护DC免受病原体感染方面发挥特定作用。来自活化中性粒细胞的外泌体是导致慢性阻塞性肺病的致病元凶[18]。外泌体作为亲本细胞的“信使”,“忠诚”地履行着亲本细胞赋予的使命,例如在致病细胞中可作为致病实体[18]或防御手段[16],在正常细胞中可作为细胞间交流的机制,发挥积极的作用。
在靶向治疗应用方面,虽然对外泌体的靶向运输机制还不完全了解,但是外泌体作为靶向治疗载体的概念已被广泛接受并在动物模型中获得成功。例如,Alvarez-Erviti等[19]静脉注射靶向小鼠大脑的外泌体可以改善小鼠的阿尔茨海默病,Ohno等[20]静脉注射携带miRNA药物的外泌体靶向治疗表皮生长因子受体(epidermal growth factor receptor,EGFR)高表达的乳腺癌。Kamerkar等[21]利用外泌体靶向KRAS突变的胰腺癌,显著抑制肿瘤的生长。Yang等[22]利用细胞纳米穿孔技术产生了比传统方法多50倍的外泌体,解决了限制外泌体应用中产量不足的难题。外泌体的靶向治疗在实验室取得的初步成果也引起了商业公司的关注。目前外泌体靶向改造较为成熟的有瑞士Roche公司和美国PureTech Health公司的乳源外泌体平台技术和美国Codiak公司的engExTM精密外泌体工程平台。在临床试验方面,关于外泌体靶向治疗的临床试验较少,通过美国临床试验登记系统查询,目前仅有1例外泌体靶向治疗试验进入Ⅲ期临床阶段,启动时间为2014年,目前状态为未知。进入Ⅱ期临床试验的有3例,目前正在进展的项目有:植物来源的外泌体携带姜黄素来治疗结直肠癌已经进入Ⅱ期临床试验阶段。
3 外泌体与靶向治疗
3.1 外泌体作为靶向治疗载体的优势
外泌体和脂质体与纳米材料载体相比有很多优势,例如:低免疫原性,来源于D C的外泌体含有主要组织相容性复合体(major histocompatibility complex,MHC)Ⅰ类和Ⅱ类分子[23],因此不会被免疫细胞清除;半衰期长,外泌体表面高表达CD47蛋白[21],CD47蛋白是一种广泛表达的整联蛋白相关跨膜蛋白,是信号调节蛋白α(signal regulatory protein α,SIRPα)的配体,CD47-SIRPα结合引发“不要吃我”抑制吞噬作用的信号[24],可以防止外泌体被单核细胞或巨噬细胞吞噬,增加外泌体在体内的半衰期;外泌体还具有穿透血脑屏障、胎盘屏障的能力[19];外泌体可以与传统的病毒载体结合使用,形成一种功能更强的基因治疗工具,如Orefice等[25]利用外泌体包裹腺相关病毒(adeno-associated virus,AAV)载体来靶向治疗神经退行性疾病,动物实验获得了良好的效果,为脑部疾病的治疗带来了希望。外泌体载体的以上优势吸引了越来越多的研究者去研究外泌体载体,拓展了外泌体载体的应用范围。
3.2 外泌体作为靶向治疗载体的基础
外泌体在细胞间的通讯交流中扮演着重要角色,在人体中,外泌体携带着蛋白、核酸和脂质等大量生命信息,需要遵循人体运行的有序性,否则必然会导致人体信息传递的错乱,破坏人体功能的平衡,所以有理由相信外泌体在体内是靶向运输的,这为开发外泌体的靶向改造提供了可能性。Alvarez-Erviti等[19]通过改造产生外泌体的母细胞,使其分泌的外泌体膜表面产生靶向目标细胞的蛋白,从而使外泌体产生所需的靶向性,证明可以对外泌体进行靶向性改造。之后越来越多的研究涌向外泌体的靶向治疗领域。
3.3 外泌体的靶向性改造技术
外泌体的产生受亲本基因的控制,通过基因工程手段导入融合归巢蛋白和外泌体的转膜蛋白的基因到亲本细胞中,使得想要的蛋白展示在外泌体膜表面。对外泌体进行靶向改造的过程就是膜蛋白展示的过程。目前已经验证的转膜蛋白和归巢蛋白的组合见表1[26]。
归巢蛋白与在外泌体膜表面已知富集的跨膜蛋白融合,从而展示在外泌体膜表面。对于利用乳凝集素C1C2结构域作为锚定点的组合,因为凝集素是膜相关蛋白,而不是跨膜蛋白,所以使用凝集素C1C2结构域作为外泌体膜表面的锚点没有利用外泌体的转膜蛋白可信[34]。以下简要介绍溶酶体相关膜蛋白2(lysosomal-associated membrane protein,Lamp2)和血小板衍生的生长因子受体(platelet-derived growth factor receptor,PDGFR)的研究。Alvarez-Erviti等[19]利用未成熟的DC作为工程化外泌体的来源,通过将狂犬病毒糖蛋白(rabies viral glycoprotein,RVG)基因和一种在外泌体膜表面富集的Lamp2b基因融合,然后利用载体转染未成熟的DC,获得表面表达融合蛋白的外泌体,靶向神经系统中的乙酰胆碱受体,将RVG和Lamp2b的基因融合克隆到载体上并转染未成熟的DC,被展示在外泌体表面的Lamp2b-RVG蛋白将会靶向神经细胞。提纯之后的外泌体利用电穿孔的方法装载GAPDH-siRNA,静脉注射结果发现小鼠脑中的神经元、小胶质细胞和少突胶质细胞中的GAPDH基因被敲除,预暴露于RVG-外泌体并没有导致敲除削弱,除脑以外的其他组织中并未发现非特异性的敲除。使用外泌体装载siRNA靶向治疗阿尔茨海默病在小鼠实验中获得了较好的结果,与野生型小鼠相比较,靶向治疗组的小鼠体内的β分泌酶1(β-secretase 1,BACE1)的60%水平的mRNA和62%水平的蛋白质被敲除。证明外泌体不仅可以获得性地形成靶向性而且可以穿透血脑屏障,已在治疗阿尔茨海默病方面显示出巨大潜力。
Ohno等[20]利用HEK-293细胞作为外泌体的来源,利用特殊的pDisplay载体携带靶向基因转染HEK-293细胞。利用表皮生长因子(epidermal growth factor,EGF)和GE11多肽靶向EGFR高表达的乳腺癌细胞,利用脂质体转染的方法使外泌体加载siRNA(let-7a miRNA)。pDisplay载体中含有PDGFR跨膜区域,将会促进蛋白质在质膜上的表达。融合基因中设置血细胞凝集素(hemagglutinin,HA)抗体基因标签,以便于后续的检测和筛选。GE11是通过噬菌体展示技术筛选出的一种含有11个氨基酸残基的多肽,能高效地靶向结合于细胞膜表面的EGFR受体。该实验靶向性获得的策略延续了上述研究,但是该研究利用电穿孔法并不能成功的装载siRNA到外泌体,作者认为可能是由于细胞类型不同,分泌的外泌体也有差异。
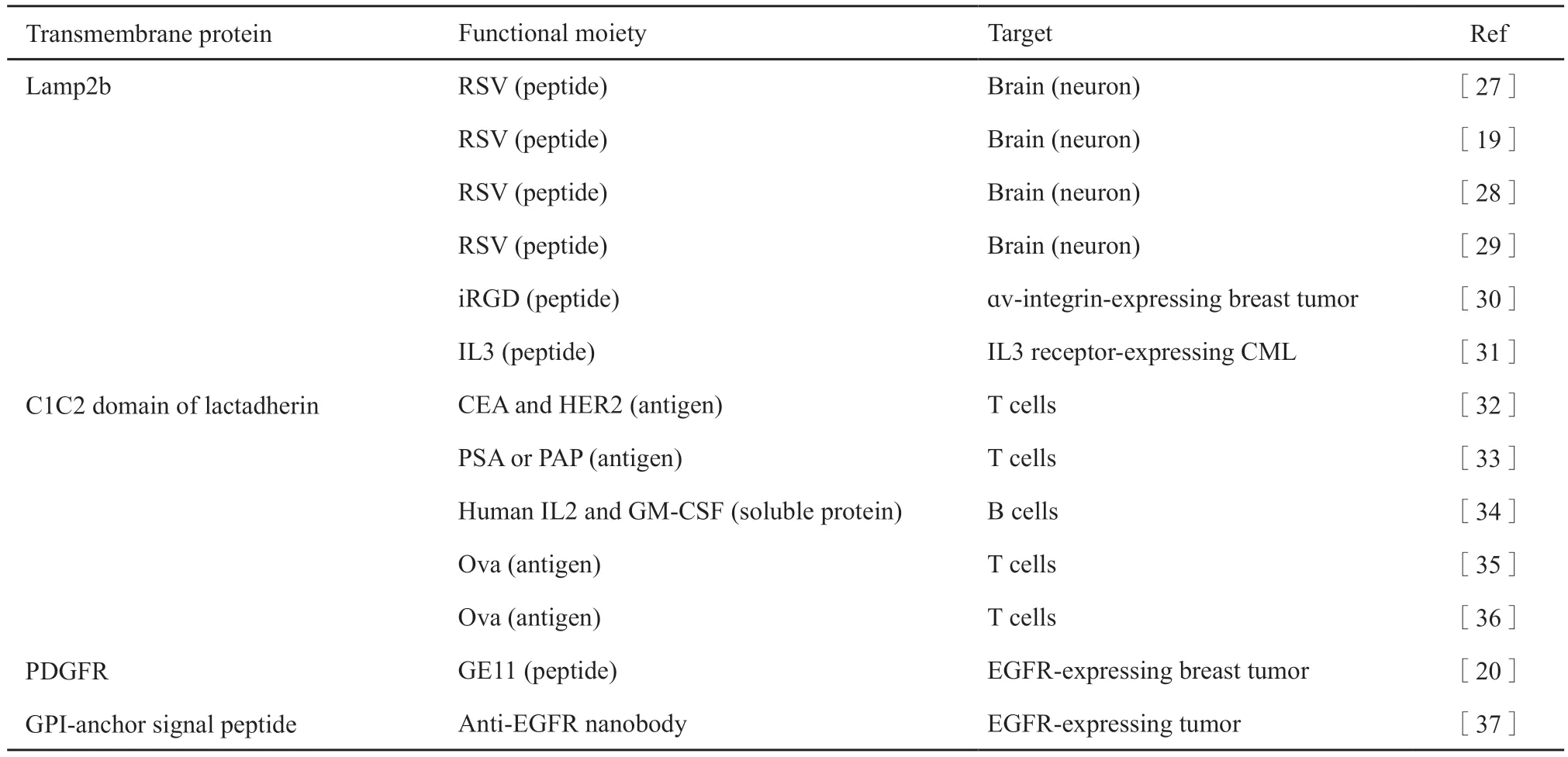
表1 用于外泌体膜表面展示的与跨膜结构域融合的功能肽Tab.1 Functional peptides fused with transmembrane domains for exosome membrane surface display
通过转膜蛋白和归巢蛋白相融合的策略能将多肽展示在外泌体膜表面,但是也会有一些问题,例如,展示在外泌体膜表面的归巢肽有时会被细胞内或体液中的蛋白酶降解从而失去其靶向性,在有靶向性的多肽的N端,利用工程手段加入一个糖基化多肽序列GNSTM可以保护靶向多肽免遭蛋白酶降解,增加在细胞和外泌体中的表达,增强外泌体对靶细胞的靶向能力。另一方面,如果归巢肽相对分子质量太大,当其和膜蛋白融合的时候,会干扰融合蛋白的表达或正确折叠,因此寻找受体的核心短片段,尽量减少归巢肽的相对分子质量对于解决外泌体作为靶向治疗载体的靶向性难题具有重要意义。
3.4 外泌体的装载技术
3.4.1 核酸药物的装载
外泌体内部包含miRNA、RNA、DNA和其他非编码RNA,说明外泌体具有对核酸药物的天然包容性,目前外泌体装载治疗性的miRNA的研究相对较多,详见表2。

表2 外泌体装载核酸药物的方法Tab.2 Method for loading exosomes with nucleic acid drugs
电穿孔法一直被用来处理细胞,是一种高效、经济的膜穿孔方法,在外泌体装载负荷时也被证明是可行的,但是该方法目前被发现存在一定的缺陷,例如,Kooijmans等[37]认为电穿孔可能会导致siRNA的聚集并随外泌体共同沉降,出现假阳性的结果,当无外泌体存在时,siRNA在经过电穿孔处理之后,纳米粒径分析和共聚焦显微镜揭示比有外泌体存在情况下相等或更多的不溶的siRNA聚合物,这些不溶物将会随外泌体一起沉降,在后续实验中产生假阳性的结果,解决方法可通过在电转缓冲液中加乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)或柠檬酸盐(更高效)来减少siRNA的聚合。
然而并不是所有细胞来源的外泌体都可以用电穿孔法,例如,Ohno等[20]发现,当使用HEK-293细胞而不是DC作为外泌体来源的时候,电穿孔法不能有效地加载siRNA,而脂质体转染法却能成功地装载,研究者认为可能是细胞类型不同导致的,具体原因需进一步探究。虽然脂质体转染法相对于电穿孔法效率较低,使用的较少,但是当有些细胞不能使用电穿孔法的时候可作为备用选择。
Haney等[24]也尝试利用室温温育、反复冻融、声波降解和挤压法来使外泌体装载过氧化氢酶,发现装载效率:室温温育<反复冻融<声波降解≈挤压法,推断可能是在超声和挤压时形成瞬时孔或外泌体膜重组使得过氧化氢酶可以从周围递质中扩散到外泌体内部。该方法是否也适合miRNA的装载还需要进一步验证。
3.4.2 蛋白质的装载
蛋白质药物相对于基因药物更直接,但是直接进入生物体内的蛋白质药物容易引起免疫反应而被清除。自体产生的外泌体不会引起机体的免疫反应,其囊泡结构也能保护药物蛋白不受体内环境的影响,是一种极具优势的蛋白质药物的载体。目前针对在外泌体中装载蛋白的研究相对较少,以下简单介绍目前外泌体装载蛋白质的技术。
Hong等[41]利用脂质体转染携带PH20透明质酸酶基因的质粒到HEK-293T细胞中,在产生的外泌体表面展示该酶,作用于实体瘤,消化道肿瘤微环境中过多的细胞外基质,抑制肿瘤生长并增加T细胞对肿瘤的浸润。Yim等[42]使用光诱导外泌体装载治疗蛋白,使用蓝光来控制可逆的蛋白与蛋白相互作用模型来影响外泌体内吞过程,该研究小组使用感光色素蛋白2(cryptochrome circadian regulator 2,CRY2)和感光色素相互作用的螺旋-环-螺旋CIBN在450~490 nm波长的蓝光照射时相互黏在一起的原理,将蛋白治疗剂与CRY2相结合,外泌体与CIBN相结合,然后用450~490 nm波长的蓝光照射,此时蛋白质治疗剂和外泌体将会结合在一起。该方法可以将蛋白质治疗剂的负载率提高超过1 000倍。而且新技术不必控制对蛋白质治疗剂的免疫反应,且可诱导蛋白质治疗剂到达靶细胞,是一种高效的外源蛋白装载方法。
Sterzenbach等[43]利用晚期(L-domain)途径形成外泌体的过程中,将外源蛋白装入外泌体的方法,研究发现,WW标签标记的Cre重组酶蛋白可以被晚期(L-domain)途径中的Ndfip1蛋白识别,导致泛素化并被摄入外泌体中。该过程可以被外泌体的抑制剂GW4869所抑制,说明Ndfip1的表达可作为外泌体装载WW-Cre蛋白的分子开关。而且WW-Cre的外泌体能够在受体细胞中诱导DNA重组,表明成功地将外源功能性蛋白质递送到受体细胞。该方法直接利用外泌体的生成机制进行外源蛋白的装载,虽然比较便捷高效,但是目前对外泌体的产生机制尚未完全了解,不确定该方法是否会产生其他不利的影响。
4 结语
外泌体的免疫沉默、膜展示系统、具有靶向性和可渗透生物屏障等优势使人们对它在靶向治疗方面的应用产生了巨大热情,目前关于外泌体靶向治疗的研究进展迅速,但存在一定的局限性,例如,目前多数关于外泌体靶向治疗的研究中,外泌体仅通过物理方法进行质控,而没有考虑其他有类似特征的细胞外囊泡可能的影响。而且同种细胞可分泌不同的外泌体,其异质性对于临床应用也可能有重要意义。有鉴于此,只有对外泌体的产生、释放和传递过程有更深入的了解,才能使得外泌体的应用技术进一步发展。随着分离外泌体的亚类等技术的成熟,外泌体在生物体中的确切功能必将得到阐明。

