CYP450表氧化酶/EET代谢途径通过HIF-1α减轻肥胖小鼠脂肪炎症*
焉晓乘, 牟维娜, 强 晔, 赵蕙琛, 孙 琦,2, 姚晓敏,3, 张玉超, 刘元涛△
(1青岛大学医学院附属青岛市市立医院内分泌科,山东青岛266011;2青岛市胶州中心医院内分泌科,山东青岛266300;3日照市人民医院内分泌科,山东日照276826)
目前糖尿病及肥胖呈全球流行趋势。肥胖与糖尿病密切相关,其病理生理机制尚不清楚,因此,脂肪组织生物学的研究引起广泛关注。研究证实脂肪组织不仅是惰性的脂肪储存库,还是重要的内分泌器官[1],可通过自分泌及旁分泌的方式释放多种细胞因子[2],参与局部和系统的代谢及炎症过程,调节外周组织对胰岛素的敏感性,参与胰岛素抵抗(insulin resistance,IR)的发生发展[3]。同时,脂肪细胞过度膨胀,导致脂肪组织内出现缺氧微环境,诱导脂肪细胞与巨噬细胞表达促炎症因子、巨噬细胞浸润、脂肪细胞坏死等,进一步加重脂肪组织的炎症程度。
环氧二十碳三烯酸(epoxyeicosatrienoic acids,EETs)为花生四烯酸(arachidonic acid,AA)经细胞色素P450(cytochrome P450,CYP450)表氧化酶催化生成的代谢产物[4-5],其中 11,12-EET 和 14,15-EET是多数细胞和血管中EETs的主要存在形式,具广泛的生物效应,如抗炎及促进血管再生[6-7]。我们的前期研究证实,糖尿病小鼠组织中CYP450表氧化酶CYP2J2表达显著降低,EETs可显著促进糖尿病小鼠血管再生,抑制组织炎症反应[8]。还有研究提示EETs在肥胖和IR等方面发挥重要作用[9]。CYP2J2/EET途径在IR中的作用日益受到关注[10],但是相关机制目前国内研究较少。根据已有研究,我们推测CYP450/EET代谢通路可能通过促进血管生成作用减轻肥胖诱导的慢性炎症及IR,并通过设计动物实验进行验证。
材料和方法
1 实验动物
SPF级雄性C57BL/6Cnc小鼠40只,3周龄,体重(19±1)g,购自北京维通利华实验动物技术有限公司,许可证号为SCXK(京)2016-0006。每笼5只饲养在SPF级动物房中,每日光照12 h。自由饮食饮水。
2 主要试剂
11,12-EET 和 14,15-环氧二十碳-5(Z)-烯酸[epoxyeicosa-5(Z)-enoic acid,EEZE]购于 Cayman;兔抗 CD31(1∶300)购于 Abcam;兔抗 CYP2J2(1∶1 000)、鼠抗GAPDH(1∶5 000)及小鼠IL-1β、IL-6、TNF-α和MCP-1 ELISA试剂盒购于Proteintech;鼠抗低氧诱导因子1α(hypoxia-inducible factor-1α,HIF-1α;1∶500)购于EMD Millipore;Phosphatase Inhibitor Cocktail(100×)购于 Cell Signaling Technology;小鼠胰岛素高敏ELISA试剂盒购于Arigo Biolaboratories。
3 主要方法
3.1 肥胖模型构建及分组 将小鼠分为普通饲料组和高脂饲料组,分别喂饲普通饲料和高脂饲料(脂肪提供热量的40%)。每7 d测定小鼠体重,当高脂饲料组小鼠体重超过普通饲料组小鼠30%,确定为肥胖小鼠成功建模。将肥胖小鼠又随机分为:肥胖(obesity,OB)组(生理盐水腹腔注射,n=10)、EET组(0.1 g·kg-1·d-111,12-EET 腹 腔 注 射 ,n=10)[11]和EEZE组(0.1 g·kg-1·d-114,15-EEZE腹腔注射,n=10)[12]。普通饲料组小鼠腹腔注射等量生理盐水作为正常对照(normal control,NC)组(n=10)。干预第7天禁食8 h后于眼眶静脉丛取血,静置30 min后分离血清。最后处死小鼠,取附睾和肾周脂肪置于4%组织细胞固定液固定或液氮内保存。
3.2 ELISA实验测定小鼠血清炎症因子水平 参照ELISA试剂盒说明书,按顺序加入小鼠血清和试剂盒试剂孵育,洗板后加入检测抗体孵育1 h,加入链霉素亲和的辣根过氧化物酶抗体孵育,最后加显色底物。加入终止溶液终止反应后立即使用酶标仪读取波长450 nm的吸光度(A)。用ELISA Calc软件拟合出标准曲线,以标准品的A值为纵坐标,浓度为横坐标。回归分析求出最好的拟合曲线,浓度和A值取对数拟合。依照拟合的回归曲线来求出小鼠血清中MCP-1、TNF-α、IL-6和IL-1β的含量。
3.3 胰岛素抵抗指数(homeostasis model assessment of insulin resistance,HOMA-IR)的测定 根据ELISA试剂盒说明书对血清样品进行处理,计算小鼠血清胰岛素水平。HOMA-IR=空腹血糖水平(mmol/L)×空腹胰岛素水平(mU/L)/22.5。
3.4 Western blot实验 用预冷的RIPA裂解液提取附睾脂肪组织蛋白。应用10%SDS-PEAG后,转模1.5 h,室温脱脂牛奶封闭1 h,4℃I抗孵育过夜,室温II抗孵育1 h,充分洗膜后ECL显像。ImageJ 1.42定量分析结果。
3.5 免疫组化分析 脂肪组织经脱水、石蜡包埋、切片(组织厚度为5µm)、脱蜡和水化、抗原修复、阻断内源性过氧化物酶、血清封闭后,加入I抗4℃孵育过夜,室温II抗孵育50 min,DAB显色,苏木精复染细胞核,脱水封片,显微镜镜检拍照并扫描图片,DAB标记阳性结果显示棕黄色。用QuantCenter 2.1软件(3DHISTECH)分析抗体阳性表达程度,使用组织化学评分(histochemistry score,H-SCORE)对组织染色进行半定量分析。组织学评分方法:将每张切片内阳性的细胞数量及其染色强度转化为相应的数值。H-SCORE=(percentage of cells of weak intensity×1)+(percentage of cells of moderate intensity × 2)+(percentage of cells of strong intensity× 3)。
3.6 RT-qPCR检测脂肪组织HIF-1α的mRNA水平 取10 mg附睾脂肪组织,严格按照试剂盒说明书进行操作提取总RNA,测定浓度后反转录为cDNA,加入扩增反应体系运用RT-qPCR法扩增,40个循环结束后采用2-ΔΔCt法进行相对定量分析,检测目的基因的mRNA相对表达水平。引物序列由生工生物工程(上海)股份有限公司合成,序列见表1。
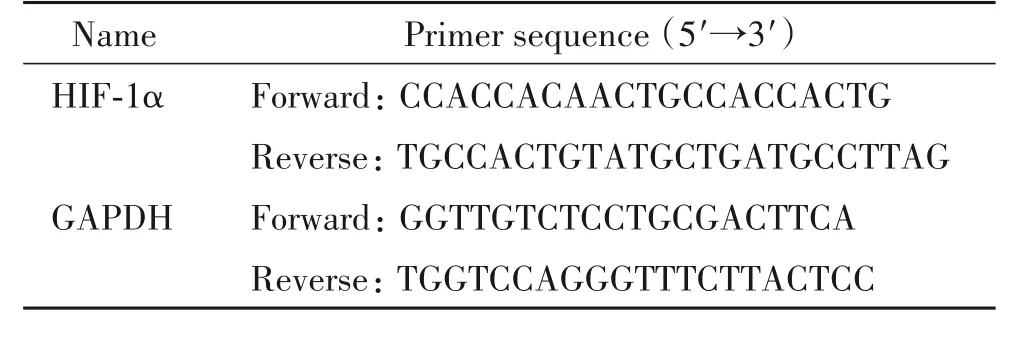
表1 RT-qPCR相关引物序列Table 1.The sequences of the primers for RT-qPCR
4 统计学处理
采用SPSS 1.0.0.1246软件统计分析,各测定值以均数±标准差(mean±SD)表示,各组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 EET可以降低肥胖小鼠胰岛素抵抗水平
与NC组相比,OB组HOMA-IR显著升高(P<0.05);与OB组相比,EET组HOMA-IR显著降低(P<0.01),EEZE组HOMA-IR无显著差异;EEZE组HOMA-IR显著高于EET组(P<0.01),见图1。
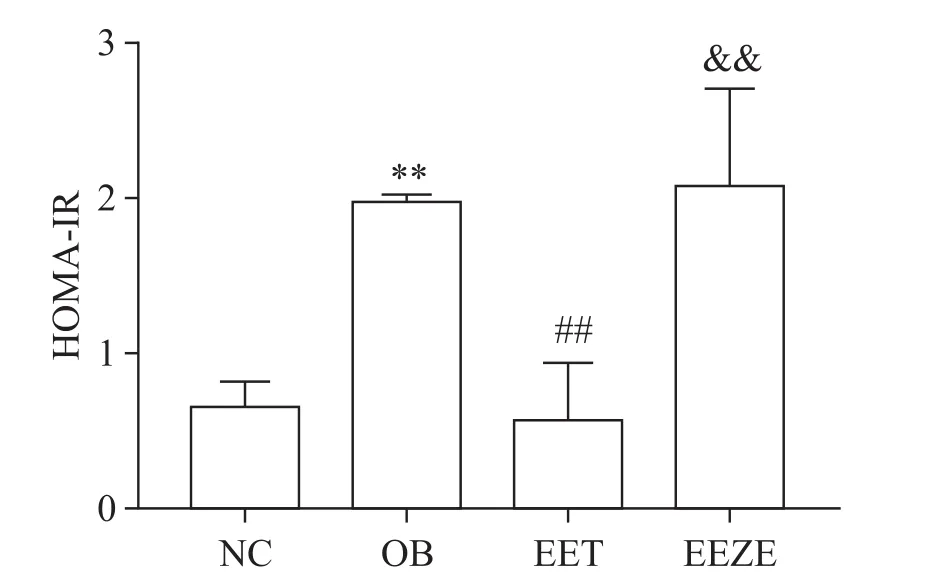
Figure 1.Treatment with EET attenuated insulin resistance in obese mice.Mean±SD.n=10.**P<0.01 vs NC group;##P<0.01 vs OB group;&&P<0.01 vs EET group.图1 EET可以降低肥胖小鼠胰岛素抵抗水平
2 肥胖小鼠CYP2J2蛋白表达水平显著降低
Western blot结果显示,OB、EET和EEZE组小鼠附睾脂肪组织CYP2J2蛋白表达水平均较NC组显著降低(P<0.01),其余组间两两比较差异无统计学意义,见图2。

Figure 2 The protein expression levels of CYP2J2 in epididymal adipose tissues of obese mice were significantly reduced compared with normal C57BL/6JCnc mice.Mean±SD.n=10.**P<0.01 vs NC group.图2 肥胖小鼠CYP2J2蛋白表达水平显著降低
3 EET可以减轻肥胖小鼠脂肪组织缺氧程度
为评估各组小鼠组织缺氧程度,我们检测了小鼠附睾脂肪组织中HIF-1α蛋白的水平。与NC组相比,OB组HIF-1α表达水平显著升高(P<0.01);与OB组相比,EET组HIF-1α蛋白表达水平显著降低(P<0.01);与EET组相比,EEZE组HIF-1α蛋白表达水平显著升高(P<0.01),见图3A。但4组小鼠附睾脂肪组织HIF-1α mRNA水平无显著差异,见图3B。

Figure 3.Treatment with EET attenuated the anoxic conditions in epididymal adipose tissues of obese mice.A:Western blot for determining the protein level of HIF-1α;B:real-time PCR for determining the mRNA level of HIF-1α.Mean±SD.n=10.**P<0.01 vs NC group;##P<0.01 vs OB group;&&P<0.01 vs EET group.图3 EET可以减轻肥胖小鼠脂肪组织缺氧程度
4 EET可降低肥胖小鼠体内炎症因子水平
检测小鼠血清中MCP-1、TNF-α、IL-6及IL-1β水平,结果显示,OB组小鼠血清炎症因子水平显著高于NC组(P<0.05);EET干预7 d后,小鼠血清中4种炎症因子水平与OB组相比显著下降(P<0.05),见图4。
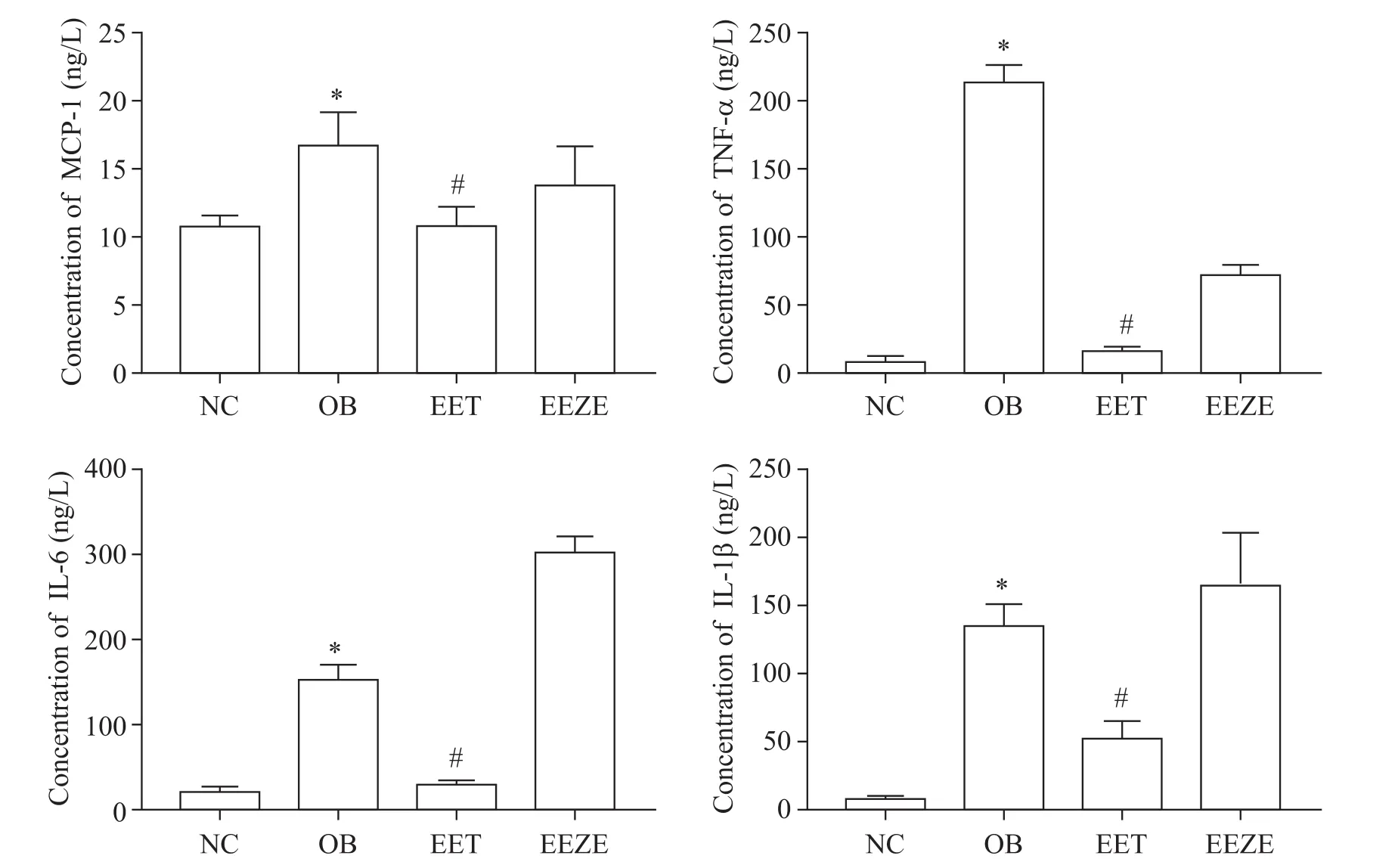
Figure 4.Administration of exogenous EET resulted in reduced production of inflammatory cytokines in the serum of obese mice.Mean±SD.n=10.*P<0.05 vs NC group;#P<0.05 vs OB group.图4 EET可以降低肥胖小鼠体内炎症因子水平
5 EET可以促进肥胖小鼠脂肪组织血管生成
使用CD31标记附睾脂肪组织中血管样组织以检测EET干预后小鼠附睾脂肪组织的血管生成情况。CD31染色如图5箭头所示,与NC组比较,OB组CD31蛋白量减少,EET组CD31染色水平接近NC组。图像统计分析结果显示,在药物干预第7天,与NC组相比,OB组小鼠的H-SCORE显著降低(P<0.05),EET组H-SCORE值与NC组持平;与OB组相比,EET组H-SCORE显著升高(P<0.05)。
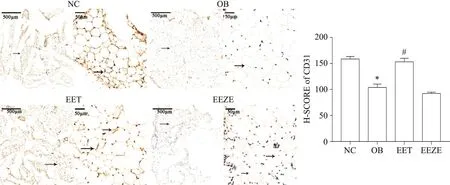
Figure 5.EET promoted angiogenesis in epididymal adipose tissues of obese mice.At day 7 after drug treatment,vessel-like structures(CD31-positive)in epididymal adipose tissues were observed by immunohistochemistry(left:scale bar=500 µm;right:scale bar=50 µm),and histochemistry score(H-SCORE)of CD31 was calculated.Mean±SD.n=10.*P<0.05 vs NC group;#P<0.05 vs OB group.图5 EET可以促进肥胖小鼠脂肪组织血管生成
讨 论
既往研究表明CYP450/EET途径对胰腺细胞功能及外周组织对胰岛素的敏感性有重要影响。5,6-EET可刺激大鼠离体胰岛分泌胰岛素,过表达CYP2J2或可溶性环氧化物水解酶(soluble epoxide hydrolase,sEH)抑制剂可显著减轻小鼠外周IR及代谢功能障碍[13-15]。临床研究显示,2型糖尿病患者循环EET代谢产物的血浆浓度是降低的[16];大鼠实验研究显示,高脂饮食诱导肥胖大鼠肾脏CYP450表达降低[17],提示CYP450/EET途径障碍可能与糖尿病的发生及进展有关。肥胖(尤其是向心性肥胖)是糖尿病发生的重要危险因素之一。目前研究认为肥胖状态下,脂肪炎症可能是导致IR的重要原因,但具体机制尚不明确。本研究旨在探索CYP450/EET通路与肥胖诱导的脂肪炎症及IR的关系并探讨其机制。
大量证据表明,炎症是IR的重要原因。炎症因子通过核因子κB(nuclear factor-κB,NF-κB)和蛋白激酶C(protein kinase C,PKC)系统,抑制胰岛素的磷酯酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,PKB)通路,干扰胰岛素信号转导,导致IR[18]。巨噬细胞和白细胞代谢生成的细胞因子(如TNF-α等)可激活内皮细胞,促进细胞黏附分子(cell adhesion molecules,CAMs)的表达,而CAMs是一类位于细胞膜表面的糖蛋白,是炎症的诱导剂[19]。有研究报道,11,12-EET是对血管细胞黏附分子1(vascular cell adhesion molecule-1,VCAM-1)表达最强的抑制剂[20]。NF-κB是一种广泛存在于各种细胞中的转录因子,因其能与免疫球蛋白κ链基因增强子结合而得名。激活的NF-κB可促进许多致炎因子的转录和表达,被作为炎症治疗的“靶点”。另有研究表明,sEH抑制剂可抑制NF-κB活性,减少炎症细胞浸润[21]。注射外源性EETs可抑制NF-κB的活化和转位,从而显著抑制TNF-α诱导的小鼠颈动脉内皮细胞VCAM-1的表达,减少单核细胞对内皮细胞的黏附[20]。缺氧条件下,CYP2J3/EETs可能通过抑制caspase-3蛋白表达及活性调节心肌细胞活力[22],而11,12-EET可激活肝脏细胞与动脉内皮细胞内缺氧反应元件的启动子活性,诱导HIF-1α稳定表达。可见,CYP450/EET通路与缺氧导致炎症反应有关[23]。
为探讨CYP450/EET代谢通路与肥胖诱导的脂肪组织炎症的关系,我们首先检测了CYP450表氧化酶在肥胖小鼠脂肪组织中的表达,其中CYP2J2蛋白表达水平显著降低。为明确CYP2J2下调与脂肪炎症的相关性,我们观察了外源性EET对脂肪炎症的影响,结果显示肥胖小鼠脂肪组织中炎症因子MCP-1、TNF-α、IL-6和IL-β表达显著增多,外源性11,12-EET治疗可以显著降低脂肪组织中炎症因子的表达水平,而EET拮抗剂14,15-EEZE则导致各种炎症因子显著增加。以上结果提示CYP450表氧化酶表达减少可能是肥胖状态下脂肪炎症的重要因素之一。
缺氧是导致炎症的重要因素之一。本研究观察到,与正常小鼠相比,肥胖小鼠附睾脂肪组织中HIF-1α蛋白表达水平升高,提示肥胖诱导的脂肪炎症可能与缺氧有关。为探讨CYP450/EET对炎症的影响机制,我们观察了外源性EET对血管形成及缺氧的影响。结果显示,EET干预的肥胖小鼠脂肪组织中CD31阳性率显著增增加,而HIF-1α蛋白表达显著下降。上述结果提示,EET可通过促进脂肪组织血管生成,缓解缺氧,从而抑制组织炎症。
综上所述,本研究提示CYP450表氧化酶低表达可能是肥胖诱导IR的重要原因,外源性EET可显著减轻肥胖导致的IR,其作用机制可能与促进血管生成、缓解缺氧、减轻炎症有关。

