阿霉素促进心脏成纤维细胞分泌IL-1β和Ⅰ型胶原蛋白的机制研究*
罗远良, 李梦思, 滕嘉硕, 戴晓萌, 唐翔栩, 邢 云, 吕秀秀
(暨南大学基础医学院病理生理学系,国家中医药管理局病理生理重点实验室,广东广州510000)
蒽环类化疗药物阿霉素(adriamycin)又称多柔比星(doxorubicin,DOX),对白血病、淋巴瘤、乳腺癌和肺癌等疗效显著[1-2]。然而,DOX具有明显的心脏毒性,并且随着使用过程中药物剂量的累积,心脏损伤不断加重,最终发展为心力衰竭。最近观察到肿瘤幸存者在治疗早期就会出现心脏舒张功能障碍,而此时并没有伴有收缩功能障碍。心肌炎症、纤维化以及间质增生等均可引起心室顺应性下降,进而影响舒张功能[3-5]。长期以来,心肌细胞被认为是DOX心脏毒性的经典细胞靶点[6-11]。直到最近,心脏中其它类型细胞才被提出作为DOX心脏毒性的细胞靶点。心脏成纤维细胞占人心脏细胞总数的60%~70%,心脏成纤维细胞受到刺激时,可向肌成纤维细胞表型转化,而肌成纤维细胞是纤维化过程中主要分泌细胞外基质的细胞。随着人们对各种心血管疾病的研究,心脏成纤维细胞在维持心功能方面的意义已被认可[12-13]。炎症是纤维化的重要触发因素。Riad等[14]发现TLR4敲除可减少氧化应激和炎症反应,从而改善DOX性心肌病小鼠左室功能。然而,目前并没有文献报道细菌性感染参与了DOX性心肌病的发生发展。以上结果提示:非细菌性炎症在DOX性心肌病中可能发挥着重要作用。
2010年Zhu等[15]报道,DOX可增加小鼠血清中白细胞介素1β(interleukin-1β,IL-1β)水平,预先给予IL-1受体的拮抗剂可降低小鼠死亡率,改善心功能,减轻心脏损伤及心肌凋亡。IL-1β是天然免疫中非常重要的促炎症因子,其活化需经过表达、成熟、分泌几个阶段[16-20]。Martinon等[21]在2002年首次提出IL-1β的成熟和分泌为炎症小体所调节。炎症小体有多种类型,但目前结构和功能最为明确的仅有核苷酸结合寡聚化结构域样受体蛋白3(nucleotidebinding oligomerization domain-like receptor protein 3,NLRP3)炎症小体。NLRP3炎症小体在结构上包含3个主体部分:(1)NLRP3;(2)配体蛋白——含CARD的凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing CARD,ASC);(3)IL-1β转换酶(IL-1β-converting enzyme,ICE)或 caspase-1[22-24]。越来越多证据表明NLRP3炎症小体与非细菌性炎症密切相关[25-28]。此外,已有研究表明心肌细胞/心脏成纤维细胞中NLRP3介导的非细菌性炎症在病毒性心肌炎、糖尿病性心肌病、心肌梗死以及充血性心力衰竭中发挥重要作用[29-30]。心脏成纤维细胞表达天然免疫系统的成分,包括Toll样受体和NOD样受体,能快速感知内源性危险信号。同时,心脏成纤维细胞亦能表达炎症小体,从而促进IL-1β的激活和分泌[31-33]。但是,DOX对心脏成纤维细胞促炎症因子IL-1β释放以及促纤维化的作用及机制,目前尚未见报道。
材料和方法
1 动物
出生1~3 d的SPF级SD大鼠乳鼠,雌雄不限,采购于广东省广州市南方医科大学实验动物中心,合格证号为No.44002100012730。实验操作严格按照暨南大学实验动物伦理委员会的相关规定进行
2 主要试剂
DMEM培养基(Gibco);HEPES粉、PBS、HBSS和2.5%胰酶(HyClone);含EDTA的胰酶和澳洲胎牛血清(Gibco);青霉素和链霉素(Thermo Fisher);5 mg DOX粉剂(暨南大学附属第一医院)和荧光素标记的山羊抗小鼠Ⅱ抗(Abcam);驴血清封闭液和CCK-8工作液(Dojindo);annexin V-FITC/PI试剂盒(Sigma);RIPA液、BCA试剂定量试剂和配胶试剂盒均购自碧云天公司;TNF-α、IL-1β和IL-6的ELISA试剂盒(R&D);本研究中所用的Ⅰ抗均购自Abcam。
3 主要方法
3.1 成纤维细胞的培养和鉴定 取SD大鼠乳鼠,雌雄不限,放入75%乙醇消毒5~10 s,经异氟烷吸入麻醉后,移入超净台内,用眼科剪打开胸腔,用眼科弯镊找到心脏,将取出的心脏置于预冷的PBS中,并使用眼科直镊轻轻挤压心脏两侧,尽量地去除心脏内残血。再使用眼科镊将心脏组织夹到另外的已提前放入预冷的PBS的培养皿中,尽可能剪除依附着心脏表面的其他组织。用剪刀把心脏组织剪成一半,保留心脏的中间部位至心尖处,用眼科剪将其尽可能剪碎,用微量移液器加入心脏组织量5~10倍体积的0.125%胰酶,用滴管轻轻将组织块吹散,盖上已经高压的锡箔纸,置于37℃恒温搅拌条件下消化。第1次消化7 min,弃上清。再次加入5~10倍的0.125%胰酶消化5 min,重复消化数大概为5~7次后,收集细胞上清液于离心管内,并用微量移液器加入相同体积的完全培养基,终止胰酶的消化。将终止消化的细胞液放入高速低温离心机中进行离心(800 r/min,4℃,7 min)。离心后得到细胞沉淀后,用基础培养基DMEM液重新悬浮起细胞沉淀2次后,弃上清液。用配制好的完全培养基进行细胞沉淀的悬浮,合并每次所得细胞悬液,接种于培养瓶中,置于37℃、5%CO2培养箱中培养1~2 h,通过差速贴壁纯化心脏成纤维细胞。根据实验需要将细胞接种于共聚焦皿中继续培养。成纤维细胞培养48 h后,采用免疫荧光法检测波形蛋白对成纤维细胞进行鉴定。
3.2 CCK-8法检测心脏成纤维细胞的活力 心脏成纤维细胞培养48 h后,分为对照组及1、2和4µmol/L DOX处理组。37℃、5%CO2培养箱中继续培养24和48 h后,每孔加入10µL的CCK-8工作液,混匀后,放入培养箱中继续培养90 min。用多功能全波长酶标仪在450和570 nm双波长处读取每个孔A值,计算出各组成纤维细胞的活力。
3.3 流式细胞仪观察DOX对心脏成纤维细胞凋亡的影响 将心脏成纤维细胞种于6孔板中,培养48 h后,分为对照组和1µmol/L DOX组。继续培养24 h后,用含有EDTA的胰酶,消化细胞4 min;然后加入500µL的完全培养基,终止消化,充分的混匀,收集于1.5 mL离心管中,4℃、1 000 r/min离心5 min。PBS缓冲液洗涤后,1 000 r/min再次离心5 min,收集细胞沉淀,并依此加入100µL Binding Buffer、2.5µL annexin V-FITC及2.5µL PI,室温避光孵育15 min,加入200 µL Binding Buffer混匀,上机检测。
3.4 ELISA试剂盒检测心脏成纤维细胞上清中IL-1β、IL-6和TNF-α的含量 将心脏成纤维细胞种于96孔板中,48 h后分组处理同3.3。分别在培养12和24 h后,收集细胞上清液,根据ELISA试剂盒的步骤依次进行操作,最后使用酶标仪测量450 nm处的吸光度值,设定540或590 nm波长作为校正波长。绘制线性标准曲线,计算细胞上清中各种促炎症因子的含量。
3.5 免疫荧光染色检测心脏成纤维细胞中α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)、波形蛋白(vimentin)和心肌肌钙蛋白 I(cardial troponin I,cTnI)的表达 将心脏成纤维细胞种于6孔板中,48 h后分组处理同3.3。加药处理48 h后,丢弃共聚焦皿中的培养基,加入PBS溶液洗皿3次,每次5 min。加入1 mL 4%多聚甲醛,室温固定30 min后,加入PBS缓冲液洗皿3次,每次5 min。加入0.3%的Triton X-100 1 mL,于4℃冰箱中放置5 min。PBS溶液洗涤洗皿3次,每次5 min。加驴血清封闭液1 mL,室温封闭1 h。配制好Ⅰ抗(抗α-SMA抗体、抗vimentin抗体及抗cTnI抗体)溶液,4℃孵育过夜。Ⅱ抗室温孵育1 h,加入DAPI染色,共聚焦显微镜下进行观察。
3.6 免疫荧光检测心脏成纤维细胞线粒体活性氧簇(mitochondrial reactive oxygen species,mROS)的释放情况 将心脏成纤维细胞种于6孔板中,加药处理同3.3。用13µL的DMSO溶液加入50µg的线粒体超氧化物粉剂中,充分的混匀溶解,配制成5 mmol/L线粒体超氧化物试剂。使用HBSS稀释试剂,将线粒体超氧化物试剂稀释制备成5µmol/L试剂工作液。向共聚焦皿中加入试剂工作液,放在37℃、5%CO2的培养箱中孵育细胞10 min,避光操作;用已恢复室温的PBS缓冲液,洗涤细胞3次;最后每皿加入1 mL的PBS缓冲液,置于共聚焦显微镜下观察。
3.7 Western blot检测相关蛋白水平 DOX处理心脏成纤维细胞24 h后,提取细胞。配制分离胶和浓缩胶,取15µL样品行SDS-PAGE分离,然后转至PVDF膜上,TBST漂洗3次,每次5 min(在摇床上进行),于5%脱脂牛奶中室温封闭1 h后,用Ⅰ抗[抗Ⅰ型胶原(collagen type I,Col I)抗体、抗转化生长因子β(transforming growth factor-β,TGF-β)抗体、抗GAPDH抗体、抗NLRP3抗体和抗caspase-1抗体,均按1∶1 000稀释]4℃孵育过夜。TBST漂洗3次,山羊抗兔Ⅱ抗(1∶8 000)室温孵育1 h后,TBST漂洗3次,每次10 min(在摇床上进行)。超敏ECL化学发光法显色。采用目的蛋白与内参照GAPDH灰度值的比值反映蛋白的表达水平。
4 统计学处理
应用SPSS 17.0软件进行统计学分析。统计数据以均数±标准误(mean±SEM)表示,两组间的均数比较采用独立样本t检验,P<0.05时认为两者的差异具有统计学意义。
结 果
1 心脏成纤维细胞的原代培养及鉴定
免疫荧光染色结果显示,绿色荧光为vimentin,用来标记心脏成纤维细胞;红色荧光为cTnI,用来标记心肌细胞;蓝色荧光为DAPI,标记细胞核。差速贴壁1和2 h后,心肌细胞数量很少,而成纤维细胞数量占细胞总数95%左右,见图1。将获得的心脏成纤维细胞继续培养48 h后,在倒置显微镜下观察可见细胞完全贴壁,体型较小,呈多角形,胞质较少且透亮。
2 DOX对心脏成纤维细胞的损伤作用
经1、2和4µmol/L的DOX处理24和48 h后,心脏成纤维细胞的活力与对照组比较明显下降(P<0.05),其中2和4µmol/L的DOX处理48 h后,细胞相对活力远低于50%,见图2A。
利用annexin-V和PI共染色,可区分早期凋亡、晚期凋亡和坏死细胞。如图2B所示,原代培养心脏成纤维细胞48 h,再用1µmol/L DOX处理24 h后,代表早期凋亡的Q4区及晚期凋亡的Q2区中细胞百分比都很低,与对照组比较差异无统计学意义。

Figure 1.Identification of neonatal rat cardiac fibroblasts(×100).It can be seen from the results that the 2 h time point can ensure the purity of cardiac fibroblasts,and the number of cells is sufficient.图1 心脏成纤维细胞的鉴定
1µmol/L DOX处理心脏成纤维细胞12和24 h,与对照组相比,细胞上清中IL-1β和IL-6的含量显著增加(P<0.05),并具有时间依赖性;但DOX处理心脏成纤维细胞12和24 h后TNF-α并没有显著增加,与对照组比较无显著差异,见图2C。

Figure 2.Effects of doxorubicin(DOX)on cardiac fibroblasts.A:the effect of different concentrations of DOX on the viability of cardiac fibroblasts at 24 and 48 h;B:cultured fibroblasts treated with DOX for 24 h were analyzed by flow cytometry with annexin V-FITC staining;C:the expression levels of IL-1β,IL-6 and TNF-α in cardiac fibroblasts after DOX treatment were detected by ELISA.Mean±SEM.n=3.*P<0.05,**P<0.01 control group.图2 DOX对心脏成纤维细胞的损伤作用
3 DOX对心脏成纤维细胞促纤维化的影响
α-SMA是一种标记平滑肌的肌动蛋白,当各种刺激因素导致成纤维细胞转变为肌成纤维细胞时,就会表达α-SMA。而肌成纤维细胞具有典型的亲纤维化表型。如图3A所示,对照组中成纤维细胞极少数α-SMA染色阳性;而1µmol/L DOX处理24 h后,其中既表达vimentin又表达α-SMA的肌成纤维细胞显著增多。该部分结果提示DOX能促进心脏成纤维细胞向肌成纤维细胞表型转化。
Ⅰ型胶原蛋白是胶原纤维的主要生物化学成分,亦是细胞外基质的组成成分之一。1µmol/L DOX处理24 h后,Ⅰ型胶原蛋白表达量显著增加,与对照组比较有显著差异(P<0.05),见图3B。
TGF-β能够调节Ⅰ型胶原的产生。因此,我们进一步检测心脏成纤维细胞在DOX作用下TGF-β含量的变化。如图3B所示,1µmol/L DOX处理心脏成纤维细胞24 h后TGF-β水平和对照组相比没有显著差异。
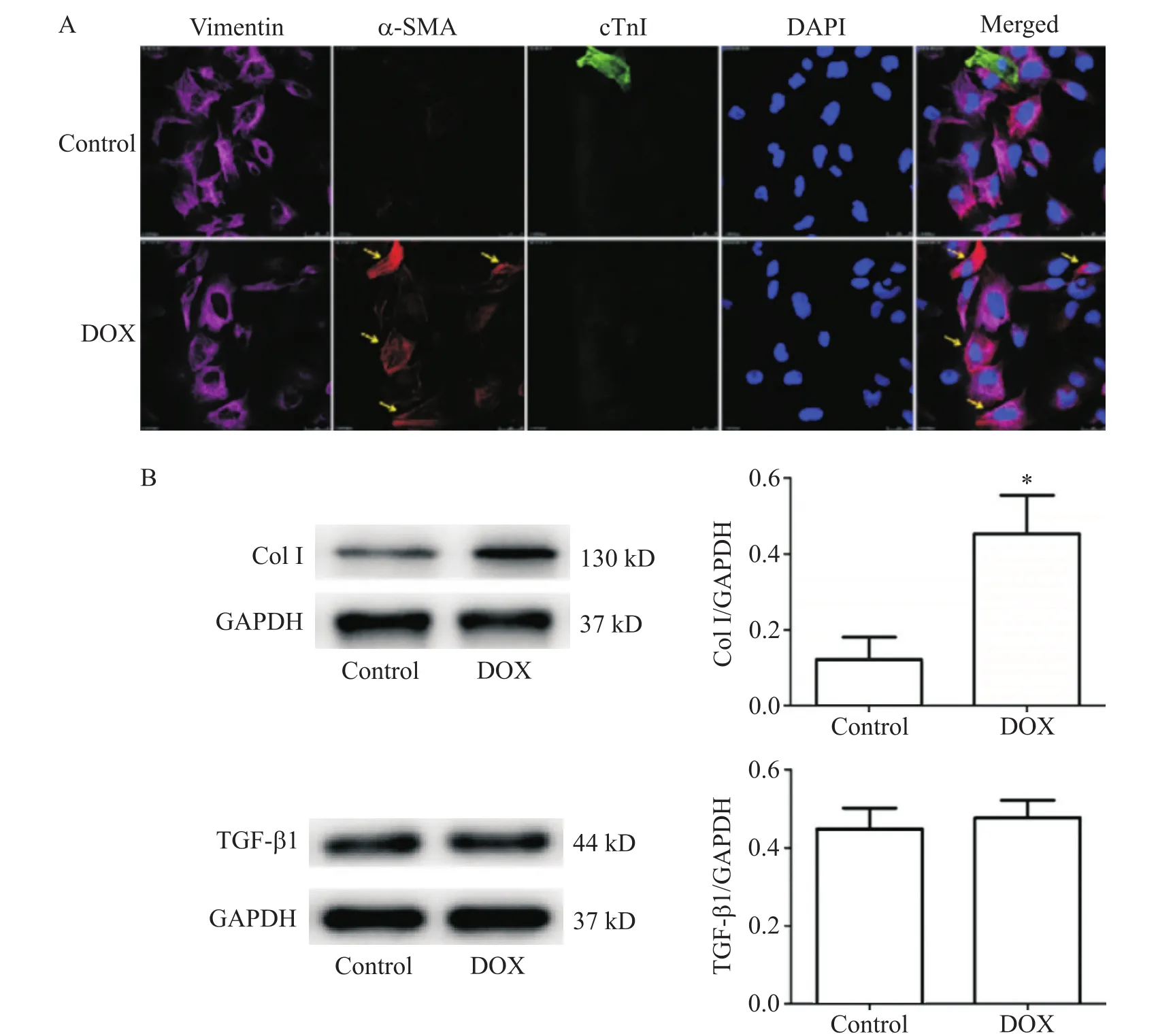
Figure 3.The pro-fibrotic effect of doxorubicin(DOX)on cardiac fibroblasts.A:cardiac fibroblasts treated with DOX for 24 h showed the phenotypic transformation toward myofibroblasts(vimentin is labeled as fibroblasts,α-SMA is labeled as myofibroblasts,cTnI is labeled as cardiomyocytes,and DAPI is labeled as nuclei;×600);B:the effects of DOX on the expression of collagen type I(Col I)and TGF-β1 in cardiac fibroblasts.Mean±SEM.n=3.*P<0.05 vs control group.图3 DOX对心脏成纤维细胞促纤维化的作用
4 DOX促进心脏成纤维细胞释放炎症因子可能与mROS-NLRP3炎症小体途径相关
我们通过线粒体超氧化物试剂标记mROS,结果显示,1µmol/LDOX处理6 h、12 h和24 h后心脏成纤维细胞中代表mROS的红色荧光强度较对照组都有所增加,随机选取5个不同区域,分别测得红色荧光强度值,计算各组平均荧光强度值。DOX处理6和12 h后,心脏成纤维细胞中代表mROS的红色荧光较对照组显著增强(P<0.05),见图4。
Western blot结果显示,给予1µmol/LDOX24 h后,心脏成纤维细胞NLRP3蛋白表达显著增加。同时NLRP3炎症小体中重要成分cleaved caspase-1水平也明显升高,和对照组相比具有统计学意义((P<0.05),见图5。
讨 论
减轻DOX的慢性心脏毒性,是治疗肿瘤过程中面临的重要问题。这种毒性作用表现为剂量累积性和个体耐受差异性。对于化疗患者来说,DOX慢性心脏毒性将成为其终生的潜在威胁。
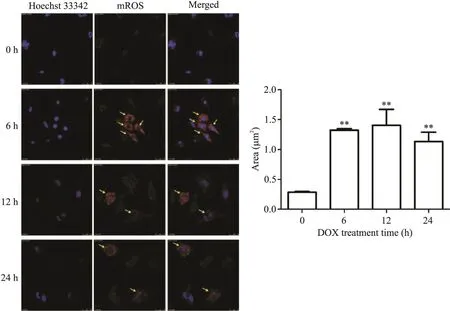
Figure 4.Effect of doxorubicin(DOX)on mROS release in cardiac fibroblasts(×600).Mean±SEM.n=3.**P<0.01 vs 0 h group.图4DOX对心脏成纤维细胞中mROS释放的影响
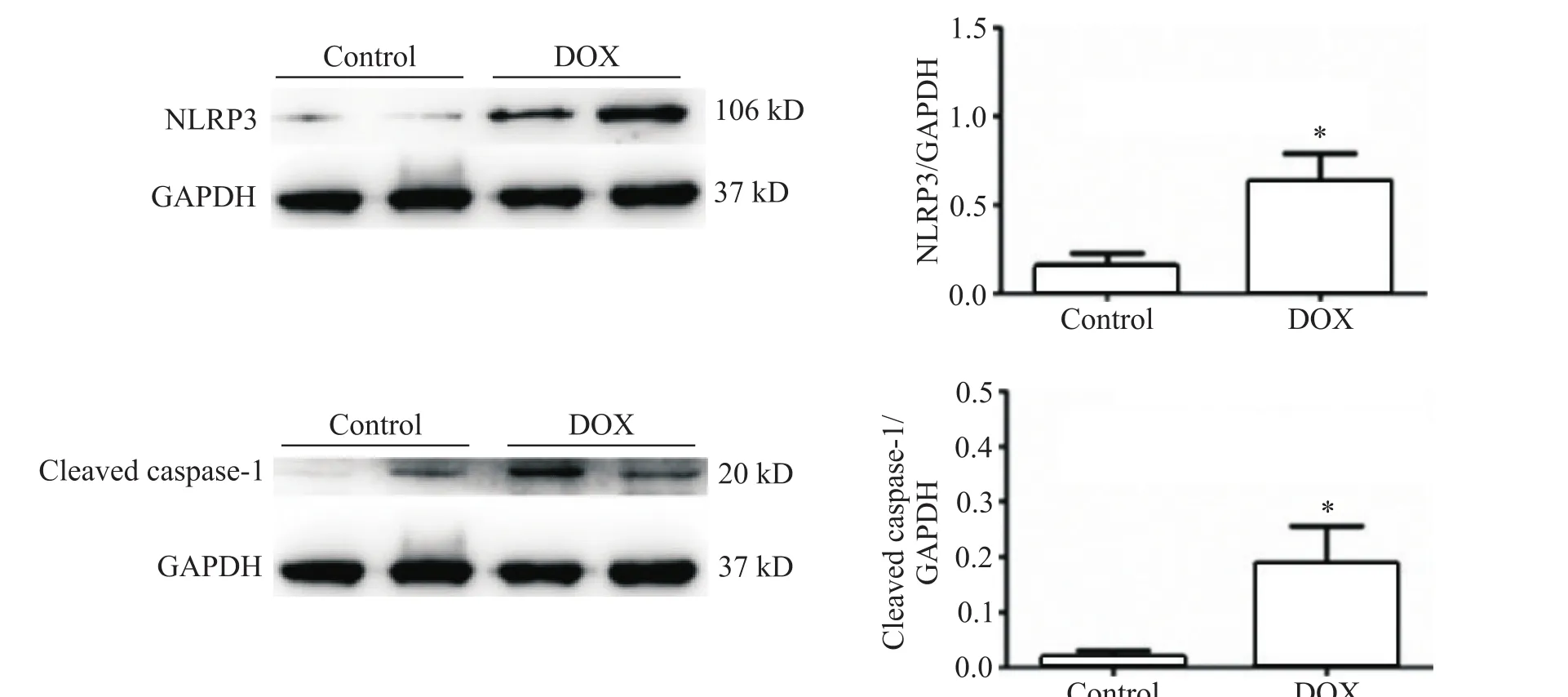
Figure 5.Effect of doxorubicin(DOX)on NLRP3 and cleaved caspase-1 exprossion in cardiac fibroblasts.Mean±SEM.n=3.*P<0.05,**P<0.01 vs control group.图5 DOX对心脏成纤维细胞NLRP3和cleaved caspase-1表达的影响
随着临床检测心功能手段不断完善,用来评估心功能的指标不断优化,越来越多的研究显示,在进行化疗治疗过程中或化疗结束时,有些患者虽没有明确的心功能障碍症状,但此时已经出现了舒张功能障碍。目前,DOX引起舒张功能障碍的机制尚不完全清楚,心肌炎症、纤维化以及间质增生等等改变,均可引起心室顺应性下降,进而造成舒张功能障碍。
本研究所用的心脏成纤维细胞为原代培养细胞。因此,我们通过免疫荧光检测成纤维细胞特异性标志物—波形蛋白,对所获得细胞进行鉴定,为保证细胞纯度能用于后续实验,随后,我们检测了不同浓度的DOX对心脏成纤维细胞活力的影响。实验结果显示:1、2和4µmol/L的DOX处理24 h和48 h后,心脏成纤维细胞活力显著降低。但2µmol/L和4µmol/L的DOX处理心脏成纤维细胞48 h后,细胞活力远远低于50%。为了确保后面实验细胞数量的稳定性,所以我们选用1µmol/L的DOX来进行后续实验。
我们进一步通过流式检测细胞凋亡情况。结果显示:DOX并没有明显增加心脏成纤维细胞的早期和晚期凋亡率。同时,利用ELISA测定心脏成纤维细胞上清中各种炎症因子的含量,结果表明:1µmol/LDOX能促进心脏成纤维细胞释放大量的IL-1β和IL-6,但对于心脏成纤维细胞分泌TNF-α并没有显著作用。炎症是纤维化的重要触发因素,本研究通过免疫荧光检测心脏成纤维细胞中α-SMA的表达情况,观察DOX促心脏成纤维细胞肌化的作用。结果显示:DOX处理24 h后,成纤维细胞表达α-SMA显著增多。此外,DOX处理24 h后,心脏成纤维细胞分泌Ⅰ型胶原蛋白显著增加。该部分结果提示:1µmol/LDOX并不能显著诱导心脏成纤维细胞凋亡,但会促进心脏成纤维细胞释放大量炎症因子,使得心脏成纤维细胞受损、肌化,并产生大量Ⅰ型胶原蛋白。
目前在DOX心脏毒性中并没有明确的细菌性炎症相关的报道。因此,我们推测DOX引起的主要为非细菌性炎症。越来越多证据表明NLRP3炎症小体与非细菌性炎症密切相关,正常静息状态下,NLRP3并不以NLRP3炎症小体形式存在,必须在NLRP3激活物刺激后,NLRP3发生寡聚化,并通过其PYD募集含有同型PYD的ASC,再通过含有CARD的ASC募集pro-caspase-1,形成NLRP3炎症小体促进pro-caspase-1进行自我剪切为活化的caspase-1 p10/p20四聚体,最后活化的caspase-1将pro IL-1β加工为成熟的IL-1β。但NLRP3炎症小体活化的机制,目前还不明确,有学者提出:NLRP3激活物产生的ROS主要来源于线粒体[18]。为了进一步探究DOX促心脏成纤维细胞释放炎症因子的机制,我们检测了心脏成纤维细胞在DOX作用下线粒体ROS表达情况、NLRP3以及活化的caspase-1蛋白水平。免疫荧光结果显示:DOX处理心脏成纤维细胞6 h后,线粒体就能释放ROS;同时DOX能显著增加心脏成纤维细胞中NLRP3和cleaved caspase-1的水平。越来越多的研究表明,IL-1β可能是诱导IL-6表达的主要激活因子之一[34-36]。有研究表明:sIL-6R与IL-6结合,可促进心脏成纤维细胞生成胶原,并诱导成纤维细胞向肌成纤维细胞表型转化。这很好地解释了DOX虽然没有改变经典调节I型胶原相关蛋白TGF-β水平,但依然促进了I型胶原蛋白的分泌。
综上所述,DOX可刺激心脏成纤维细胞线粒体释放大量的ROS,引起NLRP3炎症小体活化,进而刺激心脏成纤维细胞释放大量炎症因子,促进其肌化、分泌大量胶原,最终影响心脏顺应性。

