YAP通过增加HIF-1α转录活性进而促进小鼠下肢缺血后动脉生成*
李智昱, 李梦琦, 张成虎, 李博川, 何金龙, 梁德刚△, 艾 玎△
(1天津医科大学生理学与病理生理学系,天津医学表观遗传学协同创新中心,天津300070;2天津医科大学总医院心血管外科,天津300052)
下肢外周动脉疾病(peripheral arterial disease,PAD)在全世界影响超过两亿人,部分PAD患者存在严重肢体缺血,可导致行走能力的缺失和生活质量的降低,造成社会巨大经济负担。PAD治疗的基础是血管重建,以防止肢体坏死和功能障碍[1]。动脉生成是由血管内皮细胞等介导的侧支血管重建的过程[2],在缺血性疾病中的治疗作用不可或缺。
缺氧诱导因子1(hypoxia-inducible factor-1,HIF-1)是缺氧反应的主要转录介质,可以直接或间接调节血管内皮细胞中2%以上的基因,通过促进血管生成、动脉生成、血管重塑等过程来控制氧和营养物质的输送[3]。研究表明,HIF-1α活性的高低与小鼠下肢缺血后血流灌注情况相关[4-6],但其转录活性调控的具体分子机制目前尚不十分清楚。
Hippo-Yes相 关 蛋 白(Yes-associated protein,YAP)信号通路在进化过程中高度保守,经典Hippo通路通过一系列激酶反应最终导致下游效应分子YAP/具有PDZ结合基序的转录辅激活因子(transcriptional coactivator with PDZ-binding motif,TAZ)丝氨酸位点的磷酸化,进而促进YAP/TAZ降解或者在细胞浆中滞留,从而在控制器官大小、肿瘤生长等过程中发挥重要调控作用[7]。近年来研究发现Hippo-YAP信号通路在心血管疾病中同样至关重要[8],如YAP可以介导血流动力学导致的内皮激活,进而促进动脉粥样硬化发生发展[9],内皮细胞YAP也可以通过与信号转导和转录激活因子3(signal transducer and activator of transcription 3,STAT3)相结合,进而促进乳小鼠视网膜血管新生过程[10]。YAP为辅转录因子,通过与TEAD等转录因子结合发挥转录调控活性[7-8]。已知在肿瘤细胞中,YAP和HIF-1α可以相互结合[11],但YAP是否可以在内皮细胞中调控HIF-1α仍然未知。
在本研究中,我们构建内皮细胞特异性YAP过表达(EC-YAPtg)小鼠下肢缺血模型,试图探究YAP促进动脉生成的分子机制,旨在为PAD的治疗提供新的潜在靶点。
材料和方法
1 动物和细胞
CAG-loxP-STOP-loxP-YAP1转基因小鼠(YAPflox)以及内皮特异性Tie-2启动子表达CRE的小鼠购于南京大学-南京生物医药研究院。EC-YAPtg小鼠为以上两种小鼠杂交所得。实验使用6~8周龄雄性小鼠。人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)从天津医科大学总医院产科提供的脐带中分离获得;HEK293细胞购于ATCC(货号CRL-1573)。
2 主要试剂
抗HIF-1α抗体(货号79233)、抗总YAP(total YAP,t-YAP)抗体(货号4912)和抗Ser127位点磷酸化 YAP(phosphorylated YAP at Ser127,p-YAPS127)抗体(货号 4911)购于 Cell Signaling Technology;抗GAPDH 抗体(货号 60004-1-lg)购于 Proteintech;YAP-WT和YAP-5SA质粒由浙江大学赵斌教授赠送。
3 主要方法
3.1 Western blot实验 提取HUVECs蛋白,使用BCA试剂盒进行蛋白定量,进行SDS-PAGE(蛋白上样量为20µg),转移蛋白质到硝酸纤维素膜上。5%的脱脂奶粉封闭1 h,加入I抗并4℃孵育过夜,洗膜后II抗室温孵育1 h,化学发光法检测蛋白表达。使用ImageJ软件分析YAP总蛋白以及其磷酸化蛋白水平,以GAPDH为内参照,最后进行统计分析。
3.2 免疫细胞化学染色 用PBS清洗实验组和对照组细胞或组织,使用4%多聚甲醛固定0.5 h,0.5%Triton X-100室温处理0.5 h,并使用山羊血清工作液室温封闭1 h,加入I抗于4℃湿盒过夜;使用PBS清洗后再加入荧光II抗室温孵育1 h,PBS清洗后使用含有DAPI染料的封片剂封片;使用激光共聚焦显微镜拍照分析。
3.3 免疫共沉淀实验 提取HUVECs蛋白,使用BCA试剂盒进行蛋白定量;取500µg蛋白质样品,加入特异性抗体,4℃孵育过夜;第2天加入琼脂糖珠,4℃孵育过夜;最后加入SDS,100℃加热5 min,再进行Western blot实验。
3.4 萤光素酶报告基因实验 将HIF-1α萤光素酶报告基因载体(由上海吉凯基因公司构建)与LacZ、YAP-WT和YAP-5SA质粒共转染HEK293细胞24 h后,收获细胞;按萤光素酶活性检测试剂盒(Promega)说明书检测HEK293细胞萤光素酶活性;最后用ImageJ软件分析荧光强度,并进行统计分析。
3.5 激光多普勒血流仪检测小鼠下肢血流 分别于结扎股动脉手术后1、8、15和22 d使用激光多普勒血流仪检测小鼠下肢血流量情况。2组小鼠麻醉后仰卧,固定双下肢,将多普勒光纤探头固定至下肢,扫描并记录下肢血流灌注情况。
4 统计学处理
采用GraphPad Prism 7.0软件进行统计分析及作图。实验结果均以均数±标准误(mean±SEM)表示。两组间比较采用未配对双尾t检验,多组间比较采用双因素方差分析和Bonferroni校正后的t检验。以P<0.05作为差异有统计学显著性的标准。
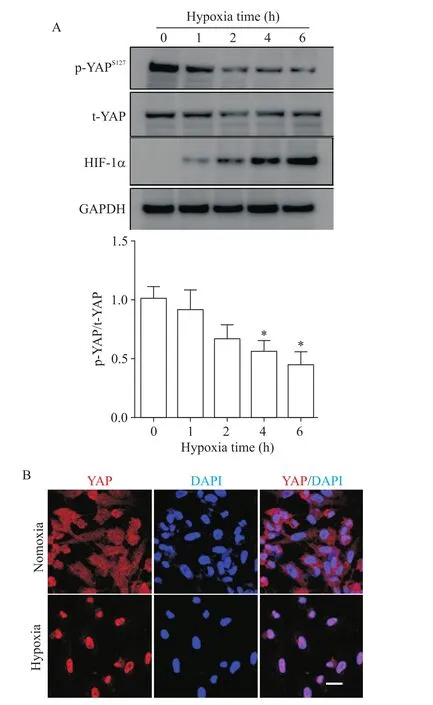
Figure 1.Hypoxia reduced YAP phosphorylation and promoted YAP nuclear translocation.A:Western blot analysis of expression of indicated proteins;B:HUVECs were exposed to nomoxia or hypoxia for 6 h,and immunofluorescence staining for YAP(red)and DAPI(blue)was performed.The scale bar=20 µm.Mean±SEM.n=3.*P<0.05 vs 0 h.图1 缺氧降低YAP蛋白磷酸化水平并增加其核转位
结 果
1 缺氧降低YAP磷酸化水平并增加其核转位
随着缺氧时间延长,HIF-1α的表达水平上调,同时YAP蛋白第127位丝氨酸磷酸化水平呈时间依赖性下降,4 h和6 h下降最为显著(P<0.05),而总YAP蛋白水平没有明显改变,见图1A。免疫荧光染色结果显示,缺氧处理6 h显著增加YAP蛋白在细胞核的定位,见图1B。
2 YAP和HIF-1α在内皮细胞中相互结合
既往研究显示,YAP蛋白在肝癌细胞中可以和HIF-1α蛋白相互结合并促进细胞的糖酵解过程[12],但内皮细胞中两者是否存在结合尚不清楚。免疫共沉淀实验结果显示,在缺氧状态下,内皮细胞YAP蛋白和HIF-1α蛋白存在相互结合,见图2。
3 YAP上调HIF-1α的转录活性
在HEK293细胞中,将HIF-1α萤光素酶报告基因质粒分别与LacZ、YAP-WT和YAP-5SA质粒共转染24 h后,检测萤光素酶的活性,结果显示,与对照质粒相比,YAP-WT质粒能有效增加HIF-1α的转录活性(P<0.05),YAP-5SA质粒比YAP-WT质粒能进一步增加HIF-1α的转录活性(P<0.05),见图3。这表明YAP蛋白可以上调HIF-1α的转录活性。
4 YAP过表达可以促进缺氧组织的血流恢复
EC-YAPtg小鼠的构建过程如图4A所示。对ECYAPTg小鼠和对照小鼠(YAPflox)行股动脉结扎手术,分别于术后1、8、15和22 d使用激光多普勒血流仪检测小鼠下肢血流恢复情况。与YAPflox小鼠相比,EC-YAPtg小鼠下肢的血流灌注显著增加(P<0.05),见图4B。这提示YAP蛋白过表达可以促进小鼠缺氧组织的血流恢复。
5 YAP能够促进动脉生成
进一步提取EC-YAPtg小鼠和YAPflox小鼠腓肠肌并且进行免疫细胞化学染色检测CD31、α-SMA及Mac3表达水平。相比于YAPflox小鼠,EC-YAPtg小鼠肌肉中CD31和α-SMA表达明显增高(P<0.05),而Mac3表达没有明显变化(P>0.05),见图5。这表明YAP过表达促进了缺血组织中动脉生成。
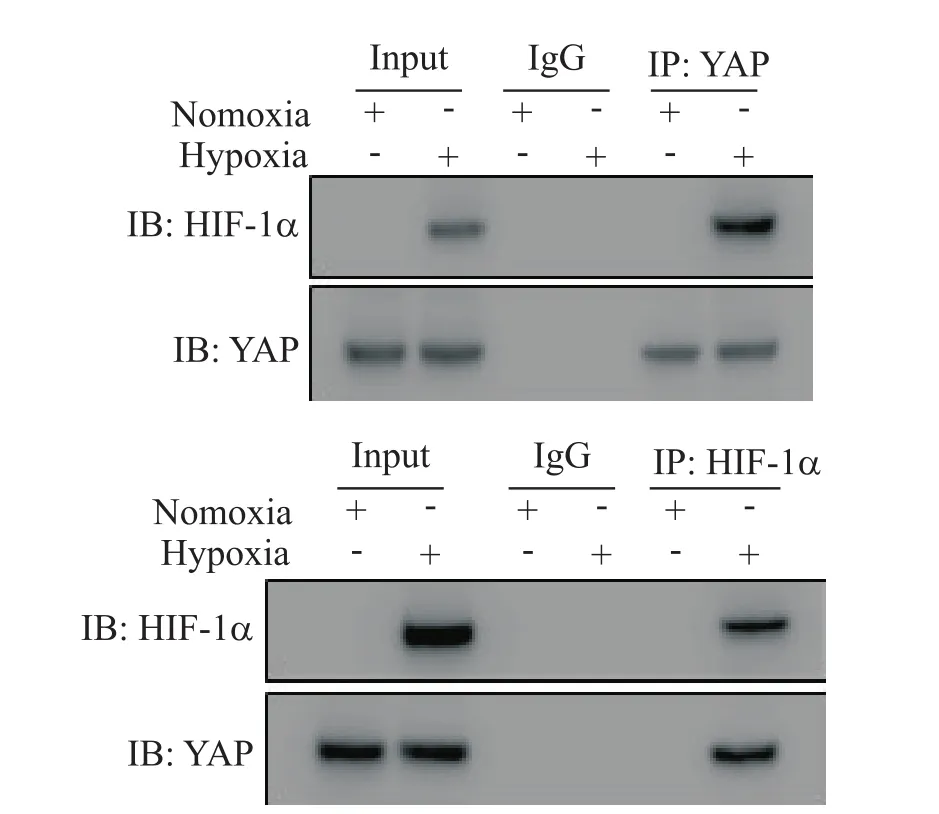
Figure 2.Identification of HIF-1α as YAP-binding partner.Coimmunoprecipitation(IP)assay was performed using extracts of HUVECs and anti-YAP/HIF-1α antibody.Rabbit normal IgG was used as control.Immunoblotting was performed with the indicated anti-HIF-1α or anti-YAP antibody.图2 YAP蛋白和HIF-1α蛋白相互结合
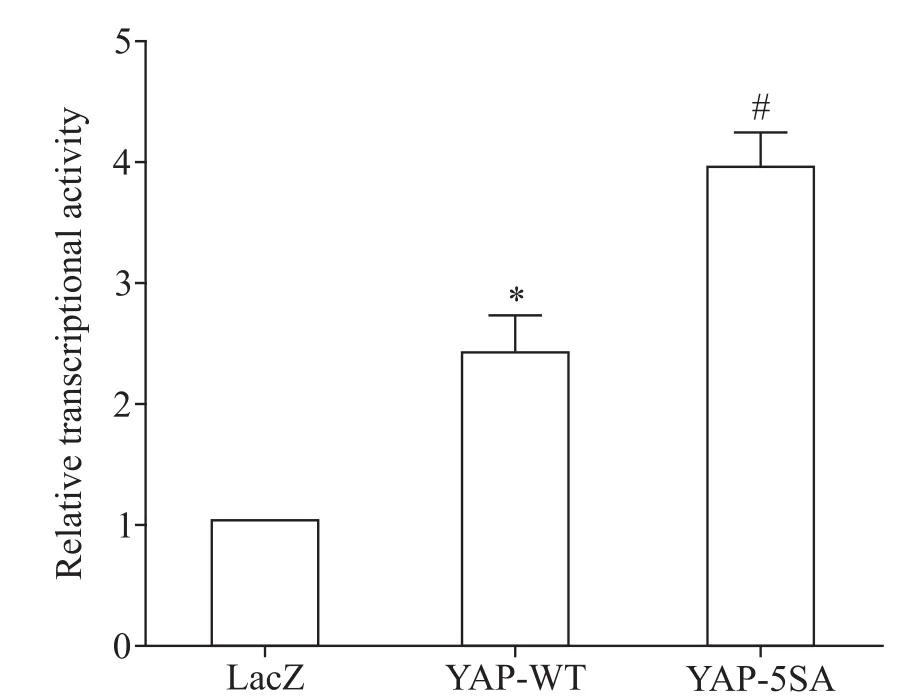
Figure 3.YAP up-regulated the transcriptional activity of HIF-1α.HIF-1α promoter luciferase reporter plasmid was cotransfected into HEK293 cells with LacZ,YAP-WT or YAP-5SA plasmids for 24 h.The promoter activity was measured by luciferase reporter assay,which was normalized to β-galactosidase.Mean±SEM.n=5.*P<0.05 vs LacZ group;#P<0.05 vs YAP-WT group.图3 YAP增加HIF-1α的转录活性
讨 论
以上实验结果证实,缺氧通过调控YAP第127位丝氨酸磷酸化而促进YAP入核与HIF-1α相互结合,并可能通过上调HIF-1α的转录活性,进而调控缺血后动脉生成过程。
HIF-1α在调节缺氧/缺血相关的疾病中被证实可以通过转录活性调控血管活性、血管新生、动脉生成,以及骨髓来源细胞的迁移和归巢等过程,进而在疾病发生发展过程中发挥重要的调控作用[6]。研究证实HIF-1α可以作为细胞内的氧气感受器存在:氧气浓度增加时,HIF-1α被羟基化并与希佩尔-林道肿瘤抑制因子(von Hippel-Lindau tumor suppressor,VHL)相互作用,最终导致HIF-1α的泛素化修饰以及降解;缺氧时HIF-1α的羟基化修饰过程被抑制,进而泛素化修饰以及降解过程被抑制[13]。已有报道证实HIF-1α在缺血相关的动脉生成过程中发挥重要作用。HIF-1α+/-小鼠相比于对照鼠,其下肢缺血后血流恢复速度更慢,同时也发现HIF-1α作为转录因子,可以调控众多与血管新生以及动脉生成相关的基因,包括血管生成素1(angiopoietin 1,ANGPT1)、ANGPT2、干细胞生长因子(stem cell growth factor,SCF)、基质细胞衍生因子1(stromal cell-derived factor-1,SDF1)、血管内皮生长因子(vascular endothelial growth factor,VEGF)等[4]。因此,鉴于HIF-1α在血管新生以及动脉生成中的重要作用,使用药物干预或者基因治疗来提高HIF-1α的活性,可以成为治疗缺血性疾病的新策略[3]。研究证实,通过局部注射CoCl2或者二甲基乙二酰基甘氨酸(dimethyloxalylglycine,DMOG)可以提高HIF-1α的表达进而改善损伤后的修复过程[5,14]。同时,腺病毒过表达持续激活形式的HIF-1α也可以促进2型糖尿病小鼠下肢缺血后血流恢复[15]。我们的研究证实了YAP可以与HIF-1α相互结合并且促进其转录活性,YAP可以作为内源性HIF-1α转录活性的激活蛋白存在。此外,通过构建EC-YAPtg小鼠我们也发现,内皮细胞YAP过表达可以改善小鼠下肢缺血后血流灌注情况,促进动脉生成。
血管生成,即从已有血管网中形成新的血管,常见于发育过程中[16];动脉生成,是指现有的侧支血管的扩张,内皮细胞增殖后,平滑肌细胞有丝分裂,弹性层内破裂,血管平滑肌细胞迁移形成新内膜,一般见于出生后动脉网的延伸或缺血损伤后天然微血管侧支小动脉转变为功能动脉等过程[17]。动脉生成与血管生成在触发因素、参与细胞及分子调控等方面存在不同[17-19]。我们之前的研究以及他人的研究均发现YAP在VEGF信号通路调控过程中具有重要作用[10,20],同时也证实了 YAP在血管内皮细胞中通过增加STAT3在细胞核的滞留时间进而增加ANGPT2的转录调控,从而促进乳小鼠视网膜血管新生过程[10],但YAP是否在动脉生成过程中也发挥着重要调控作用尚不清楚。本研究中,我们采用经典的动脉生成模型[21],而且小鼠腓肠肌冰冻切片免疫荧光染色的结果表明,相比于YAPflox小鼠,EC-YAPtg小鼠腓肠肌中成熟内皮细胞标志物CD31和血管平滑肌细胞标志物α-SMA[22]的表达水平明显升高,巨噬细胞标志物Mac3无明显变化。这一结果提示内皮细胞YAP可以促进动脉生成过程,促进小鼠缺血后下肢血流的恢复。

Figure 4.Over-expression of YAP promoted blood flow recovery in mice after hind-limb ischemia.A:loxP-flanked STOP cassette was used to control YAP expression in tissue by mating mice with an endothelial-specific Cre mouse line;B:hind-limb ischemia was surgically induced in EC-YAPtgmice and their wild-type littermates(YAPflox),and blood flow was evaluated by laser Doppler imaging on days 1,8,15 and 22.Mean±SEM.n=10.*P<0.05 vs YAPfloxgroup on day 22.图4 YAP过表达可以促进下肢缺血后血流恢复
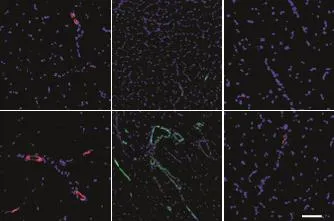
Figure 5.YAP overexpression promoted arteriogenesis.Gastrocnemius was extracted from YAPfloxand EC-YAPtgmice after ligation of femoral artery.Immunofluorescence staining for CD31(red),α-SMA(green),Mac3(red)and DAPI(blue)was performed.The scale bar=100µm.Mean±SEM.n=10.*P<0.05 vs YAPfloxgroup.图5 YAP过表达促进下肢缺血后血管生成
综上所述,缺氧刺激可调节YAP磷酸化水平进而促进YAP核转位;YAP可以与HIF-1α结合并促进其转录活性;特异性内皮细胞过表达YAP可以促进小鼠下肢缺血后动脉生成过程。本研究为缺血后动脉生成过程的分子机制研究提供了新思路;同时提示缺氧诱导的YAP入核参与了下肢缺血后动脉生成过程,并可能成为新的治疗靶点。

