泊沙康唑与伏立康唑预防成人恶性血液病患者侵袭性真菌感染的效果分析
王菀菀,刘桂玲
侵袭性真菌感染(invasive fungal infection,IFI)是指真菌入侵内脏、深部组织等部位造成的感染。近年来,IFI的发病率呈上升趋势,因恶性血液病及肿瘤化疗等造成免疫力低下的患者是IFI的高危人群,其发生部位以肺部最常见,病菌以曲霉菌为主,IFI的早期诊断困难,且死亡率高[1-2]。因此,对于高危人群早期预防尤其重要。泊沙康唑与伏立康唑同属二代唑类药物,均可以防止侵袭性真菌病的发展,对部分耐药及新出现病原体仍有抗菌活性。目前对于急性髓系白血病(AML)和骨髓异常增生综合征(MDS)化疗后导致粒细胞缺乏患者的预防性治疗药物,指南首选推荐泊沙康唑[3]。但目前泊沙康唑的预防性应用在国内尚未被推广,相关临床研究缺乏。另外,对于伏立康唑初级预防的相关报道也比较少。本文探究并分析比较泊沙康唑与伏立康唑在恶性血液病患者预防性抗真菌治疗方面的效果及不良反应,以期获得安全有效的预防性抗真菌药物,提高恶性血液病患者的生存率。
1 资料和方法
1.1 一般资料 选择2018年9月—2020年3月在本院血液科接受治疗恶性血液病合并粒细胞缺乏患者46例。入选标准:(1)年龄≥18岁;(2)接受化疗或小剂量化疗联合去甲基化治疗;(3)中性粒细胞绝对计数<0.5×109/L。排除标准:(1)对所选药物过敏;(2)严重肝、肾功能损害;(3)患者已经接受其他抗真菌药物的预防治疗;(4)明确已经发生真菌感染;(5)心电图有明显的心律失常及QT间期延长。根据我国血液病/恶性肿瘤患者侵袭性真菌病的诊断标准和治疗原则[4],将研究对象分为确诊、临床诊断、拟诊和未确定病例。抗真菌治疗策略分为:预防治疗、经验治疗、诊断驱动治疗和目标治疗。
1.2 方法 泊沙康唑组:口服泊沙康唑混悬液(默沙东)200 mg,3次/天。伏立康唑组:伏立康唑片(辉瑞),口服,d1,400 mg 2次,随后200 mg,2次/天;2组治疗持续至粒细胞缺乏恢复,或临床考虑出现IFI,根据诊断标准和治疗原则,更改其他抗真菌治疗方案,更换的药物包括静脉应用伏立康唑、两性霉素B、米卡芬净或联合用药。观察期间视患者情况入住层流病房,可给予粒细胞集落刺激因子(G-CSF)、促血小板生长因子(TPO)或IL-11、预防性抗细菌等药物。
1.3 观察指标 观察记录患者症状及体征变化;至少每周3次监测患者血、尿常规,肝、肾功能及电解质等;监测患者粒缺持续时间,观察患者有无发热、咳嗽。必要时完善血液、痰液、咽拭和尿液的细菌和真菌培养,G试验、GM试验、胸部CT等影像学检查以及支气管肺泡灌洗检查。观察并记录期间不良事件的发生情况。进行疗效及安全性评估。预防成功的定义为:应用预防药物结束后1周内未发生IFI、未行抢先静脉抗真菌治疗。统计2组患者发热率、IFI的发生率及转归。
2 结果
2.1 2组患者临床资料比较 2组患者年龄、性别、血液病类型、疾病的缓解状态、粒细胞缺乏持续时间、是否入住层流病房以及是否行预防性抗细菌治疗比较,差异无统计学意义(P>0.05)。具有可比性。见表1。
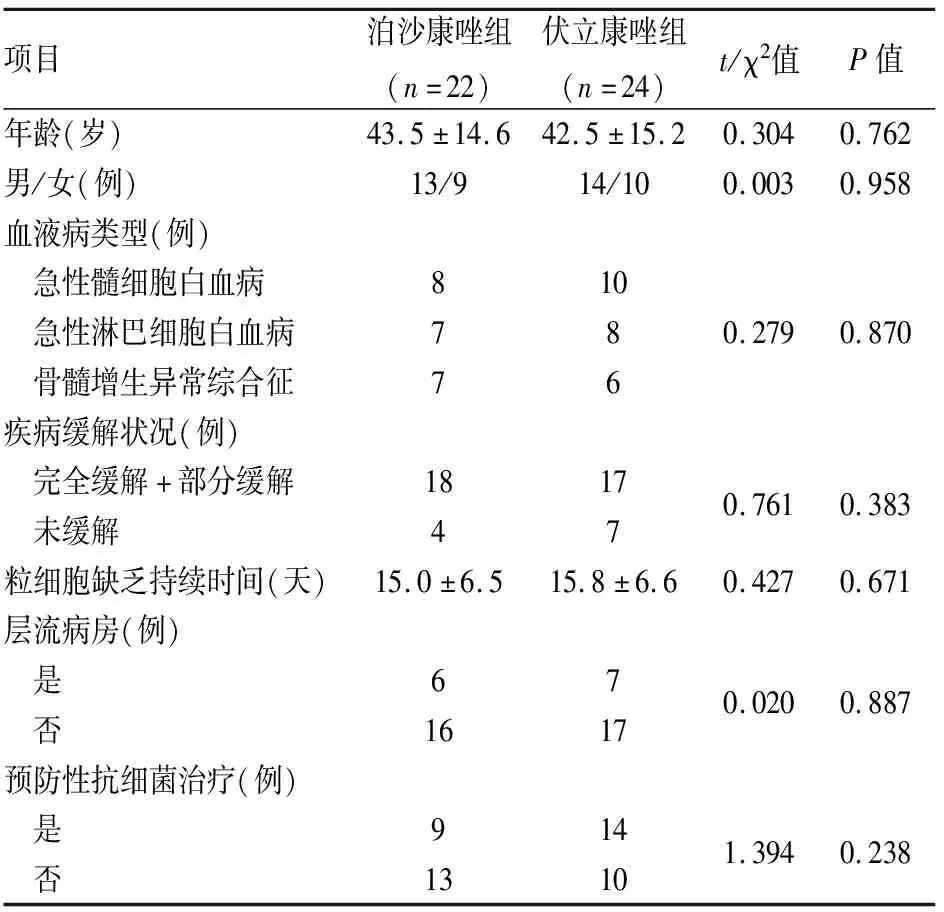
表1 2组患者临床资料比较
2.2 2组患者IFI发生及死亡情况比较 2组患者发热例数比较差异无统计学意义(P>0.05)。泊沙康唑组出现确诊/临床诊断、拟诊和未确定IFI以及行经验治疗和诊断驱动治疗的患者均低于伏立康唑组,但差异无统计学意义(P>0.05)。泊沙康唑组行一线抗真菌治疗的少于伏立康唑组,预防成功率高于伏立康唑组,但2组比较差异均无统计学意义(P>0.05)。泊沙康唑组未出现真菌相关的死亡病例,伏立康唑组出现1例真菌相关死亡病例。
泊沙康唑组1例临床诊断为IFI感染患者,经过米卡芬净治疗3周后,症状明显好转,且肺部影像学提示病灶明显改善。伏立康唑组1例临床诊断肺部严重侵袭性曲霉菌病的患者,给予米卡芬净与两性霉素B联合抗真菌治疗,最终治疗无效死亡。其余抗真菌治疗病例均治愈或病情稳定。见表2。

表2 2组患者IFI发生及死亡情况比较[例(%)]
2.3 2组患者不良反应比较 泊沙康唑组出现肝功能异常4例,明显低于伏立康唑组,且均为轻度肝功能损害,经过保肝治疗,均恢复正常;而伏立康唑组肝功能损害2例达到中度,经过保肝治疗,最终恢复正常。泊沙康唑组出现1例窦性心动过缓,经药物应用后好转。其他的不良反应均轻微,经过对症治疗后好转。2组患者不良反应比较,差异均无统计学意义(P>0.05)。见表3。

表3 2组患者不良反应比较[例(%)]
3 讨论
恶性血液病尤其是急性髓细胞白血病(AML)、急性淋巴细胞白血病(ALL)及骨髓增生异常综合征(MDS),具有许多IFI的高危因素,尤其是在化疗期间出现的粒细胞缺乏是IFI感染的高危因素。侵袭性曲霉菌是血液病患者发病率和死亡率较高的原因之一[5],而泊沙康唑与伏立康唑多用于曲霉菌的感染,伏立康唑被推荐为曲霉菌感染的首选药。曲霉菌感染通常为肺部,其他罕见部位的感染,如脑曲霉菌的感染[6]、侵袭性心包内曲霉病[7],使用泊沙康唑也有良好的效果且无严重不良反应。
泊沙康唑与伏立康唑均属于第二代三唑类抗真菌药,均可以抑制真菌细胞膜上合成麦角固醇的关键酶羊毛甾醇14α-去甲基化酶(CYP51),从而干扰真菌细胞生长,发挥抗真菌作用。其对人类细胞的P450酶影响较小,药物活性更高、更安全。最常见的剂型是口服混悬剂,服用简单方便,患者的依从性较好。泊沙康唑抗菌谱较广,覆盖了念珠菌、曲霉、大多数接合菌、球孢子菌等,是目前唯一对毛霉菌属等接合菌有效的三唑类药物,对罕见孢子菌,甚至结合菌属也有较强的抗菌活性,对常见念珠菌属的抗菌活性强于伏立康唑,且不易受耐药菌株基因突变的影响,对隐球菌属的抗菌活性与伏立康唑基本相当[8]。伏立康唑为氟康唑的衍生物,抗菌谱广,对念珠菌属、曲霉菌属、隐球菌属、足放线菌属、镰刀菌属及氟康唑耐药的念珠菌均有效。具有静脉及口服剂型,理论上也可以作为高危人群初级预防性药物[9]。泊沙康唑作为伊曲康唑的衍生物,研究显示泊沙康唑在AML/MDS患者诱导治疗初级预防IFI治疗过程中,疗效显著优于氟康唑、伊曲康唑,突破性真菌感染的发生率仅为2%[10]。在一项270例患者接受泊沙康唑预防真菌感染的研究[11]中,证实或者可能发生IFI突破的占3.3%,在AML中性粒细胞减少的患者中发生率是4.2%。泊沙康唑预防发生IFI突破的危险因素可能影响其预防的疗效,比如高龄、对诱导化疗无反应,遗传变异等[12]。此外,有研究[13-14]表明,在接受诱导化疗治疗的AML/MDS的重症患者中,泊沙康唑是首个表现出能够明显提高群体生存率的药物。国外学者[15]利用真菌致敏性重症哮喘(SAFS)和变应性支气管肺曲菌病(ABPA)来评估伏立康唑或泊沙康唑作为二线或三线用药的疗效,发现2种药物均可以作为潜在的有效的SAFS和ABPA的治疗方案。泊沙康唑治疗难治性肺部侵袭性曲霉菌病及ABPA有良好的效果,可降低肺部感染加重及哮喘急性加重的频率,并且对罕见的侵袭性肺部真菌感染(IPFI)也有疗效,可以作为IPFI的挽救用药。
本资料结果显示伏立康唑与泊沙康唑在恶性血液病初级预防IFI的疗效及不良反应均相当,与国内外研究结果均一致[9,16]。与伏立康唑不同的是,由于泊沙康唑的代谢(主要是葡萄糖醛酸)和肾清除只起次要作用,所以在肾或肝脏功能不全的情况下不需要调整其用药剂量。临床试验[1,9,17-18]结果均提示,泊沙康唑与伏立康唑的耐受性良好,大多数不良反应与其他三唑类类似,主要表现为胃肠道功能紊乱,与治疗时间及剂量无关;同时肝脏损伤、神经毒性及心脏毒性轻微或持续时间相对短暂。本资料结果显示,2组的主要反应为肝功能异常、消化道症状,皮疹等,均可耐受并可控。本资料结果显示,泊沙康唑和伏立康唑作为恶性血液系统疾病患者粒细胞缺乏期IFI的预防用药均安全且有效,能有效预防并减少IFI的发生,降低一线抗真菌治疗比例,两种药物的不良反应均可耐受并可控。但本资料存在样本量不足、预防治疗的时机存在差异,另外,也可能存在病例选择偏倚等局限性,因此,尚需大规模多中心随机对照研究进一步验证。

