丁苯酞注射液对脑缺血再灌注线粒体损伤过程的保护机制研究
颜秀丽, 裴兵兵
脑血管疾病是一种严重危害人类身体健康的疾病,一直以来以高死亡率、致残率和难以预见等特点受到国内外医学界的广泛关注。而卒中也成为全球范围内死亡的第二大原因[1~3]。其中缺血性卒中只有r-tPA及机械血栓切除术在临床上真正被证明有效并得到了广泛共识,但无论是r-tPA还是机械血栓清除术有效率都较低,且伴随的风险很大。一些临床资料表明患者通过化学或机械方法,虽然恢复了脑血流供应但并没有使病情得到预期的恢复或者提高[4]。这种治疗失败,甚至导致病情恶化的情况在临床上并不少见,现阶段认为缺血再灌注损伤是导致此种情况的主要的病理生理过程。线粒体是细胞能量代谢的主要场所,因此对线粒体代谢的研究可能为我们提供治疗的新靶点。本课题组在前期工作中通过线粒体PCR Array方法,分析了缺血再灌注损伤对线粒体能量代谢相关基因的影响,并深入研究丁苯酞注射液对于线粒体代谢相关基因的调节作用,根据前期的实验结果,选择了细胞色素C氧化酶A2(cytochrome c oxidaseⅥ A2,COX6A2),烟酰胺核苷酸转移酶(nicotinamide nucleotide transhydrogenase,NNT ),解偶联蛋白3 ( uncoupling protein3,UCP3)三种线粒体蛋白作为研究靶点,以进一步明确丁苯酞注射液(Butylphthalide,NBP)在缺血再灌注损伤过程中是否通过调节上述三种蛋白进而对线粒体起到保护作用。
1 材料与方法
1.1 材料
1.1.1 实验动物 选择健康成年雄性Sprague-Dawley大鼠,由辽宁长生生物技术有限公司提供。
1.1.2 试剂 A4级大鼠线栓购自北京西浓科技有限公司;水合氯醛购自北京化工厂;2,3,5氯化三苯基四氮唑(triphenyltetrazolium chloride,TTC) 购自鼎国昌盛生物技术有限公司;VDAC1一抗购自美国Abcam公司;COX6A2、NNT、UCP3一抗购自美国Abcam公司;线粒体分离试剂盒购自北京索莱宝生物科技有限公司;预染蛋白分子Marker购自北京博奥森生物科技有限公司;实验用丁苯酞原液购自石药集团。
1.1.3 仪器 手术器械(包括止血钳、眼科镊、眼科剪、显微外科镊、可吸收缝合线、持针器等);大鼠用脑切片槽购自美国Alto公司;蛋白电泳购自美国Bio-Rad公司;Western-blot跑胶装置、电源购自北京百晶科技公司。
1.2 方法
1.2.1 动物筛选及分组 大鼠体重在250~280 g之间,随机分笼,遵照大鼠标准饲养方式喂养,垫料及鼠粮由吉林大学动物中心提供,大鼠采取自由进食及饮水。随机分为3组(每组6只):(1)Sham组:大鼠仅暴露左侧颈总动脉后,正常缝合表皮。(2)模型组(MCAO组):运用改良经典线栓法,制备大鼠MCAO模型,缺血1.5 h后拔出线栓,再灌注24 h后处死。(3)NBP组(NBP+MCAO组):运用改良经典线栓法,制备大鼠MCAO模型,于缺血1 h给予80 mg/kg NBP腹腔注射,缺血1.5 h后拔出线栓,再灌注24 h后处死。
1.2.2 大鼠模型制备 采用改良的经典线栓法,10%的水合氯醛腹腔注射进行麻醉,固定大鼠,沿气管方向纵向切开,暴露左颈总动脉游离颈内及颈外动脉,动脉夹暂时夹闭颈总动脉及颈内动脉,于颈外动脉将栓塞线插入颈内动脉,直至栓塞线至大脑中动脉中深度(约1.8±0.3 cm),打开置于颈内动脉上的活结及颈总动脉上的动脉夹,缝合切口。缺血1.5 h后,取出栓塞线并在切口下方打结。逐层缝合伤口,放于室温环境中观察,待大鼠完全苏醒后送回饲养室,再灌注24 h。
1.2.3 神经功能评分 待大鼠完全清醒后,运用改良Garcia评分法[5]评价大鼠神经功能。
1.2.4 Western blot检测蛋白水平表达
1.2.4.1 脑组织样本制备 快速断头取脑后,在冰盒上剥离大鼠梗死侧大脑皮质,装入事先编号的EP管内,放入液氮中速冻后,置于-80 ℃冰箱保存。
1.2.4.2 线粒体蛋白的提取 称取150 mg新鲜大鼠脑组织,洗净血水后,用滤吸干后将脑组织剪碎后放入玻璃匀浆器内冰上研磨组织20次左右。离心,上清液取出,再次离心10 min。取上清,4 ℃,12000 r/min,离心15 min。离心后的EP管内液体,上清含胞浆成分,可从中提取胞浆蛋白,沉淀物为线粒体。取沉淀再次洗涤离心,弃掉上清,提纯线粒体。重悬线粒体沉淀,放入-80 ℃冰箱保存。
1.2.5 染色 术后24 h用10%水合氯醛腹腔注射麻醉大鼠,于冰板上快速断头取脑。将脑组织置于-20 ℃冰箱中15 min,取出后脑组织置于脑切片槽内,以2 mm为间隔做冠状切片,共切5片。切好后置于1%TTC磷酸缓冲液(0.1 mol/L,pH 7.4)中,放入37 ℃避光孵箱中静置15 min后取出翻面,再等待15 min。染色完成后分别对两面进行图片采集,图片采用Image J图像分析系统计算梗死体积。梗死体积百分比(%)=梗死区脑的体积/大脑的体积×100%。
1.2.6 蛋白免疫印记(Western blot)法检测COX6A2、NNT、UCP3蛋白的表达 用蛋白裂解液将脑组织制备成匀浆液,在4 ℃ 低温12000 r/min 离心30 min,取上清液备用。BCA法定量总蛋白质浓度,将各组蛋白浓度调到同一水平。制备10%聚丙烯酰胺凝胶,加蛋白样品,电泳后通过湿转将蛋白转到PVDF 膜。5%脱脂奶粉TBST 缓冲液洗膜15 min,一抗4 ℃下孵育过夜后TBST 洗膜3次,加入二抗后孵1.5 h,TBST洗3次后加入显色剂ECL 1 min 后,暗室显影2 min洗胶片,扫描各免疫印记条带并进行分析。
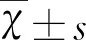
2 结 果
2.1 大鼠神经功能评分及梗死体积 通过综合改良Garcia评分法可以看出,Sham组大鼠神经功能基本正常,与MCAO组(5.60±0.51)相比,NBP组(10.60±0.81),大鼠的神经功能都得到了一定的改善(P<0.05)。
如图1所示,通过Image J软件分析可以看出MCAO组梗死体积百分比为(27.92±1.31),NBP组为(21.72±1.10),梗死体积明显减小(P<0.05)。
2.2 Western blot检测NBP对脑缺血再灌注损伤后COX6A2、NNT、UCP3蛋白表达水平的影响 如图2所示,与Sham组相比,MCAO组的COX6A2表达明显增高(P<0.05),而应用NBP后,这种增高得到了明显的抑制(P<0.05);与Sham组相比,MCAO组的NNT蛋白在线粒体内表达明显下降(P<0.05),而应用NBP后,这种下降得到了明显的抑制(P<0.05);与Sham组相比,MCAO组的UCP3蛋白表达明显增高(P<0.05),而应用NBP后,这种增高得到了明显的抑制(P<0.05)。
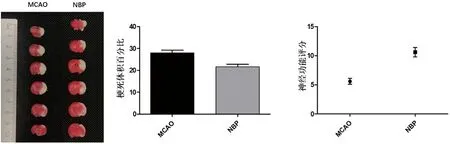
图1 TTC染色、梗死体积百分比及神经功能评分
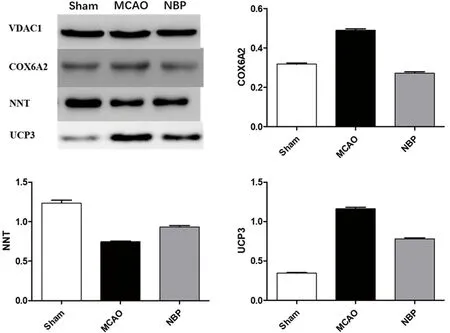
图2 Western blot检测大鼠皮质缺血区线粒体COX6A2、NNT、UCP3蛋白表达情况
3 讨 论
脑缺血再灌注损伤的机制复杂,涉及氧化应激、炎症反应、细胞内钙超载、内质网应激和神经细胞凋亡、自噬等。本研究中采用组织染色,神经功能评价及检测蛋白表达水平,证明了NBP可以减少脑缺血再灌注损伤,这种保护作用机制之一是通过调节线粒体代谢途径实现的。本实验中COX6A2、NNT、UCP3三种蛋白皆是线粒体表达蛋白,且在缺血再灌注损伤中对线粒体代谢起到调节作用。
细胞色素C氧化酶(cytochrome C oxidase,CcO)是线粒体电子传递链的末端酶复合物,哺乳动物中CcO是一种异质寡聚蛋白复合物,由13个亚基组成,线粒体基因和核基因共同编码。COX6A是细胞色素C氧化酶的核编码亚基之一,该亚基由不同基因编码分为两种亚型,其中COX6A1(COX6AL)表达在非肌肉组织内,COX6A2(COX6AH)仅表达于横纹肌中[6],在一定条件下,细胞可通过过度表达COX6A2以补充COX6A1的缺乏[7]。COX6A参与CcO最后阶段的组装,有研究表明,COX6A参与维持CcO二聚体状态的稳定,并构成了细胞色素C的作用位点[8,9],在功能复合物 IV 的表达和酶活性中起着重要的作用[7]。COX6A2可以通过结合ADP进而导致CcO催化活性的增加,且这种增强可以通过单克隆抗体的竞争而消除[10],并在线粒体活性氧代谢的过程中发挥作用[11]。同样,本研究中COX6A2蛋白在缺血再灌注损伤中表达明显增高,线粒体内ATP/ADP比率增高,降低质子泵容量,下调线粒体膜电位,使线粒体通透性增大,过量的细胞色素C释放入胞浆,进而细胞发生凋亡。NBP通过抑制COX6A2蛋白的表达,从而减少神经细胞在缺血再灌注损伤中的凋亡。
NNT是一种由核基因编码的蛋白,主要位于线粒体内膜中[12]。NNT通过结构变化参与线粒体及胞浆的质子转移过程[13],维持线粒体膜电位、活性氧的动态平衡及能量产生,是保护线粒体功能和细胞生存的重要酶。有研究表明,病理生理条件下,质子与NNT结合,可以催化还原型辅酶Ⅰ(nicotinamide adenine dinucleotide,NADH)及烟酰胺腺嘌呤二核苷磷酸(oxidized form of nicotinamide adenine dinucleotide phosphate,NADP)等[14],且二者是代谢的重要辅酶,在生物合成和氧化还原稳态过程中起着电子载体的作用,是细胞内抗氧化防御系统的重要组成之一,在防御活性氧损伤方面起着非常重要的作用。有研究结果表明,在慢性心肌缺血模型中,NNT表达含量降低,这与我们现有结果一致[15]。我们认为在氧化应激损伤中,线粒体能量代谢蛋白含量下降,细胞内抗氧化能力降低,细胞损伤加重。这提示我们NNT是一个潜在的治疗靶点,可以改善神经元氧化应激条件下的氧化还原平衡。NBP可以通过增加NNT蛋白的表达进而保证线粒体质子泵活性,稳定线粒体结构和功能,降低氧化应激对神经细胞的损伤。
UCP3是线粒体载体蛋白家族的重要成员之一,主要分布在骨骼肌线粒体膜,可引起线粒体膜质子漏增加,降低质子梯度,ATP 合成效率下降,呼吸链氧化和磷酸化解偶联,并以热能的形式释放能量。在本课题组前期对线粒体代谢蛋白的研究中表明,该蛋白亦存在于脑组织中,且在缺血再灌注损伤中占据着重要的地位。有研究表明UCP3参与解偶联过程[16],调节线粒体活性氧的生成[17],调节能量及脂质代谢[18],影响线粒体钙离子转运[19]。上述过程是脑缺血再灌注损伤的重要病理生理过程,因此UCP3蛋白参与脑缺血再灌注损伤的调节,为治疗提供新的靶点。
综上,脑缺血再灌注损伤过程中线粒体地位至关重要,而线粒体代谢相关蛋白结构及功能繁杂交错,本实验以前期工作中筛查的变化显著的基因表达蛋白为研究对象,从蛋白水平证明了其与脑缺血再灌注损伤的重要关系,为下一步深入机制研究提供了很好的开端,同时,探究了NBP的线粒体保护相关途径,扩展了其保护机制的相关研究。

