莲藕多酚氧化酶互作蛋白的筛选及验证
原新博,程婷婷,惠小涵,陈章玉,王瑞红,柯卫东,郭宏波
(1西北农林科技大学化学与药学院/中药指纹图谱国家地方联合工程研究中心/陕西省中药指纹图谱与天然产物库研究中心,陕西杨凌 712100;2西北农林科技大学生命科学学院,陕西杨凌 712100;3武汉市农业科学院蔬菜研究所,武汉430065)
0 引言
【研究意义】莲藕(Nelumbo nuciferaGaertn.)是我国最大的水生蔬菜种类[1],药食两用,其整个植株10个部位中有6个部位入药,具有降脂减肥、抗氧化、抗衰老、安神助眠等药理学功效。莲藕具有很高的营养价值和药用功效[2],但采后褐变严重影响了其商品性及加工产业的发展。为解决莲藕采后贮藏和加工过程中由多酚氧化酶(PPO)引起的褐变问题,研究筛选、验证PPO与何蛋白互作,逐步摸清其在莲藕中的作用机制,对于采后控制莲藕褐变,延长其产业链具有重要意义。【前人研究进展】PPO是由核基因编码的一种含铜金属酶[3],可将其分为单酚氧化酶(酪氨酸氧化酶)、双酚氧化酶(儿茶酚氧化酶)和漆酶 3类[4],在动植物、真菌和昆虫的质体中广泛存在[5-6]。PPO通常由3部分组成:一个N端导肽区,一个高度保守的CuA和CuB区以及一个C端疏水区域[7];PPO的主要功能区是Cu结合区,其他部分对酶空间构象、高级结构形成和维持起作用[8]。研究发现PPO在植物中有多种重要功能,如抗病虫害、抗机械损伤、参与花色的形成、参与光合作用、酶促褐变等[9-13]。在植物细胞中,PPO和多酚是相互独立的两类物质,前者主要分布于类囊体中,后者存在于液泡中,当细胞受到损伤时,PPO会在氧气的参与下,催化多酚类物质生产醌类黑色素,使莲藕等果蔬褐变[7,14]。草酸处理莲藕切片可延缓切面褐变,并且显著降低PPO的活性[15]。抗坏血酸和芦荟凝胶联合使用抑制贮藏期间莲藕表面褐变,并抑制过氧化物酶(POD)和PPO的活性[16]。通过人工microRNAs基因沉默技术,同时下调马铃薯多酚氧化酶基因家族中StuPPO2、StuPPO3和StuPPO4,会产生低活性的PPO和低褐变的马铃薯[17]。洋葱提取物中的低分子量化合物对芋头多酚氧化酶和酶促褐变具有抑制作用[18]。番木瓜粗提物中存在的低分子量热稳定阴离子化合物可与 PPO催化活性双核位点结合,抑制PPO的活性[19]。通过农杆菌介导法将反义PPO转入苹果愈伤组织中,PPO活性和愈伤组织的褐变潜力均发生变化[20]。【本研究切入点】目前关于PPO导致莲藕等果蔬褐变的分子机制未见报道,仅有关于酶学性质、体外抑制PPO活性、生理活性等的研究。有研究表明SOD、CAT和POD等抗氧化酶也参与了莲藕的褐变过程[21]。笔者课题组前期发现NnPPO1与多个蛋白存在互作[22],本研究进一步筛选、验证与莲藕NnPPO1互作的褐变相关酶。【拟解决的关键问题】利用Y2H技术,从抗氧化酶保护系统中筛选出NnCAT1与NnPPO1存在蛋白互作;利用BiFC技术进一步验证NnPPO1与NnCAT1之间是否存在互作,通过截短蛋白寻找互作关键位点;并对NnPPO1与NnCAT1进行组织特异性表达分析;对NnCAT1进行生物信息学分析、亚细胞定位分析。为深入研究莲藕中NnPPO1与NnCAT1互作的分子机制奠定基础,为精准控制NnPPO1酶活性、降低褐变提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 植物材料 试验材料为莲藕‘鄂莲5号’品种;烟草为本氏烟草(Nicotiana benthamiana),种子播种于营养土中,萌发后7 d左右开始浇营养液,每隔2 d浇一次,温室温度为25℃,湿度约为70%,光照周期为14 h光照、10 h黑暗。
1.1.2 试验试剂及载体 植物总RNA提取试剂盒、反转录试剂盒、DNA聚合酶和限制性内切酶均购自宝生物工程有限公司;荧光定量试剂盒购自南京诺唯赞生物科技有限公司;大肠杆菌感受态、酵母菌感受态、农杆菌感受态、同源重组试剂盒Quick-Clone Mix购自陕西普因特生物公司;DNA marker、DNA胶回收纯化试剂盒和质粒提取试剂盒均购自OMEGA公司;X-α-Gal、Aureobasidin A购自Clontech公司;PCR引物合成及载体测序均由上海生工生物工程股份有限公司完成。
构建所有载体使用的大肠杆菌是EPI300感受态,酵母双杂试验所用载体为pGADT7和pGBKT7,酵母菌株为Y2HGold感受态,亚细胞定位试验使用的载体是p35S-eGFP[23],双分子荧光互补试验所使用的载体是35S-SPYNER173与35S-SPYCEM[24]。注射烟草叶片所使用的农杆菌菌株是GV3101感受态。
1.2 RNA提取及基因克隆
使用Plant RNA Extraction Kit(Takara)提取莲藕叶片总RNA;利用PrimeScript™ II 1st Strand cDNA Synthesis Kit(Takara)反转录合成cDNA。以莲藕叶片cDNA为模板,利用基因特异性引物(表1)对抗坏血酸过氧化物酶(APX)(GenBank: GU174022)[25]、过氧化氢酶(NnCAT1)、胞质铜-锌超氧化物歧化酶(CuZnSOD)(GenBank: GQ149102)[26]、半胱氨酸过氧化物酶(PER1)(GenBank: KU923323)[27]、过氧化物酶3(POD3L)(GenBank: XM_010245037)、过氧化物酶 43(POD43L)(GenBank: XM_010247537)、过氧化物酶 P7(PODP7L)(GenBank: XM_010248161)等5种抗氧化酶的7个基因进行PCR扩增;反应体系为 25 μL:cDNA 1 μL、PrimeSTAR Max Premix(2×)12.5 μL、上下游引物各 1 μL 和 ddH2O 9.5 μL。反应程序为98℃ 10 s;60℃ 15 s,72℃ 2 min,34个循环,16℃保存。PCR产物经琼脂糖凝胶电泳检测,使用胶回收试剂盒纯化,得到目的片段。
1.3 共转化验证
按照同源重组Quick-Clone Mix试剂盒的操作步骤,将APX、NnCAT1、CuZnSOD、PER1、POD3L、PODP7L、POD43L等的编码区分别克隆到 pGADT7(AD)载体上,课题组前期构建多酚氧化酶诱饵载体NnPPO1-BD和去除N端导肽部分的诱饵载体JDPPO1-BD[22];通过PEG/LiAc介导的方法,将质粒组合APX-AD+JDPPO1-BD、NnCAT1-AD+JDPPO1-BD、CuZnSOD-AD+JDPPO1-BD、PER1-AD+JDPPO1-BD、POD3L-AD+JDPPO1-BD、POD43L-AD+JDPPO1-BD、PODP7L-AD+JDPPO1-BD、pGBKT7-53+pGADT7-T(阳性对照)和pGBKT7-Lam+pGADT7-T(阴性对照)分别转入酵母Y2HGold感受态细胞中,转化后的菌液涂于DDO(SD/-Trp/-Leu)二缺平板上,进行筛选含质粒的酵母,28℃培养3—5 d。从DDO平板上挑取直径为2—3 mm的阳性克隆于DDO液体培养基中,在30℃、180 r/min摇床振荡培养过夜(12—16 h)。吸取1.5 μL酵母菌液均匀点播于提前标记好的QDO(SD/-Trp/-Leu/-His/-Ade)/X-α-Gal/AbA 和 DDO(SD/-His/-Ade)培养基上,28—30℃生长3—5 d后,分析菌落的生长状况。
1.4 互作蛋白的毒性和自激活检测
前期已做过NnPPO1的毒性与自激活检测[22],利用基因特异性引物将NnCAT1的编码区克隆至pGBKT7(BD)载体上,将重组载体NnCAT1-BD和
空载体pGBKT7分别转化酵母Y2HGold感受态中,转化后的菌液涂于SD/-Trp培养基上筛选,挑取单克隆,稀释100倍分别涂布在SD/-Trp培养基上。将质粒组合 NnCAT1-BD+AD、pGBKT7-53+pGADT7-T(阳性对照)、pGBKT7-53+pGADT7-Lam(阴性对照)分别转入酵母Y2HGold菌株的感受态细胞中,转化后的菌液涂于DDO(SD/-Trp/-Leu)二缺平板上,挑菌后均匀点播于SD/-Trp和SD/-Trp/-Leu/-His培养基上,28—30℃生长3—5 d后,分析菌落的生长状况。

表1 PCR 引物列表Table 1 PCR primer list
1.5 双分子荧光互补技术验证互作蛋白
利用同源重组技术,选择BamH I和XhoI酶切位点,将NnPPO1和NnCAT1的编码区分别构建至35S-SPYNER173和35S-SPYCEM载体上,通过冻融法转入农杆菌GV3101感受态中,28℃生长2 d后挑取阳性菌落于YEB液体培养基(含20 μg·mL-1Rif和50 μg·mL-1Kana)中,28℃振荡培养 12—16 h。离心收集菌体,用烟草注射渗透液(10 mmol·L-1MES-KOH(pH 5.6)、10 mmol·L-1MgCl2和 150 μmol·L-1乙酰丁香酮)重悬菌体至 OD600=0.8,将含有 35S-NnPPO1-SPYNER173、35S-NnCAT1-SPYCEM、P19和 35SNnPPO1-SPYNER173、35S-SPYCEM、P19的菌液分别按照1∶1∶1混合后黑暗静止4 h,然后注射到生长约35 d的烟草叶片中。2—5 d内,使用生物激光共聚焦显微镜(LECIA TCSSP8)观察表皮细胞的黄色荧光信号。
经济发展形势好,但国防观念不牢固。经济功能区是各地经济发展的火车头,总体发展形势比较好,但专注考虑经济发展多,对包括武装工作在内的其他工作大多重视不够。有的党政机关对民兵工作认识不全面不深入,一些企业认为编民兵会影响生产经营,有的甚至害怕与军方有关联影响对外贸易;同时受长期和平环境影响,全民国防意识有所淡化,企业员工对加入民兵组织积极性不高,民兵训练难落实的问题在经济功能区也更为突出。
1.6 蛋白序列分析和互作结构域分析
通过两种方法证实NnPPO1和NnCAT1之间是否存在互作及两者间如何互作,对NnPPO1和NnCAT1序列进行分析,用NCBI的Conserved Domains服务器分析NnPPO1和NnCAT1蛋白氨基酸序列的保守结构域;使用DNAMAN软件对NnCAT1与其他物种CAT序列进行多序列比对;根据NnPPO1和NnCAT1的结构域分析结果,将 NnCAT1的主要结构域 Catalase Domain(16—398 aa)和 Heme-binding Enzyme Domain(16—493 aa)分别构建到 AD载体上,将 NnPPO1的主要结构域 Tyrosinase Domain(175—380 aa)、PPO1_KFDV Domain(381—468 aa)和 PPO1_DWL Domain(469—597 aa)分别构建到BD载体上,利用酵母双杂的技术分析互作关键结构域。
1.7 亚细胞定位分析
设计引物(表1),使用PrimeSTAR扩增出NnCAT1的编码区,选择BamH I和KpnI酶切位点,然后构建到p35S-eGFP载体上,与GFP蛋白融合表达。通过农杆菌注射本氏烟草。2—5 d,在生物激光共聚焦显微镜下观察绿色荧光以及红色荧光信号。
1.8 NnPPO1与NnCAT1的组织特异性表达
启动子不仅调控着基因的表达水平,也调控着基因表达的时空顺序。用 PlantCARE对NnPPO1和NnCAT1的启动子区域进行分析;然后对它们的组织特异性表达进行分析,先将鄂莲5号的莲子在试验室发芽,待芽长至约10 cm时,选取大小基本一致的莲藕幼苗,种植于塑料桶中,桶内装土高度约10 cm,桶内装满水。待莲藕叶片完全展开,并长出藕带时,采收叶、叶柄、根、藕带、茎尖等部位,用液氮速冻,放于-80℃冰箱储存。使用RNA提取试剂盒提取样品总RNA并反转录为cDNA,设计引物(表1)进行PCR扩增,莲藕β-actin为内部参照基因[28],在QuantStudio(TM)6 Flex System实时PCR仪上进行实时荧光定量PCR。反应体系:2×ChamQ SYBR qPCR Master Mix 10 μL,正、反向引物各 0.8 μL,50×ROX Reference Dye 2 0.4 μL,稀释5倍的cDNA 2 μL,以ddH2O补足至20 μL;扩增程序为:95℃,30 s;95℃,10 s,60℃,30 s,72℃,1 min,35个循环;72℃,4 min。并通过SPSS的t检验确定显著性(P≤0.05)[29]。各部位样品均设3个技术性和3个生物学重复。
1.9 NnCAT1的生物信息学分析
为进一步探讨NnCAT1的生物学功能及其在莲藕褐变中的作用机制,本研究使用 Expasy(https://web.expasy.org/protparam/)对 NnCAT1蛋白(XP_010242894)的理化性质进行分析;利用 TMHMM Server v.2.0(http://www.cbs.dtu.dk/services/TMHMM/)对NnCAT1的跨膜结构进行预测;利用SignalP 4.1 Server(http://www.cbs.dtu.dk/services/SignalP- 4.1/)对 NnCAT1的信号肽进行预测;利用 ChloroP 1.1 Server(http://www.cbs.dtu.dk/services/ChloroP/)对NnCAT1的叶绿体转运肽进行预测;利用 Expasy(https://web.expasy.org/protscale/、https://web.expasy.org/protparam/)进行莲藕NnCAT1的亲疏水性分析;为了研究NnCAT1蛋白质结构与功能的关系,分别用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)和 SWISS-MODEL(https://swissmodel.expasy.org/)[30]预测 NnCAT1二级结构和三维结构。
2 结果
2.1 酵母双杂交筛选NnPPO1的互作蛋白
以莲藕cDNA为模板扩增7个基因(APX、CuZnSOD、PER1、POD3L、POD43L、PODP7L和NnCAT1)的编码区,分别得到1 044、459、660、981、963、957和1 479 bp的条带(图1-A)。将连接产物分别转化至EPI300大肠杆菌后,进行菌落PCR检测分析,得到的条带与预期的目的片段大小相同,将阳性菌液测序比对成功后,进行Y2H配对分析,结果显示,转化质粒的酵母菌在 DDO平板上生长良好,只有含NnCAT1-AD+JDPPO1-BD的酵母菌和阳性对照能在QDO/X/A平板上生长(图 1-B),表明 JDPPO1与NnCAT1之间可能存在蛋白互作。
2.2 互作蛋白的毒性和自激活检测
本研究对NnCAT1进行自激活和毒性检测。将含有NnCAT1-pGBKT7和对照组空载体pGBKT7的酵母,稀释相同倍数后分别涂布在 SD/-Trp平板上,结果显示,两个平板上的菌落大小和数目基本相同(图2-A),表明重组载体表达的NnCAT1蛋白对酵母的生长没有影响,对酵母菌无毒性。将含有NnCAT1-pGBKT7、阳性对照和阴性对照的酵母菌,稀释相同倍数后分别涂布在一缺 SD/-Trp和三缺SD/-Trp/-Ade/-His平板上,只有阳性对照在一缺和三缺平板上正常生长,含NnCAT1-pGBKT7载体的酵母菌和阴性对照在三缺平板上不能生长(图 2-B),说明 NnCAT1无自激活作用,无法将报告基因激活,JDPPO1与NnCAT1在酵母系统中确实存在互作。

图1 基因的克隆及互作蛋白筛选Fig. 1 Gene cloning and screening of interacting proteins
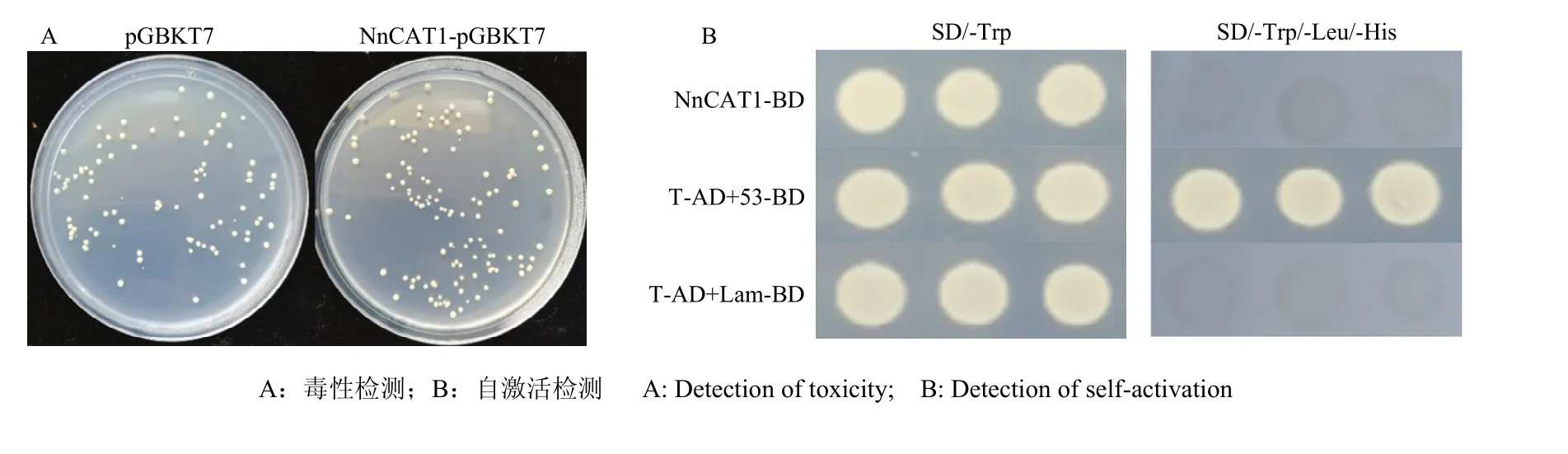
图2 莲藕NnCAT1蛋白的毒性和自激活检测Fig. 2 Detection of Toxicity and self-activation of NnCAT1 Protein
2.3 双分子荧光互补验证蛋白互作的真实性
35S-NnPPO1-SPYNER173与35S-NnCAT1-SPYCEM的组合有很强的黄色荧光信号,并且黄色荧光主要集中在细胞膜和细胞核上,而35S-NnPPO1-SPYNER173与空载体 35S-SPYCEM 的组合中未观察到黄色荧光信号(图3),说明在BiFC系统中NnPPO1与NnCAT1存在蛋白互作,并且互作位置在细胞膜和细胞核上,也进一步证实了酵母双杂交结果。
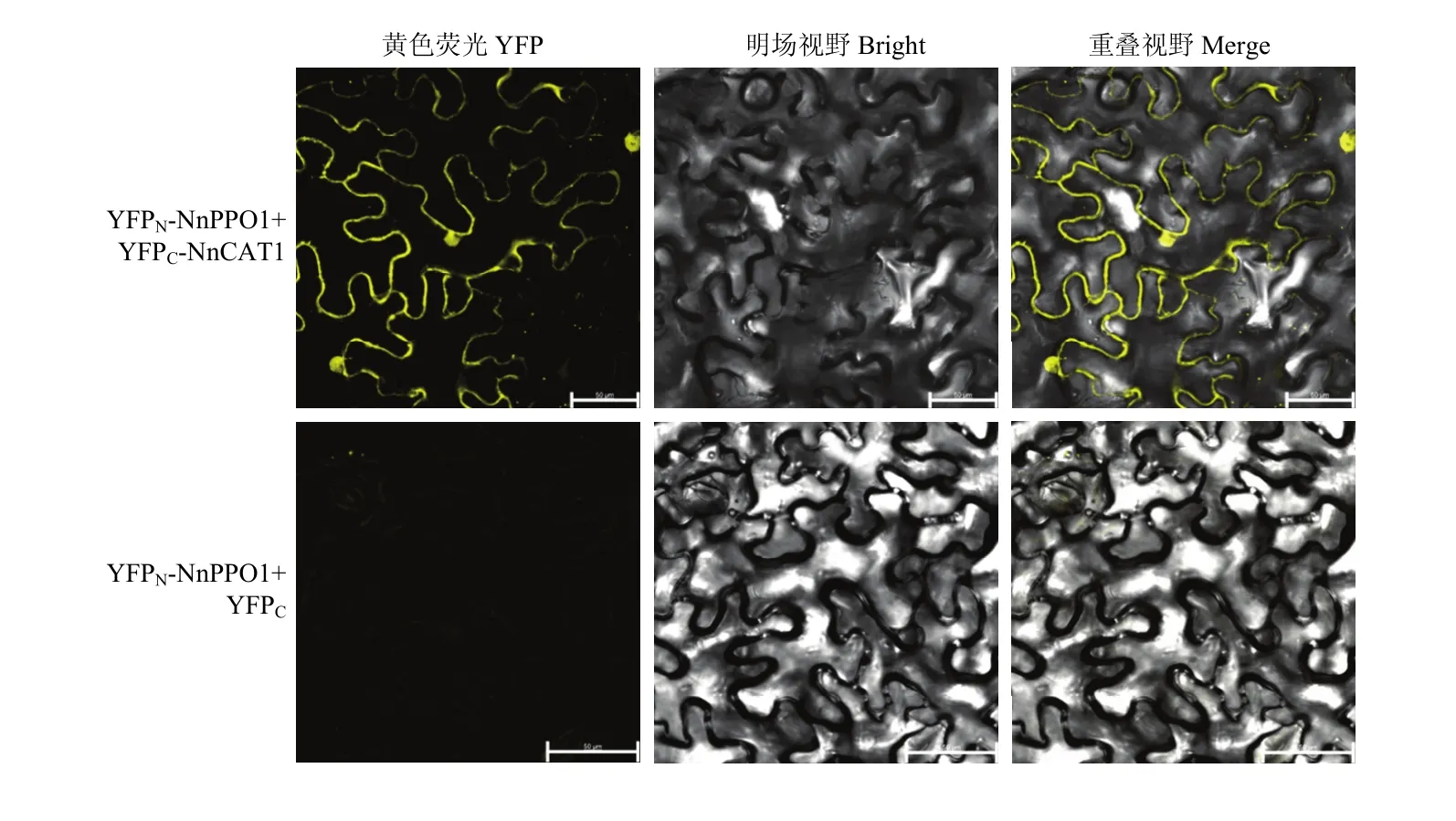
图3 双分子荧光互补检测NnPPO1与NnCAT1互作Fig. 3 Interaction between NnPPO1 and NnCAT1 detected by bimolecular fluorescence complementarity
2.4 蛋白序列分析和互作结构域分析
利用DNAMAN软件将NnCAT1与其他物种CAT氨基酸序列进行同源比对,发现该蛋白C末端包含保守的三肽模体(QKL)(图4),该模体可以与PTS1受体结合,说明莲藕NnCAT1可能是通过PTS1系统进入细胞内的过氧化物酶体。NnCAT1氨基酸序列与冬枣ZjCAT的相似度最高,达到91.67%,其次是与油菜、拟南芥、玉米、高粱的相似度分别为87.40%、86.79%、86.18%和86.18%,与大麦、木薯的相似度分别为83.94%和80.49%;证明该序列为莲藕的CAT,故命名为 NnCAT1。保守结构域分析发现,NnPPO1主要有 Tyrosinase Domain(175—380 aa)、PPO1_DWL Domain(381—468 aa)和 PPO1_KFDV Domain(469—597 aa)等3个结构域;NnCAT1主要有Catalase Domain(16—398 aa)和Heme-binding Enzyme Domain(16—493 aa)结构域。将NnPPO1和NnCAT1的主要结构域分别构建到BD和AD载体上,BD-NnPPO1175-380、BD-NnPPO1381-468、BD-NnPPO1469-597分别与AD-NnCAT1互作的结果显示,只有BD- NnPPO1175-380与AD-NnCAT1发生蛋白互作(图5),说明NnPPO1与NnCAT1的互作关键部位在其保守的酪氨酸酶结构域(Tyrosinase domain);而 AD-NnCAT116-398、AD-NnCAT116-493与BD-JDPPO1均不发生蛋白互作,在酵母系统中NnCAT1必须具有完整的氨基酸序列才可以与JDPPO1的互作。

图4 莲藕NnCAT1与其他物种CAT蛋白的氨基酸序列比对Fig. 4 Amino acid sequence alignment of NnCAT1 with other CAT proteins

图5 酵母双杂交验证互作关系Fig. 5 Results of the yeast two-hybrid
2.5 NnCAT1的亚细胞定位
将NnCAT1编码区构建至p35S-eGFP载体上,与载体中的eGFP蛋白融合表达,将重组质粒与空载体转入农杆菌,通过在烟草叶片中瞬时表达 NnCAT1与 GFP的融合蛋白,发现绿色荧光信号存在于细胞核和细胞膜上,并且与膜核定位信号(mCherry)红色荧光重合,空载体 GFP显示了相同的定位情况(图6)。
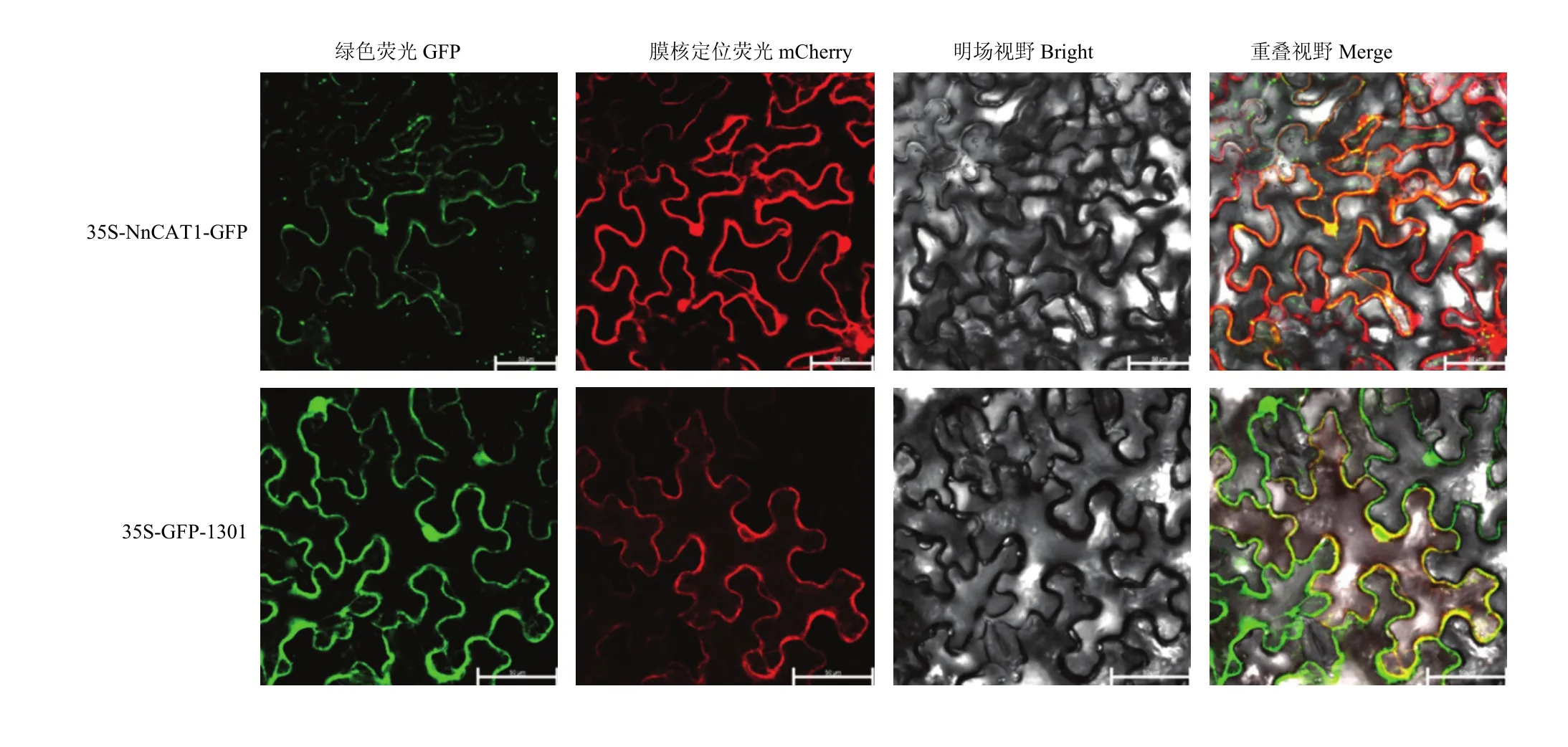
图6 NnCAT1蛋白的亚细胞定位分析Fig. 6 Subcellular localization analysis of NnCAT1 protein
2.6 NnPPO1与NnCAT1的组织特异性表达
利用PlantCARE对NnPPO1和NnCAT1起始密码子上游约2 000 bp的启动子序列进行分析,结果显示,NnPPO1序列中含有 AAAC-motif、Box 4、GT1-motif、TCCC-motif、TCT-motif、chs-CMA1a等光响应元件,ARE逆境响应元件,以及 CGTCA-motif、TGACG-motif、P-box等激素响应元件,推测NnPPO1的表达可能受到上述各因素的调控。NnCAT1序列中含有ATCT-motif、Box 4、G-box、GATA-motif、GT1-motif、I-box、TCT-motif等光响应性元件,ARE、MBS、TC-rich repeats等逆境响应元件,以及ABRE、CGTCA-motif、TCA-element、TGACG-motif等激素响应元件,推测NnCAT1的表达可能受到上述各因素的调控,部分响应元件见表2。
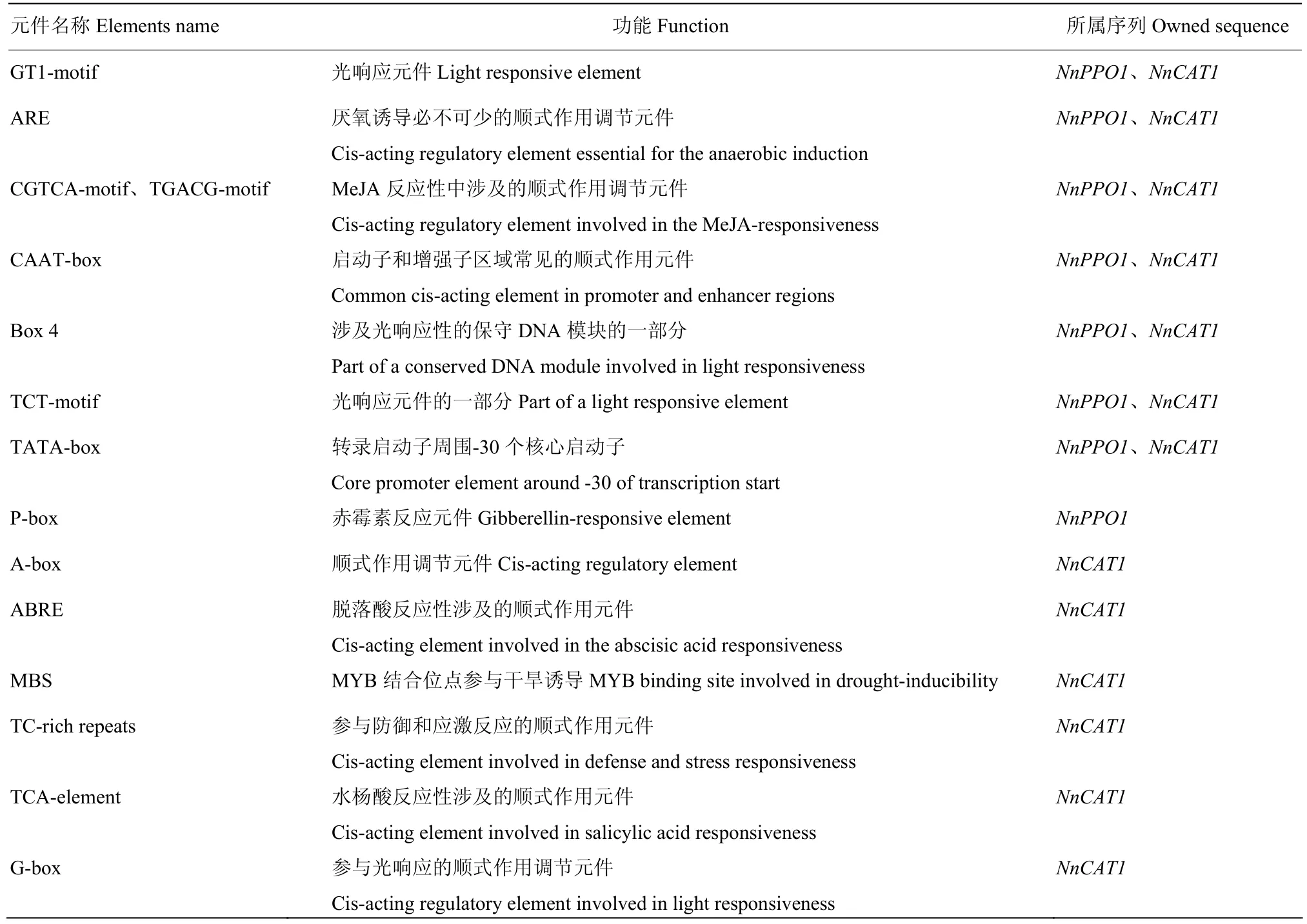
表2 NnPPO1与NnCAT1启动子响应元件Table 2 The response elements of NnPPO1 and NnCAT1
在莲藕幼苗的不同组织中两个基因均有表达。以叶中的表达量为标准进行比较,NnPPO1在叶中表达水平最高,根中其次,在茎尖中最低,并且NnPPO1在叶中的表达量是茎尖中的 15.19倍;NnCAT1在叶中表达水平最高,然后依次是叶柄、根、藕带,在茎尖中的表达量最低。另外,NnPPO1与NnCAT1的表达模式基本相同,都在叶中有最高的表达量,在茎尖中表达量最低。方差分析结果表明,5个部位中的NnPPO1表达量均有显著差异;根中NnCAT1的表达量与藕带中的差异不显著,其余部位之间均差异显著(图7)。由此推测NnPPO1与NnCAT1可能在叶、叶柄和根的颜色与生长发育中发挥重要作用。
2.7 NnCAT1的生物信息学分析
莲藕NnCAT1的相对分子质量约为57.0 kD,理论等电点(PI)为6.93。正电荷残基(Arg+Lys)总数为60个,负电荷残基(Asp+Glu)总数为62个,其分子式可写为 C2573H3874N716O727S17,不稳定系数为33.03,属于稳定蛋白;跨膜结构和信号肽预测结果显示NnCAT1无跨膜区、无信号肽;叶绿体转运肽预测结果表明,NnCAT1存在叶绿体转运肽,前21 aa为转运肽区域。NnCAT1的亲疏水性分析,结果如图8所示,分值在0以上为疏水性氨基酸,在0以下为亲水性氨基酸,得分最大值为2.389,最小值为-2.678,平均值为-0.587,证明NnCAT1是亲水性蛋白质。
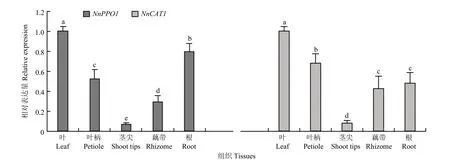
图7 NnPPO1与NnCAT1的组织特异性表达Fig. 7 Tissue-specific expression of NnPPO1 and NnCAT1
蛋白质二级结构预测结果显示,NnCAT1蛋白由27.64%α-螺旋、15.65%延长链、6.30%β-转角和50.41%无规则卷曲构成(图9-A)。NnCAT1的三维空间结构预测显示,其序列的一致性为47.64%,为同源四聚体蛋白,序列与模板序列的相似度为0.43,覆盖为0.99,为Catalase-like Superfamily家族CATALASE蛋白,与目标基因相吻合(图9-B)。
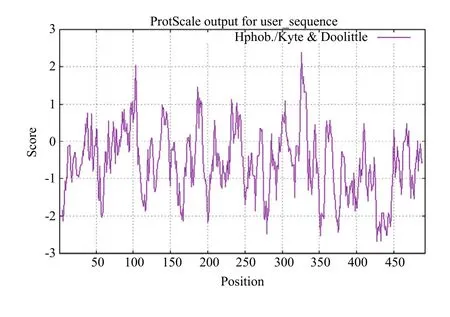
图8 NnCAT1蛋白亲疏水性分析Fig. 8 Hydrophilicity of NnCAT1 Protein

图9 NnCAT1的二级结构和三级结构预测Fig. 9 Secondary structure and tertiary structure prediction of NnCAT1
3 讨论
3.1 NnPPO1与NnCAT1存在蛋白互作
蛋白互作是当前的研究热点之一,但关于PPO的蛋白互作,除本课题组研究结果外,未见其他文献报道。张海星[31]通过酵母双杂和BIFC证实了丹参PPO和酪氨酸氨基转移酶存在互作关系,证明丹参PPO对丹酚酸类的代谢有一定的调控作用。拟南芥 AtNCA1与AtCAT2相互作用,可以将过氧化氢酶的折叠保持在功能状态,AtNCA1对于过氧化氢酶活性至关重要[32]。水稻叶片中GLO和OsCAT的互作-解离是调节水稻中H2O2水平的一种特定机制[33]。
SOD和CAT酶活性是莲藕褐变的第二主因子,所以在研究莲藕褐变机理时,可以从SOD和CAT方面着手[21]。为了深入探索PPO导致莲藕等果蔬褐变的分子机制,本研究利用莲藕NnPPO1成员,通过酵母双杂方法,从抗氧化酶保护系统中筛选出NnCAT1蛋白与NnPPO1互作,NnCAT1具有CAT蛋白家族的所有主要特征氨基酸残基、基序和元件[34],主要功能是催化过氧化氢分解为H2O和 O2,以防止活性氧自由基对植物造成的伤害[35]。同时过氧化氢酶在植物中有很多作用,如抗高(低)温胁迫、盐胁迫、干旱胁迫、抗病性、延缓植物衰老等[36-41]。本研究在烟草叶片细胞膜和细胞核上检测到强烈的黄色荧光信号,更加确定了NnPPO1与NnCAT1之间存在相互作用关系。推测 NnPPO1与 NnCAT1协同互作导致果蔬褐变,NnCAT1将H2O2分解产生的O2进入质体中,此时在NnPPO1的强烈催化下,产生的O2直接与多酚类物质反应形成醌类,这时果肉逐渐变色,具体还需要蛋白水平和遗传水平的进一步验证。
多序列比对发现NnCAT1与其他物种的CAT具有很高的相似度,表明不同物种间CAT序列具有很强的保守性;NnPPO1与NnCAT1的互作关键部位在其保守的酪氨酸酶结构域,而此结构域包含CuA和CuB的活性中心,互作结果与前人所述的 Tyrosinase Domain是NnPPO1主要功能区一致[8];NnCAT1的完整氨基酸序列才能与JDPPO1发生互作,说明除结构域以外的部分对NnCAT1的互作过程中有不可或缺的作用,为进一步研究互作机理及构建cat1、ppo1突变体植株提供了参考。
3.2 亚细胞定位与组织表达特异性分析
本研究结果表明,NnCAT1定位在细胞膜和细胞核,而前期研究表明NnPPO1存在于叶绿体上[22],结合它们的互作位置在细胞膜和细胞核上,说明正常状态时NnCAT1与NnPPO1并不接触,推测在莲藕组织或细胞受到损伤,这种空间隔离打破后,它们会到共同的位置上协同作用导致莲藕褐变。研究表明 CAT定位于过氧化物酶体中,但也有分布于其他部位,玉米的CAT3定位于线粒体中,它可能在替代氧化酶途径中起作用[42]。拟南芥 AtCAT3亚细胞定位研究发现,AtCAT3定位在细胞膜、细胞质、过氧化物酶体中,说明AtCAT3也参与了细胞膜、细胞质中H2O2的代谢[43]。槟榔过氧化氢酶(ArCAT)亚细胞定位结果表明,ArCAT1蛋白定位于过氧化物酶体中,而ArCAT2和 ArCAT3定位于过氧化物酶体和细胞核中[44]。红苋菜过氧化氢酶-酚氧化酶(AcCATPO)位于过氧化物酶体和细胞核中[45]。CAT的定位与其在细胞中的功能有着密切的关系。
NnPPO1启动子序列中发现了很多光响应、厌氧诱导响应和激素响应元件,NnCAT1启动子序列中发现了很多光响应、厌氧诱导响应、激素响应、干旱响应和参与防御和应激反应元件,推测其可能参与了植物体内各种逆境胁迫应答,为深入揭示莲藕NnPPO1与NnCAT1的表达调控机制提供了理论依据[46]。组织特异性结果表明NnPPO1与NnCAT1的表达模式基本相同,暗示NnCAT1与NnPPO1协同互作使莲藕等果蔬褐变,推测 NnPPO1与 NnCAT1在植物中可能具有广谱的互作关系,以发挥更多的作用。莲藕中含有大量的多酚氧化酶,因此,莲藕是研究多酚氧化酶比较理想的植物材料。本研究结果为深入探讨莲藕NnPPO1与NnCAT1的生物学功能,研究莲藕PPO的分子作用机制,精准抑制其活性奠定了基础。
4 结论
运用酵母双杂交技术,从抗氧化酶保护系统中筛选出NnCAT1与NnPPO1存在蛋白互作;利用BiFC进一步证实NnPPO1与NnCAT1之间的互作关系,且NnPPO1保守的酪氨酸酶结构域在互作中发挥主要作用;亚细胞定位发现,NnCAT1蛋白定位于细胞核和细胞膜上;组织特异性表达结果显示NnPPO1与NnCAT1的表达模式基本相同,都在叶中有最高的表达量,在茎尖中表达量最低。

