人工感染禽腺病毒血清4型病毒对鹅组织中免疫相关因子基因表达的影响
任梦婷,姜 磊,刘亮亮,李慧昕,张莉莉,侯雨彤,马得莹
(1.东北农业大学 动物科学技术学院,黑龙江 哈尔滨 150030;2.中国农业科学院 哈尔滨兽医研究所 兽医生物技术国家重点实验室,黑龙江 哈尔滨 150069)
天然免疫系统是机体抗感染的第一道防线,部分天然免疫通过模式识别受体(pattern recognition receptors,PRRs)识别病原相关分子模式(pathogen-associated molecular pattern,PAMP)[1]。Toll样受体(toll-like receptors,TLRs)是最重要的PRRs之一,目前,在禽体内已经发现10种TLRs,不同TLRs在细胞内定位不同,识别不同的PAMP,TLRs识别特异性配体后,通过激活MyD88依赖性或MyD88非依赖性途径激活下游信号转导途径,引发机体抗病毒反应和炎症反应,进而诱导防御素、促炎细胞因子和干扰素等免疫相关因子的表达,以抵御入侵的病原体[2]。防御素是一种富含半胱氨酸的内源性阳离子多肽,对细菌、真菌及病毒具有广谱抗性,属于抗菌肽的一个基因类别[3],禽类体内的防御素均为禽β-防御素(avian β-defensin,AvBDs),AvBDs参与宿主天然免疫反应[4]。研究发现防御素可以激活树突状细胞,并且调节干扰素(interferon,IFN)-γ表达,表明其可能在特异性免疫中发挥作用[5]。细胞因子参与细胞免疫、体液免疫以及炎症反应等重要生理学过程,是天然的治疗剂和疫苗佐剂的优良候选者,IL-18可以促进IFN-γ产生[6],IFN-γ参与多种免疫调节过程,具有较强的抗肿瘤、抗细胞分裂以及抗病毒功能[7]。与适应性免疫相比,先天免疫系统具有作用范围广、反应速度快、相对稳定等优点。
禽腺病毒(fowl adenovirus,FAdV)为线性双股DNA病毒,无囊膜,大小为43~45 kb[8]。1987年,巴基斯坦的安卡拉哥特地区首次发现FAdV[9],后来陆续在世界各地出现FAdV感染,给世界各国养禽业造成巨大经济损失。在2010年,中国也出现关于FAdV严重感染的报道[10]。感染FAdV可以引发禽类心包积水综合症(hydropericardium syndrome,HPS)、包涵体肝炎(inclusion body hepatitis,IBH)和肌胃糜烂(gizzard erosions,GE)等疾病[11-12],3~5周龄肉仔鸡死亡率高达100%[13]。2015年,我国多个省份暴发FAdV-4感染,造成巨大经济损失[14]。不同腺病毒感染不同宿主,2010年,匈牙利某鹅养殖场暴发急性疾病,经鉴定为GoAdV[15];2016年我国首次报道了国内鹅群感染FAdV-4病例,但并未进行深入研究[16],FAdV对水禽养殖业存在威胁。
FAdV基因型和血清型众多,变异和重组难免发生,不同物种间可能产生交叉感染,国内腺病毒感染可能与污染FAdV活疫苗和垂直传播有关[17]。所以,疫苗免疫并不能彻底保护机体免受病毒入侵。本试验以FAdV-4感染鹅,系统研究脾脏、哈德氏腺、骨髓、法氏囊和盲肠扁桃体中免疫相关基因mRNA表达水平及病毒载量,了解鹅抗FAdV先天免疫机制,为预防和治疗FAdV提供试验基础和新思路。
1 材料与方法
1.1 实验动物50只30日龄健康鹅,由哈尔滨国生生物科技股份有限公司实验动物中心提供;FAdV-4(HN/151025)病毒株由中国农业科学院哈尔滨兽医研究所禽呼吸道创新团队提供,病毒GenBank登录号为KU245540.1。
1.2 主要试剂One Step SYBR®Prime ScriptTMRT-PCR Kit Ⅱ试剂盒(Cat.#RR086A)、SYBR®Premix Ex TaqTM Ⅱ (Perfect Real Time)、ExTaq DNA聚合酶、RNAiso Plus和琼脂糖均购自TaKaRa宝生物工程(大连)有限公司;凝胶回收试剂盒购自OMEGA公司;异丙醇、三氯甲烷和无水乙醇等均为实验室分析纯。
1.3 动物试验将50只30日龄健康鹅随机分为3组,攻毒组(30只)和对照组(20只),经滴鼻点眼接种106.5×TCID50鸡源FAdV-4强毒株(HN/151-025)0.1 mL/只,对照组接种同种剂量PBS,隔离饲养,自由采食和饮水。在攻毒后36,72 h和7,21 d,分别在攻毒组和对照组随机选取5只鹅,采取脾脏、哈德氏腺、骨髓、法氏囊和盲肠扁桃体冷冻保存。剩余10只鹅为固定观察组,用于观察并记录临床症状。
1.4 引物设计及合成根据GenBank上已发表的鹅18S rRNA基因序列设计特异性引物(表1),鹅AvBDs、细胞因子(IL-1β、IL-2、IL-6、IL-8、IL-18、IFN-γ)、TLRs(TLR1、TLR2、TLR3、TLR5、TLR7、TLR15)参考XU等[18],MyD88引用WEI等[19]引物,上述引物由北京六合华大基因科技有限公司合成。
1.5 组织总RNA提取按照Trizol方法[18]提取组织总RNA,用70 μL DEPC水溶解,-70℃保存备用。
1.6 实时荧光定量RT-PCR标准品的制备以鹅骨髓提取的组织总RNA为模板,用设计的基因序列特异性引物,荧光定量RT-PCR方法扩增目的片段,回收克隆到PMD18-T载体上,构建重组质粒。
表1 荧光定量RT-PCR引物序列
1.7 实时荧光定量RT-PCR将重组质粒标准品连续10倍稀释8个梯度,用于构建标准曲线。以各组织总RNA为模板,使用表1所示的特异性引物进行实时荧光定量RT-PCR扩增,每个样品做3个重复,取其平均值。PCR反应体系25 μL:2×one step buffer 12.5 μL;RNA Free dH2O 7.5 μL;PrimeScript one step Enzyme Mix 1 μL;Forward Primer(2.5 μmol/L)1 μL;Reverse Primer(2.5 μmol/L)1 μL;RNA 2 μL。PCR反应程序:42℃反转录5 min;95℃预变性10 s;95℃变性5 s,60℃退火30 s,共40个循环;40℃延伸30 s。
2 结果
2.1 经FAdV-4感染后,鹅各组织病毒载量在鹅感染FAdV-4后的不同时间点,通过荧光定量RT-PCR方法,检测病毒在各组织中的病毒载量,结果显示对照组中各组织在不同时间点均未检测到病毒分布。在攻毒组中,法氏囊在攻毒后36 h和3 d,哈德氏腺在攻毒后7 d以及盲肠扁桃体在攻毒后21 d检测到病毒(图1),试验攻毒成功,鹅能够感染FAdV-4,但临床症状及解剖结果发现,鹅只无明显的发病和死亡现象。

图1 鹅经FAdV-4感染后各组织的病毒载量
2.2 FAdV-4感染后TLRs在鹅组织中表达量在鹅感染FAdV-4过程中,5个免疫组织均未检测到TLR4基因表达,其他TLRs在各组织中广泛表达,并且存在差异。感染FAdV-4后,与对照组相比,TLR1在哈德氏腺(7和21 d)表达量显著下调(P<0.05),在法氏囊(21 d)中表达量显著下调(P<0.05)。TLR2在脾脏中(36 h)表达量显著上调(P<0.05)。TLR3(72 h)在脾脏中被诱导表达(P<0.05),但在哈德氏腺(72 h和21d)、骨髓(72 h)以及在感染后期(7和21 d)的法氏囊表达量显著下调(P<0.05)。TLR5在脾脏和盲肠扁桃体(7 d)中表达量显著上调(P<0.05),在法氏囊(36 h)、哈德氏腺(72 h)以及骨髓(7 d)中表达量显著下调(P<0.05)。TLR7在盲肠扁桃体(36 h)、骨髓(7 d)和法氏囊(21 d)中表达量显著下调(P<0.05)。TLR15在骨髓(36 h)以及盲肠扁桃体(7和21 d)中表达量显著上调(P<0.05);但在法氏囊(36 h)、骨髓(72 h和7 d)、脾脏(21 d)以及感染后期的哈德氏腺中基因表达量显著下调(P<0.05)(图2)。
2.3 FAdV-4感染后TLRs信号通路关键基因在鹅组织中表达量FAdV-4感染后鹅体TLRs信号通路基因在不同时间点和不同组织器官内广泛分布,基因表达量呈现出显著性变化。MyD88在法氏囊(36 h)中显著上调(P<0.05),在脾脏(72 h)中基因表达量显著下调(P<0.05);感染后7 d,MyD88基因表达无显著性变化;在盲肠扁桃体和法氏囊(21 d)中基因表达量显著下调(P<0.05)。TRIF在哈德氏腺(36 h)、脾脏(72 h)和盲肠扁桃体(7,21 d)中表达受到抑制(P<0.05);在骨髓(7 d)表达量显著上调(P<0.05)。Rel在盲肠扁桃体(36 h)中基因表达量显著下调(P<0.05);感染后72 h,盲肠扁桃体中基因表达量显著上调(P<0.05),但在骨髓中基因表达受到抑制(P<0.05);感染后7 d,在盲肠扁桃体中基因表达量显著上调(P<0.05),在脾脏和骨髓中表达量显著下调(P<0.05);感染后21 d,Rel基因在各组织表达量无显著性变化。ERK于感染病毒后36 h,在哈德氏腺中基因表达量显著下调(P<0.05);感染后72 h,在脾脏、法氏囊和盲肠扁桃体中基因表达量显著下调(P<0.05);感染后7 d,基因表达量无显著性变化;感染后21 d,在法氏囊和盲肠扁桃体中表达量显著下调(P<0.05)(图3)。

图2 感染FAdV-4后各组织TLR1基因表达水平变化 A.TLR1;B.TLR2;C.TLFR3;D.TLR5;E.TLR7;F.TLR15
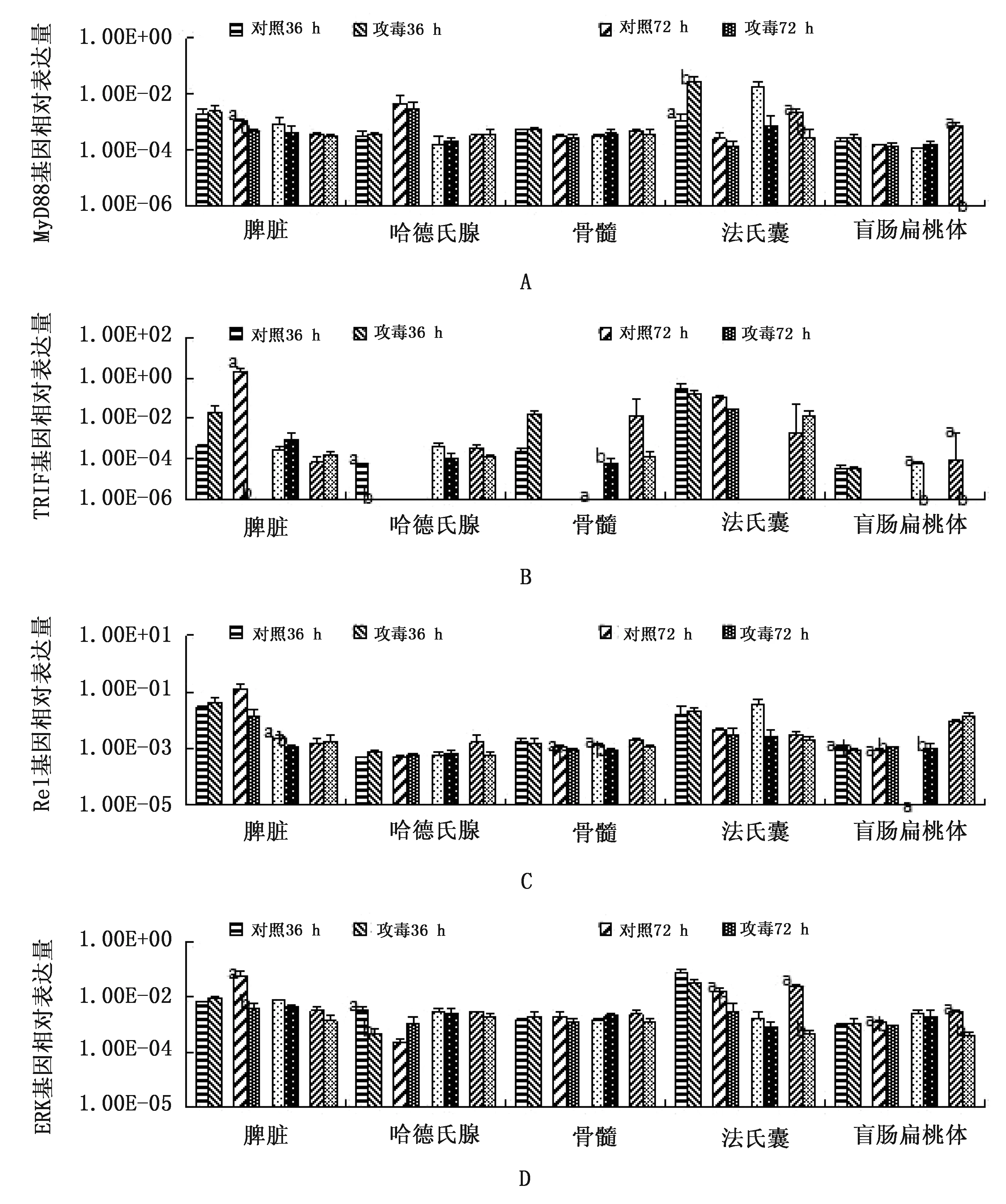
图3 感染FAdV-4后各组织TLRs信号通路关键基因表达水平变化 A.MyD88基因;B.TRIF基因;C.Rel基因;D.ERK基因
2.4 FAdV-4感染后AvBDs基因在鹅组织中的表达量鹅经FAdV-4感染后不同时间和组织器官中,AvBDs基因表达量存在明显差异。AvBD1,4,7,9,10在试验时间内部分组织中未检测到,AvBD2,5,16在不同时间的各组织中广泛分布,AvBD6未检测到(部分结果图中未显示)。试验期间,与对照组相比,AvBD1在感染前期(36和72 h)法氏囊中被诱导表达(P<0.05)。AvBD2在不同时间点的不同组织中广泛表达,在骨髓中的表达量高于其他组织。AvBD4仅在骨髓、法氏囊和盲肠扁桃体中检测到,但其表达量均无显著性变化。AvBD5在FAdV-4感染后36 h、7和21 d的脾脏中基因表达被完全抑制(P<0.05),在病毒感染期间骨髓中相对表达量有上调趋势但差异不显著。AvBD7在试验期间骨髓、法氏囊以及感染前期哈德氏腺中检测到,但其基因相对表达量无显著性变化。AvBD9仅在脾脏(36 h)中被诱导表达(P<0.05)。AvBD10在骨髓、法氏囊(7 d)中基因相对表达量显著上调(P<0.05)。AvBD16在脾脏(36 h)中基因相对表达量显著上调(P<0.05),且整个试验过程中AvBD16在骨髓和法氏囊中的基因相对表达量高于其他组织(图4)。
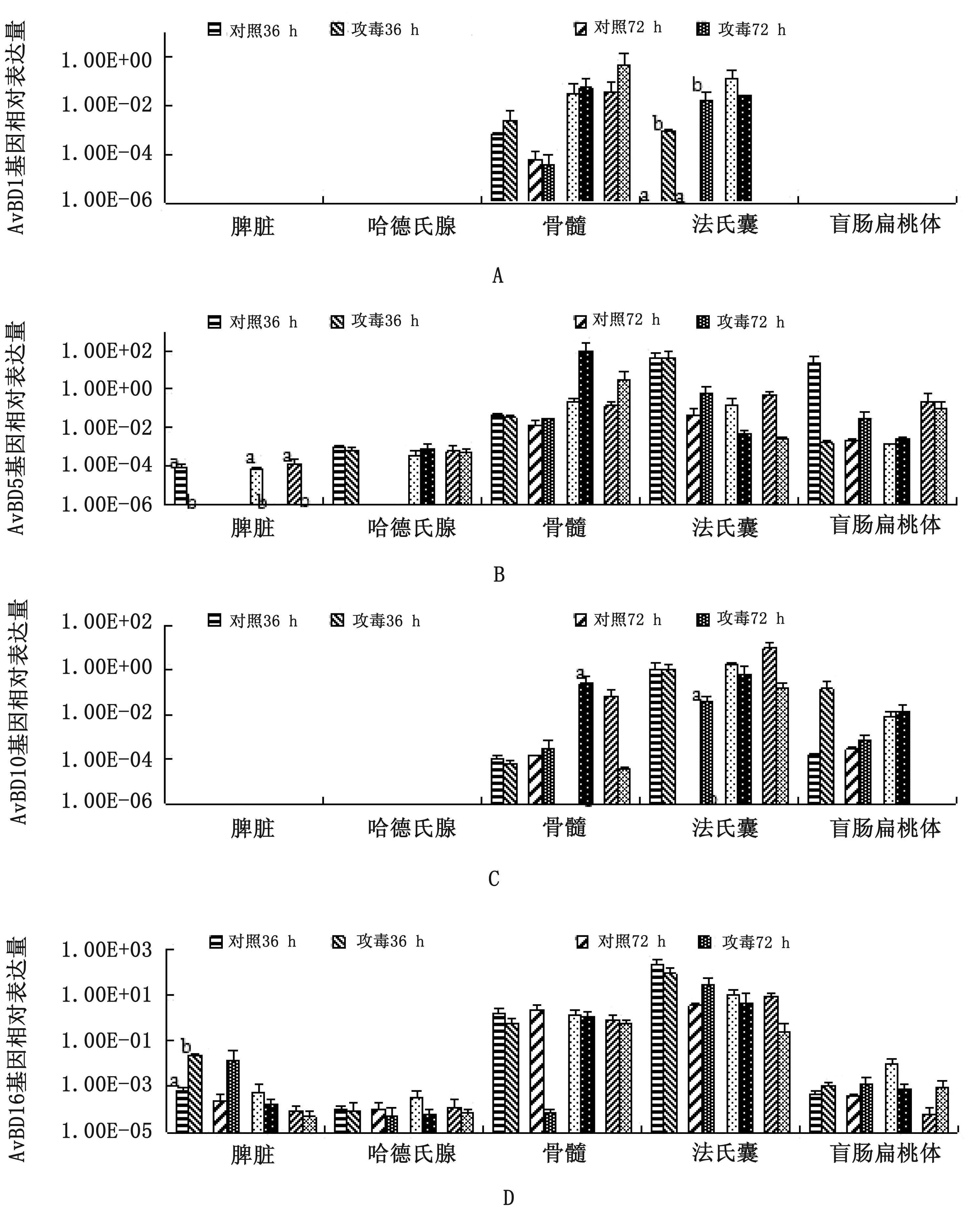
图4 感染FAdV-4后AvBDs基因在各组织表达水平变化 A.AvBD1;B.AvBD5;C.AvBD10;D.AvBD16
2.5 FAdV-4感染后细胞因子基因在鹅组织中的表达量经FAdV-4感染后,白细胞介素在不同时间和不同组织器官中分布广泛,基因表达量存在明显差异。感染FAdV-4后36 h,IL-1β在法氏囊、盲肠扁桃体中表达量显著下调(P<0.05);IL-2在哈德氏腺、法氏囊中基因表达明显受到抑制(P<0.05);IL-6在盲肠扁桃体中基因表达量显著上调(P<0.05),而在脾脏中基因表达量显著下调(P<0.05);IL-8和IL-18未发现显著性变化。感染FAdV-4后72 h,IL-1β在骨髓中基因表达受到抑制(P<0.05);IL-2在法氏囊中基因表达量显著下调(P<0.05);IL-8在脾脏中基因表达量显著上调(P<0.05);IL-18在脾脏中受到诱导表达(P<0.05)。感染FAdV-4后7 d,IL-1β和IL-2在法氏囊中基因表达量显著下调(P<0.05);IL-6、IL-8和IL-18无显著性变化。感染FAdV-4后21 d,IL-1β除在盲肠扁桃体中基因表达量显著上调以外(P<0.05),在哈德氏腺、骨髓和法氏囊中基因表达量均显著下调(P<0.05);IL-2在哈德氏腺中基因表达量显著上调(P<0.05),而在法氏囊中受到抑制(P<0.05);IL-6在法氏囊和哈德氏腺中基因表达受到抑制(P<0.05),IL-8在法氏囊中表达量显著下调(P<0.05)。感染FAdV-4后,IFN-γ基因未在哈德氏腺表达,与对照组相比,在整个试验期间法氏囊中,IFN-γ基因表达量均表现出下降趋势,且在感染后21 d,表达量显著下调(P<0.05)(图5).
3 讨论
2015年以来,FAdV-4在中国鸡群中流行,严重影响家禽生产性能,研究发现,FAdV-4感染可以导致鸡只死亡率70%[20],鸭死亡率15%[21],给养禽业发展造成严重影响。LI等[23]用本试验所用毒株感染40日龄SPF鸡,肌肉注射组发病率100%和死亡率90%,口腔攻毒组发病率100%和死亡率30%,病毒感染后,肝脏出现脂肪空泡、坏死灶和核内包涵体,心外膜水肿[13]。研究发现,对鹅进行人工感染FAdV-4时,皮下注射组有3只鹅出现抑郁和瘫痪的症状,并且有1只鹅死于轻度心包,而口腔感染组未出现明显的发病和死亡情况[22]。本次试验中,鹅感染FAdV-4后没有明显的发病症状和死亡现象,剖检时没有典型眼观病变。推测可能HN/151025株具有物种差异性,该毒株对鹅易感性较差。LI等[23]研究发现,鸡只感染FAdV-4后,可以在多种组织中检测到较高的病毒载量,但是该病毒不感染鸭。然而,本试验发现,经鸡源FAdV-4强毒-HN/151025株感染鹅后,在脾脏和骨髓中并未检测到病毒,在感染前期的法氏囊,以及感染后期的盲肠扁桃体和哈德氏腺中检测到病毒,且在大肠胰腺和胆囊不同时间点均检测到较高的病毒载量,推测可能由于HN/151025株在鹅体内组织嗜性发生改变,易感性较差,以及AvBDs、ILs和IFN等免疫相关因子的表达抑制病毒在鹅体内的复制等原因造成的。
TLRs在先天免疫中发挥重要作用,目前,多项研究表明,TLRs参与AIV、IBDV、IBV和沙门菌等病原体的抗感染机制,可以诱导抗病毒因子表达,保护机体免受病原体的侵袭[24-25]。然而,对于禽TLR在FAdV感染中的作用研究较少。本次试验表明,在感染初期,TLR2和TLR3在脾脏中相对表达量上调(P<0.05);在感染后期,TLR5和TLR15在个别组织中表达量上调(P<0.05)。有研究发现,TLR2和TLR3可以识别dsDNA病毒[26-27],这与本试验结果一致。有研究表明,DNA病毒马立克氏病毒(Marek’s disease virus,MDV)在感染鸡后,法式囊和脾脏中TLR3、TLR7以及TLR15的表达量上调[28]。本次试验中TLR7并未被诱导表达,反而在部分组织中表达量显著下调(P<0.05)。有研究发现,TLR7仅可以识别单链RNA病毒,当病毒进入到受感染细胞的细胞质中时,才能被TLR7识别[29]。ZHOU等[30]通过体内试验证实,MyD88参与了哺乳动物腺病毒感染所引发的TLRs信号传导途径以及诱导产生炎症细胞因子。在禽体内,除TLR3外的TLRs均能经MyD88途径最终导致核因子NF-κB激活,而TLR3必须与TRIF接头蛋白结合才能激活下游通路,诱发炎症反应。MyD88仅在感染后36 h显著上调(P<0.05),与TLR2的表达情况一致;而与TLR3的表达情况不同的是,TRIF在感染初期表达量受到抑制,而感染后期表达量显著上调(P<0.05)。因此,推测腺病毒感染鹅后可能由TLR2识别病毒,通过NF-κB途径而引起下游信号级联反应。
TLRs与特异性配体相互作用可以诱导防御素和细胞因子等表达,防御素是先天免疫重要的组成部分,目前,在禽类体内发现了50多种AvBDs,AvBDs最开始被认为是抗菌剂,近几年研究发现其具有抗病毒的潜力。研究表明,AvBDs对鸭肝炎病毒[31]、流感病毒[32]和传染性支气管炎病毒[33]具有抗病毒活性。研究发现,鸡感染NDV后能够诱导AvBD2以及AvBD5基因表达[34];经鸭源ND强毒感染后,鸭体内AvBD1、AvBD2、AvBD5、AvBD9和AvBD16的表达量显著升高[35];而鹅感染NDV后,AvBD4和AvBD16能够被诱导表达,在感染前期的盲肠扁桃体中,AvBD1的表达受到抑制[18]。在感染鸭肝炎病毒的鸭组织中AvBD1表达量上调[31],然而本次试验发现,经FAdV-4感染后,鹅体内AvBD1、AvBD9、AvBD10和AvBD16表达量上调,AvBD5表达量受到抑制。这些发现表明,病毒对AvBDs表达量的影响可能取决于病毒的种类、动物的种类或者不同的组织器官。
细胞因子在抗病毒反应和调节免疫应答中发挥重要作用,IL-1β可以通过诱导促炎基因表达和募集免疫细胞介导炎症反应,进而发挥抗病毒感染的作用[36]。PAMPs不能直接影响IFN-γ的表达,激活的巨噬细胞分泌的IL-2、IL-18可以调节IFN-γ的表达[37]。LI等[23]研究发现,感染FAdV-4的鸡只,组织中IL-6和IL-8基因表达量显著上调,引起严重的炎症反应,造成鸡只急性死亡。本研究发现,感染前期,鹅组织中IL-6和IL-8基因表达量显著上调,感染后期,IL-6和IL-8基因表达量受到抑制,说明,FAdV-4感染存在较大的种间差异。研究发现,肉鸭皮下注射和口服感染FAdV-4后,IL-2表达量显著上调,分别在6和9 d达到最大值,而后表达量显著下调[38]。与之不同的是,本试验中经滴鼻点眼感染FAdV-4后,IL-2表达量显著下调,21 d表达量显著上调,这可能与种间差异和感染途径有关。HELENA等[39]发现鸡感染FAdV-4后,IFN-γ水平下降,并且在10 d显著下调。本试验结果与之相似,IFN-γ感染前期均显示下降趋势,且在21 d显著下调。
本次研究发现,鸡源FAdV-4强毒-HN/151025株可以感染鹅群,但是并不引起明显的发病率和死亡率,说明FAdV-4感染存在较大的种间差异。此外,FAdV-4感染诱导大量先天免疫相关基因(TLR2、AvBD1、AvBD9、AvBD10、AvBD16、IL-6和IL-8)表达,这些因子可能在鹅抗FAdV-4感染的先天免疫中发挥作用,为预防FAdV感染和疫苗佐剂的研发提供新的可能。

