信息型氧化还原方程式的书写策略
◇ 石凤吉
信息型氧化还原方程式的书写是高考重点题型,也是“信息量比较大”的一类题型.它将元素化合物知识、氧化还原反应、元素周期表结构、离子反应、反应类型等知识融会贯通,依托化学学科的基础知识、基本能力、基本素养,以科技信息、材料为背景,考查学生获取信息、加工信息、整合信息、分析推理和迁移运用知识的综合能力.试题综合性强,对能力要求高,若要顺利解答此类题目,必须在学习中善于归纳总结,逐步形成行之有效的解题策略.
1 构建元素的价类二维图
信息型氧化还原方程式题型的特点是题干中常以反应现象、物质性质、元素价态变化、新情境等信息呈现,要求以此判断产物,正确书写化学方程式.而化合价变化是氧化还原反应的本质特征,也是正确解答此类问题的总抓手.以元素为核心,围绕化合价变化,结合物质分类,绘制成元素的“价类二维图”,如图1和图2所示,实现对元素化合物知识的网络化、系统化,从类别和价态两个角度认识物质性质和转化,引导学生分析物质的氧化性和还原性,进而分析物质发生的氧化还原反应,明确信息型氧化还原方程式书写的方向和思路,为顺利解决此类问题奠定知识基础.

图1

图2
例1(2017年全国卷Ⅰ,节选)写出图3流程中“高温煅烧②”由FePO4制备LiFePO4的化学方程式

图3
根据流程初步判断原料和产物:

铁由+3价转化为+2价,化合价降低,H2C2O4中碳元素化合价升高为+4价,再根据得失电子守恒得:

根据元素守恒,补H2O可得:
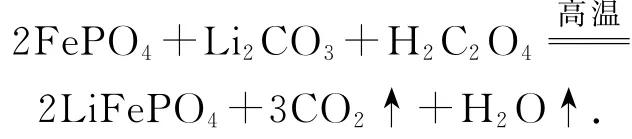
2 归纳方程式书写的解题模型
研究表明,学生在解决化学问题时使用频率最高的解题策略是模型匹配,即学生通过有限的思维过程找到与当前问题相匹配的模型而解决问题的.因此,对于陌生氧化还原反应方程式的书写,首先要根据题目情境和元素化合价升降,有效解读题给信息或根据氧化还原反应规律确定氧化剂、还原剂、氧化产物、还原产物,初步建立反应框架;其次根据得失电子守恒规律配平上述4种物质;再次根据所给信息,明确体系环境,依据电荷守恒原则补充离子(一般情况下,酸性溶液补充H+,碱性溶液补充OH-);最后通过在反应方程式两端添加H2O(或其他小分子)使方程式两端的原子守恒,得到最终的方程式.

图4
例2KMnO4能与热的经硫酸酸化的Na2C2O4反应,生成Mn2+和CO2,该反应的化学方程式是
第1步:依题意锰元素的化合价降低,故KMnO4是氧化剂,Mn2+是还原产物;碳元素的化合价升高,故Na2C2O4(碳元素化合价为+3价)是还原剂,CO2是氧化产物.
第2步:按“氧化剂+还原剂→还原产物+氧化产物”把离子方程式初步写成MnO-4+C2O2-4→Mn2++CO2↑.由锰元素降了5价,1 molMnO-4得到5mole-;碳元素升了1价,1 molC2O2-4共失去2mole-,故在C2O2-4前配5,在氧化产物CO2前配10;在MnO-4前配2,在还原产物Mn2+前配2,即2MnO-4+5C2O2-4→2Mn2++10CO2↑.
第3步:反应在硫酸中进行,依据电荷守恒,故在左边补充16H+,在右边补充H2O,即2MnO-4+5C2O2-4+16H+→2Mn2++10CO2↑+□H2O.
第4步:依据H、O元素质量守恒配平:2MnO-4+5C2O2-4+16H+△══2Mn2++10CO2↑+8H2O.
3 遵循三大守恒规律
配平化学反应方程式的方法和技巧很多,但归根到底,始终都是围绕三大守恒规律进行.
例3(2018年全国卷Ⅰ)Na2S2O5可用作食品的抗氧化剂.在测定某葡萄酒中Na2S2O5残留量时,取50.00mL葡萄酒样品,用0.01000 mol·L-1的碘标准液滴定至终点,消耗10.00 mL.滴定反应的离子方程式为
首先由得失电子守恒(化合价升降相等)配平氧化剂、还原剂、氧化产物、还原产物的化学计量数其次依据电荷守恒和反应环境(如酸碱介质)确定添加H+:最后借助质量守恒(元素守恒)加H2O完成配平:

信息型氧化还原方程式书写已成为当下高考命题的热点,它体现了“证据推理”这一核心素养的运用和落实,有利于培养学生基于信息,对物质的变化作出合理推断的思维能力,建立观点、论据和结论之间的逻辑关系.因此,在高考备考复习中,教师应适时引导学生加深对元素化合物知识的认识,突出模型构建和证据推理等核心素养的培养,增强学生在特定的任务或情境中解决问题的关键能力或品质.

