A型肉毒毒素对兔肌腱成纤维细胞抑制作用的实验研究
许良 王楠 曾林如
[摘要] 目的 探讨A型肉毒毒素在体外动物实验中对兔趾伸肌腱成纤维细胞的增殖活性的抑制作用,以及对相关细胞因子TGF-β1和bFGF表达的影响。 方法 体外分离兔趾伸肌腱,培养肌腱成纤维细胞,采取CCK8实验检测A型肉毒毒素在不同浓度条件下对成纤维细胞活性的影响。ELISA试剂检测肌腱成纤维细胞中TGF-β1和bFGF的表达含量。 结果 与对照组相比,不同浓度的A型肉毒毒素对肌腱成纤维细胞的增殖活性有不同程度的抑制作用,在30 U/mL浓度时,抑制作用较低浓度10 U/mL和高浓度50 U/mL更为明显。采用ELISA实验检测标本中TGF-β1和bFGF的表达含量。在三种A型肉毒毒素浓度条件下(10 U/mL、30 U/mL、50 U/mL),实验组中TGF-β1的表达浓度均低于对照组。在浓度为30 U/mL时,浓度降低最为明显(P<0.05)。而实验组中bFGF的浓度均高于对照组,在浓度为30 U/mL时,浓度升高最为明显(P<0.05)。 结论 A型肉毒毒素能够明显抑制体外培养的兔肌腱成纤维细胞的增殖活性,降低TGF-β1 的表达水平,提高 bFGF的表达水平,在适合的浓度下,作用强度达到高峰,改善肌腱粘连症状。
[关键词] A型肉毒毒素;肌腱粘连;成纤维细胞;动物实验;TGF-β1;bFGF
[中图分类号] R62 [文献标识码] A [文章编号] 1673-9701(2020)24-0028-03
[Abstract] Objective To investigate the inhibitory effect of botulinum toxin type A on the proliferative activity of rabbit extensor tendon fibroblasts in vitro and the effect on related cytokines TGF-β1 and bFGF. Methods Rabbit extensor tendon was isolated in vitro, and tendon fibroblasts were cultured. CCK8 assay was used to detect the effect of botulinum toxin type A on fibroblast activity under different concentrations. ELISA reagent was used to detect the expression levels of TGF-β1 and bFGF in tendon fibroblasts. Results Compared with those of the control group, different concentrations of botulinum toxin type A had different inhibitory effects on the proliferation of tendon fibroblasts. The inhibitory effect at 30 U/mL was more obvious than that at 10 U/mL and at 50 U/mL. The expression levels of TGF-β1 and bFGF in the specimens were determined by ELISA. Under the three concentrations of botulinum toxin type A (10 U/mL, 30 U/mL,50 U/mL), the expression concentration of TGF-β1 in the experimental group was lower than that in the control group. At the concentration of 30 U/mL, the concentration decrease was the most significant(P<0.05). The concentration of bFGF in the experimental group was higher than that in the control group, and the concentration was the highest at the concentration of 30 U/mL(P<0.05). Conclusion Botulinum toxin type A can significantly inhibit the proliferative activity of rabbit tendon fibroblasts, reduce the expression of TGF-β1 and increase the expression of bFGF. At a suitable concentration, the intensity of action reaches a peak and it improves tendon adhesion symptom.
[Key words] Botulinum toxin type A;Tendon adhesion; Fibroblasts; Animal experiment; TGF-β1; bFGF
肌腱損伤术后发生的粘连,会严重影响关节功能的恢复[1]。如何缓解或防止肌腱及腱周组织粘连,尽早恢复其生理功能,同时又不影响肌腱本身的愈合,成为临床及科研研究的焦点。一方面需要提高肌腱缝合的操作技术[2],另一方面,需要局部用药抑制肌腱成纤维细胞的生长,减少瘢痕的产生,避免肌腱粘连[3]。
A型肉毒毒素最早在美容整形科被广泛应用,因其微创、高效、安全而备受青睐[4]。随着研究的不断深入,A型肉毒毒素被拓展应用于修复各种皮肤缺损,抑制皮肤瘢痕增生,并取得了理想的效果。A型肉毒毒素局部注射能使瘢痕变软变平,瘢痕增生明显改善[5]。在细胞体外实验中,发现A型肉毒毒素能抑制成纤维细胞的生长和增殖,减弱局部成纤维细胞胶原蛋白的合成能力,有效缓解瘢痕生长[6]。本研究旨在进一步揭示A型肉毒毒素预防肌腱粘连的作用,扩大其治疗范围,为临床药物防治肌腱粘连提供新方案,现报道如下。
1 材料与方法
1.1 材料来源
5只新西兰兔,体重3~3.5 kg,雌性,由浙江大学动物实验中心提供,动物生产许可证号:SCXK(沪)2010-0028。在清洁环境中适应性饲养1周。注射用A型肉毒毒素(衡力BTX-A,100 U/支,国药准字3109 70037),TGF-β1和bFGF的ELISA检测试剂盒(杭州沃森生物科技有限公司),胎牛血清、0.25%胰蛋白酶、DMEM培养液、磷酸盐缓冲液、四甲基偶氮唑盐等、电热恒温水浴槽、电子天平、台式离心机、全自动酶标仪、倒置相差显微镜等。
1.2 方法
培养兔肌腱成纤维细胞,切取兔四肢趾伸肌腱,置于0.25%胰酶,4℃环境下24 h,打碎组织,加入0.25%Ⅰ型胶原酶,37℃环境孵育1 h,收集悬液,1000 rpm离心5 min,加入DMEM培养液,调整细胞密度至5×105/mL。在37℃、5%CO2条件下培养,每48小时换置培养液一次,细胞融合80%进行接种。实验选用第4代至第5代细胞。
按照A型肉毒毒素浓度分为四组:对照组(0 U/mL)、10 U/mL组、30 U/mL组、50 U/mL组。取A型肉毒毒素(100 U/支),每组样本份数20例,加入2 mL DMEM/F-12稀释为50 U/mL后,按梯度稀释至浓度30 U/mL、10 U/mL。取兔肌腱成纤维细胞,1000 rpm离心5 min,重悬稀释于细胞计数板下计数,铺96孔板,每孔5000个细胞,每组6个复孔,48 h后弃上清,每孔加入200 μL 10% 的CCK8检测液,37℃避光反应1 h,450 nm处读取各孔OD值。计算各组细胞的增殖活力,计算公式:细胞活力*(%)=[A(加药)-A(空白)]/[A(0加药)-A(空白)]×100%。采用兔TGF-β1和bFGF的ELISA试剂盒检测兔肌腱成纤维细胞在不同浓度的A型肉毒毒素条件下,培养48 h后培养基上清液中TGF-β1和bFGF的表达水平。
1.3 统计学分析
采用SPSS17.0统计学软件分析,计量资料以均数±标准差(x±s)表示,组内比较采用配对样本t检验,多组间比较采用单因素方差分析(One-way ANOVA),两两组间比较采用Tukey HSD方法。计数资料采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 兔肌腱成纤维细胞的形态学观察
细胞贴壁生长良好,细胞界限清楚,胞体饱满,排列较为紧密,大多呈现放射状走形,见封三图1。
2.2 A型肉毒毒素对肌腱成纤维细胞活性的影响
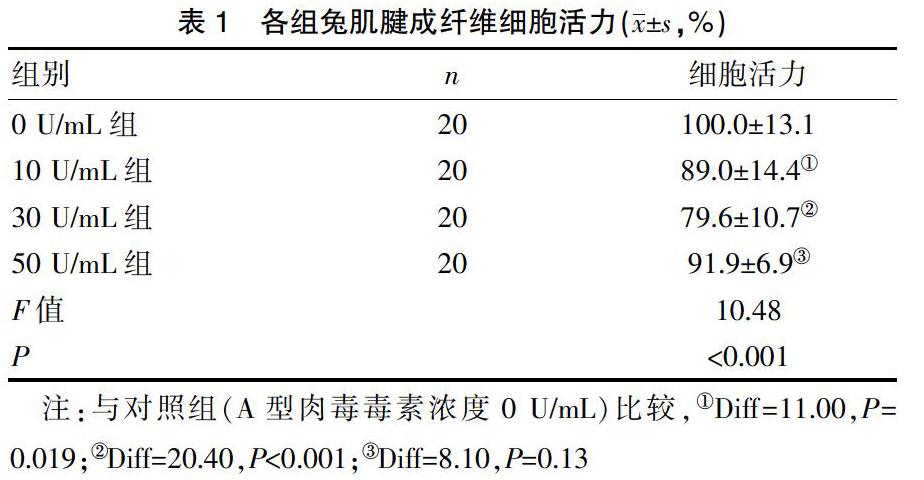
在4种浓度的A型肉毒毒素作用下,CCK8检测盒检测细胞活力,肌腱成纤维细胞的吸光度(OD)值随着浓度的增加而下降。30 U/mL组对细胞增殖活性的抑制效果最显著。A型肉毒毒素浓度为10 U/mL、30 U/mL、50 U/mL时,检测兔肌腱成纤维细胞的吸光度(OD)值,计算各组的细胞活力分别为(89.0±14.4)、(79.6±10.7)、(91.9±6.9),均低于对照组的(100.0±13.1),差异有统计学意义(P<0.05),浓度为30 U/mL时,差异最为明显,对细胞活力的抑制作用最强。见表1。
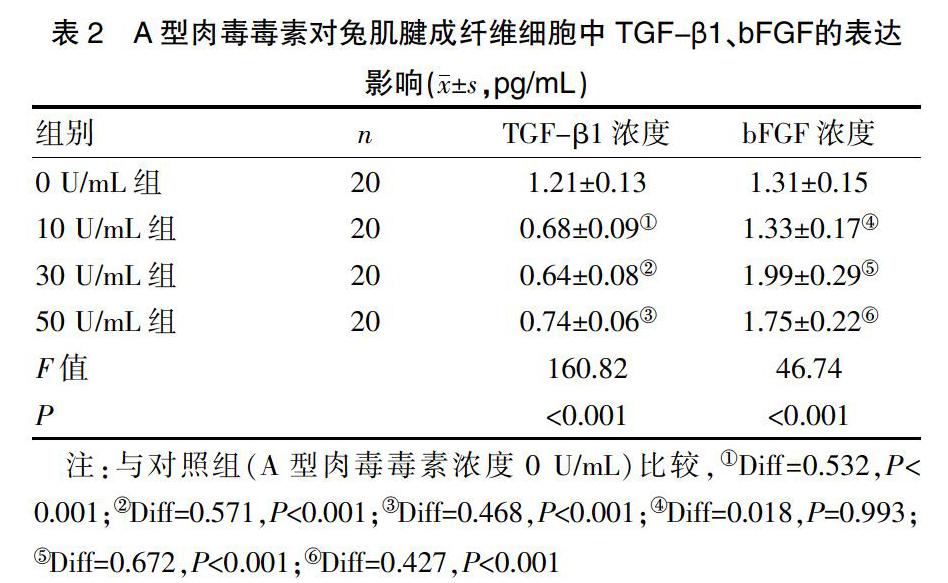
2.3 A型肉毒毒素对兔肌腱成纤维细胞中TGF-β1和bFGF表达的影响
在A型肉毒毒素作用下,成纤维细胞中的TGF-β1的表达呈现不同程度的抑制作用。30 U/mL组抑制作用最明显,而成纤维细胞中的bFGF的表达呈增加趋势,差异有统计学意义(P<0.05)。见表2。
3 讨论
外伤引起肌腱损伤在临床工作中较为常见。尽管不断改进肌腱修复技术,肌腱粘连仍作为最常见的并发症严重影响创伤后肌腱的功能康复[7]。肌腱粘连与肌腱愈合有着重要联系,肌腱在修复愈合过程中形成粘连的原因包括:①外源性愈合,因成纤维细胞在肌腱断端大量生长,造成肌腱与周围组织紧密粘连,影响肌腱滑动[8],这是粘连形成的主要因素;②由于炎性反应导致周围组织渗出增多,机化后粘连;③肌腱细胞自身增殖过程中与周围组织形成粘连[9]。所以本实验通过抑制肌腱的外源性愈合,减少肌腱成纤维细胞的大量增殖,以此来缓解肌腱粘连的症状,防治肌腱粘连。
肌腱在愈合的过程中,周围组织会释放各种细胞生长因子参与创伤修复,主要包括成纤维细胞转化生长因子β1(TGF-β1)、碱性成纤维细胞生长因子(bFGF)、基质金属蛋白酶-2(MMP-2)、基质金属蛋白酶-9(MMP-9)等[10]。研究发现TGF-β1通过对TGFβ/Smads信号通路的干扰,来抑制肌腱成纤维细胞转化,一定程度上阻断肌腱粘连的产生途径,在创伤后的肌腱粘连中作用显著[11]。有实验研究通过检测增生性瘢痕组织及皮肤组织中的TGF-β1表达水平,大样本统计对比发现TGF-β1 在瘢痕组织中的表达水平显著高于皮肤组织[12]。而生长因子bFGF的作用却不同,研究显示,能有效促进鞘管内肌腱的愈合,并且抑制鞘管内组织的粘连,缓解局部组织炎性反应。Oryan A等[13]造模兔屈肌腱损伤模型,通过局部注射bFGF,发现其能一定程度上调节炎症反应,抑制腱周组织增生粘连,增加断端胶原分泌,改善肌腱纤维的排列方式,调整組织损伤后的结构和生物力学性能。盛加根等[14]细胞实验发现,局部使用bFGF及5-氟尿嘧啶在有效促进鸡屈肌腱愈合的同时能减轻肌腱粘连。因此,细胞生长因子TGF-β1和bFGF作为监测肌腱粘连的重要参考指标,参与肌腱外源性愈合中瘢痕组织的形成机制,而被临床医师及科研工作者关注。在药物防治肌腱粘连的攻坚战中,治疗方案各有不同。Tan V等[15]通过使用COX1和COX2抑制剂布洛芬,抑制局部炎性反应,防止肌腱修复后粘连的形成。Xia C等[16]利用6-磷酸果糖抑制TGF-β1和Ⅰ型胶原RNA的表达,有效防止粘连产生,同时对肌腱愈合无明显影响。随着研究的深入,各种方法的临床应用较为局限,肌腱粘连仍未得到有效解决。
A型肉毒毒素临床主要应用于皱纹的治疗[17],临床神经药理毒理作用研究较为丰富。随着研究的深入,治疗范围逐渐扩大,用于治疗皮肤大量瘢痕增生[18],且对缓解烧伤后的组织瘢痕化效果明显。于波等[19]在瘢痕局部注射A型肉毒毒素,有效减轻了患者早期瘙痒和轻度疼痛的症状,软化皮肤瘢痕组织。同时,发现A型肉毒毒素可促进体外培养的瘢痕成纤维细胞的凋亡[20]。彭旦生[21]建立兔耳缘皮肤瘢痕模型,发现A型肉毒毒素缓解兔耳瘢痕增生,抑制局部挛缩的作用,是通过抑制成纤维细胞增殖或促进其凋亡,减少局部胶原的合成来实现的。
本研究发现在体外培养环境中,A型肉毒毒素对肌腱成纤维细胞的增殖活力会产生不同程度的抑制作用。在对照组中,兔肌腱成纤维细胞生长旺盛。当A型肉毒毒素浓度为10 U/mL、30 U/mL、50 U/mL时,成纤维细胞镜下观察,发现数目减少、胞体减小、形态不典型、增殖活力减弱,在30 U/mL浓度时,增殖活力抑制最为明显。采用ELISA实验测定各组标本TGF-β1和bFGF表达含量。在三种A型肉毒毒素浓度条件下(10 U/mL、30 U/mL、50 U/mL),肌腱成纤维细胞中TGF-β1的浓度分别为0.68 pg/mL、0.64 pg/mL、0.74 pg/mL,均低于对照组浓度1.21 pg/mL(P<0.05)。在浓度为30 U/mL时,抑制作用最为明显。肌腱成纤维细胞中bFGF的浓度分别为1.33 pg/mL、1.99 pg/mL、1.75 pg/mL,均高于对照组浓度1.31 pg/mL(P<0.05)。在浓度为30 U/mL时,促进作用最为明显。由本研究可知,A型肉毒毒素可在一定程度上降低肌腱成纤维细胞TGF-β1的表达水平,从而抑制I型胶原、纤维结合素及α-SMA的表达,减少了肌腱成纤维细胞向瘢痕组织的转化,避免肌腱周围瘢痕组织增生。同时,A型肉毒毒素能上调bFGF的表达水平,增加胶原蛋白的分泌,防止过量的细胞外基质沉积,改善肌腱纤维的聚合和排列方式,抑制肌腱的粘连。A型肉毒毒素的作用效果并非随着浓度的增加而递增,在本研究中,当浓度为30 U/mL时,效果最为显著,能有效抑制成纤维细胞的增生而缓解肌腱粘连。
[参考文献]
[1] 陈思凯,王楠,曾林如. 术后肌腱粘连的防治研究现状与进展[J]. 浙江中西医结合杂志,2016,26(10):967-969.
[2] 胡燕青,蒋海,李棋,等. 不同肌腱缝合方法的生物力学比较研究[J]. 中国修复重建外科杂志,2017,31(10):1208-1213.
[3] 穆卫强,黄毛毛,淦常勤,等. 肌腱修复术后肌腱粘连防治的研究现状[J]. 创伤外科杂志,2015,17(5):470-472.
[4] 沈明康,郑红,马文英. A 型肉毒毒素在面部除皱中的临床应用[J]. 中国医疗美容,2017,7(6):40-41.
[5] 杨艳清,张洁,许其军. A型肉毒毒素对人瘢痕疙瘩成纤维细胞凋亡影响的实验研究[J]. 中国美容医学,2017, 26(9):43-45.
[6] 颜彤彤,陈敏亮,马奎,等. A型肉毒毒素治疗挛缩性瘢痕[J]. 中华医学美学美容杂志,2013,19(3):196-199.
[7] 白江博,赵红芳,高瑞姣,等. 新鲜羊膜与脱细胞羊膜修复腱鞘缺损预防肌腱粘连[J]. 中国组织工程研究,2017,21(30):4842-4846.
[8] 白江博,赵红芳,张冰,等. 冻干羊膜重建腱鞘缺损对肌腱愈合的早期生物力学影响[J]. 河北医科大学学报,2018,39(1):34-38.
[9] 姜士超,刘珅,范存义. 肌腱粘连机制及预防的研究进展[J]. 中国修复重建外科杂志,2013,27(5):633-636.
[10] 耿震,王宸. 细胞生长因子对肌腱愈合的影响[J]. 中国修复重建外科杂志,2014,24(2):239-242.
[11] 姜大朋,李昭铸,张玉波,等. TGF-β1对腱鞘成纤维细胞a-SMA及细胞外基质合成的影响[J].中国矫形外科杂志,2010,18(9):759-761.
[12] 庞久玲,刘爱东,刘军. 转化生长因子β1 和基质金属蛋白酶在病理性瘢痕中的表达及意义[J].实用医学杂志,2010,26(17):3175-3177.
[13] Oryan A,Moshiri A. Recombinant fibroblast growth protein enhances healing ability of experimentally induced tendon injury in vivo[J]. J Tissue Eng Regen Med,2014, 8(6):421-431.
[14] 盛加根,曾炳芳,姜佩珠,等. 局部单次使用bFGF及5-氟尿嘧啶促进屈肌腱愈合和防止粘连形成的实验研究[J]. 中国修复重建外科杂志,2011,25(6):711-717.
[15] Tan V,Nourbakhsh A,Capo J,et al. Effects of nonsteroidal anti-in-ammatory drugs on flexor tendon adhesion[J]. J Hand Surg(Am),2010,35(6):941-947.
[16] Xia C,Zuo J,Wang C,et al. Tendon healing in vivo:Effect of mannose-6-phosphate on flexor tendon adhesion formation[J]. Orthopedics,2012,35(7):1056-1060.
[17] 王莉莉. A型肉毒毒素面部除皱的临床疗效观察[J]. 中国美容整形外科杂志,2015,26(6):337-338.
[18] 楊欣欣,吴信峰. A型肉毒毒素防治病理性瘢痕的研究进展[J]. 中国美容医学,2018,27(5):150-153.
[19] 于波,陈敏亮,刘文阁,等. A型肉毒毒素预防与治疗早期增生性瘢痕的临床研究[J]. 中华医学美学美容杂志,2008,14(2):95-101.
[20] 王琳,邰宁正,范志宏. 肉毒毒素A对大鼠皮肤及创面组织中SP、CGRP、TGF-β1和α-SMA的影响[J]. 中华整形外科杂志,2009,25(1):50-53.
[21] 彭旦生. A型肉毒毒素对兔耳瘢痕挛缩的抑制效应[D].重庆:重庆医科大学,2010.
(收稿日期:2019-07-16)

