微小RNA-22在食管癌患者血清中的表达与临床意义
胡立华 张鉴颖 陈鹏
[摘要] 目的 探討微小RNA-22在食管癌患者血清中的异常表达及其临床意义。 方法 45例食管癌患者血清标本均来自黑龙江省医院2018年1月~2019年3月的门诊及住院患者,均经病理证实。采血前患者均未接受放射治疗和化学药物治疗。45名健康对照者血清标本均来自健康体检者。采用实时定量PCR(Real-time PCR,RT-PCR)法检测食管癌患者和健康对照者血清中miRNA-22的表达水平。分析食管癌患者和健康对照者血清中的miRNA-22表达情况及食管癌患者血清miRNA-22表达水平与食管癌临床病理特征之间的关系。 结果 86.67%(39/45)的食管癌患者血清中miRNA-22相对表达量明显低于健康对照者,差异有统计学意义(P<0.05)。T3、T4期患者血清中miRNA-22低表达率为93.3%(28/30),显著高于T1、T2期患者的73.3%(11/15),差异有统计学意义(P<0.05);且T分期越高,miRNA-22表达量越低,呈负相关关系(r=-0.523,P<0.05);有淋巴结转移者低表达率为96.0%(24/25),显著高于无淋巴结转移者的75.0%(15/20),差异有明显统计学意义(P<0.05);而与患者的性别、年龄及肿瘤分化程度无明显相关性(P>0.05)。 结论 miRNA-22在食管癌患者血清中的表达下调,且与食管癌的临床病理特征密切相关。
[关键词] 微小RNA-22;食管癌;血清;TNM分期
[中图分类号] R73 [文献标识码] A [文章编号] 1673-9701(2020)24-0013-04
[Abstract] Objective To investigate the abnormal expression of miRNA-22 in serum of patients with esophageal cancer and its clinical significance. Methods A total number of 45 serum samples were all collected from outpatients and inpatients with esophageal cancer who were treated in Heilongjiang Provincial Hospital from January 2018 to March 2019. All were confirmed by pathology. None of the patients were treated with radiotherapy and chemotherapy before blood collection. The serum samples of 45 healthy controls were all collected from healthy examinees. Real-time PCR(RT-PCR) method was used to detect the expression level of miRNA-22 in serum of patients with esophageal cancer and healthy controls. The expression of miRNA-22 in serum of patients with esophageal cancer and healthy controls, and the relationship between the expression level of serum miRNA-22 in patients with esophageal cancer and clinicopathological features of esophageal cancer were analyzed. Results The relative expression level of miRNA-22 in serums of 86.67%(39/45) of patients with esophageal cancer were significantly lower than those of healthy controls, with statistically significant differences(P<0.05). The low expression rate of miRNA-22 in serum of patients with T3 and T4 esophageal cancer was significantly higher than that of patients with T1 and T2 esophageal cancer, which was 93.3%(28/30) and 73.3%(11/15), respectively, with statistically significant difference(P<0.05). A negative correlation was found as the higher the T stage, the lower the expression level of miRNA-22(r=-0.523, P<0.05). The low expression rate of patients with lymph node metastasis was significantly higher than that of patients without lymph node metastasis, which was 96.0%(24/25) and 75.0%(15/20), respectively, with statistically significant difference(P<0.05). However, no significant correlations with gender, age and tumor differentiation of the patients were found(P>0.05). Conclusion The expression of miRNA-22 in serum of patients with esophageal cancer is down-regulated and is closely related to the clinicopathological features of esophageal cancer.
[Key words] miRNA-22; Esophageal cancer; Serum; TNM staging
食管癌是常见的恶性肿瘤[1]。由于其早期缺乏特异性临床表现,临床上确诊的食管癌患者多为中、晚期,5年生存率在10%左右。因此寻找敏感而特异的肿瘤标记物及早期诊断,对降低食管癌患者的病死率非常重要。近来研究发现,微小核糖核酸(micro-RNA,miRNA)与肿瘤密切相关,是一种新的肿瘤标志物。miRNA不仅在肿瘤组织、细胞中异常表达,在肿瘤患者血清中也有特征性的表达谱,特定的血清miRNA表达谱对肿瘤的诊断、分类、治疗以及预后均有重要的价值[2]。本研究通过检测微小核糖核酸-22(micro-RNA-22,miRNA-22)在食管癌患者及健康对照者血清中的表达,为探讨miRNA-22在食管癌中的生物学功能及与肿瘤的关系提供实验依据,现报道如下。
1 资料与方法
1.1 一般资料
45例食管癌患者血清标本均来自黑龙江省医院2018年1月~2019年3月的门诊及住院患者,其中男28例,女17例;年龄39~77岁,平均(58.6±3.1)岁。纳入标准[3]:(1)胃镜下活检病理证实食管鳞状细胞癌者;(2)采血前均未接受放疗、化疗、生物治疗等任何治疗者;(3)患者及其家属知情并且积极配合参与本项目。排除标准[4]:(1)合并其他肿瘤者。(2)伴随其他严重慢性疾病者。临床分期按国际抗癌联盟(UICC)第7版TNM标准分期:Ⅰ期/Ⅱ期15例,Ⅲ期/Ⅳ期30例;病理分级:高、中分化癌19例,低分化癌26例;有淋巴结转移者25例,无淋巴结转移者20例。45名健康对照者血清标本均来自健康体检者。本研究经医院伦理委员会批准,所有标本均获患者知情同意。
1.2 方法
用无菌注射器抽取食管癌患者及健康对照者静脉血5 mL,常温放置30 min,1500×g离心7 min,吸取上层血清转入另一无菌离心管,800×g离心l0 min,取上清。待检血清在-80℃保存备用。按Trizol试剂盒说明书操作,提取血清总RNA。1%琼脂糖凝胶电泳,紫外分光光度仪检RNA溶液,测A260/A280比值,计算RNA浓度和纯度,取A260/A280比值在1.8~2.1者用于进一步实验检测。取2 μg总RNA进行反转录,反应条件为:16℃ 30 min,42℃ 45 min,85℃ 5 min。实时定量PCR(Real-time PCR,RT-PCR)检测miRNA-22,miRNA-22PCR扩增,上游引物:5'-AAGCTGCCA-GTTGAAGAACTGTA-3',下游引物:5'-CTCGCTTC-GGCAGCACA-3'。反应条件:95℃ 10 min,95℃ 15 s,60℃ 1 min,40个循环。实验反复3次,同时选取U6 snRNA为内参照。U6内参照上游引物:5'GCTTCGGCAGCACATATACTAAAAT3',下游引物:5'CGCTTC-ACGAATTTGCGTGTCAT3'。RT-PCR结果以Ct值表示,用2-ΔΔCt比较各样品间miRNA-22的表达水平差异。
1.3 观察指标
比较食管癌组与健康对照组血清miRNA-22的水平变化及食管癌组miRNA-22水平与临床病理特征的关系。
1.4 统计学方法
采用SPSS22.0统计学软件对数据进行处理分析,计量资料组间比较采用t检验,计数资料采用χ2检验,Pearson法进行相关性分析,P<0.05为差异有统计学意义。
2 结果
2.1 食管癌患者及健康对照者血清中miRNA-22的表达
对45例食管癌患者和45名健康对照者血清标本中miRNA-22的表达进行检测。结果表明:86.67%(39/45)的食管癌患者血清中miRNA-22相对表达量明显低于健康对照者,差异有统计学意义(χ2=70.352,P<0.05)。
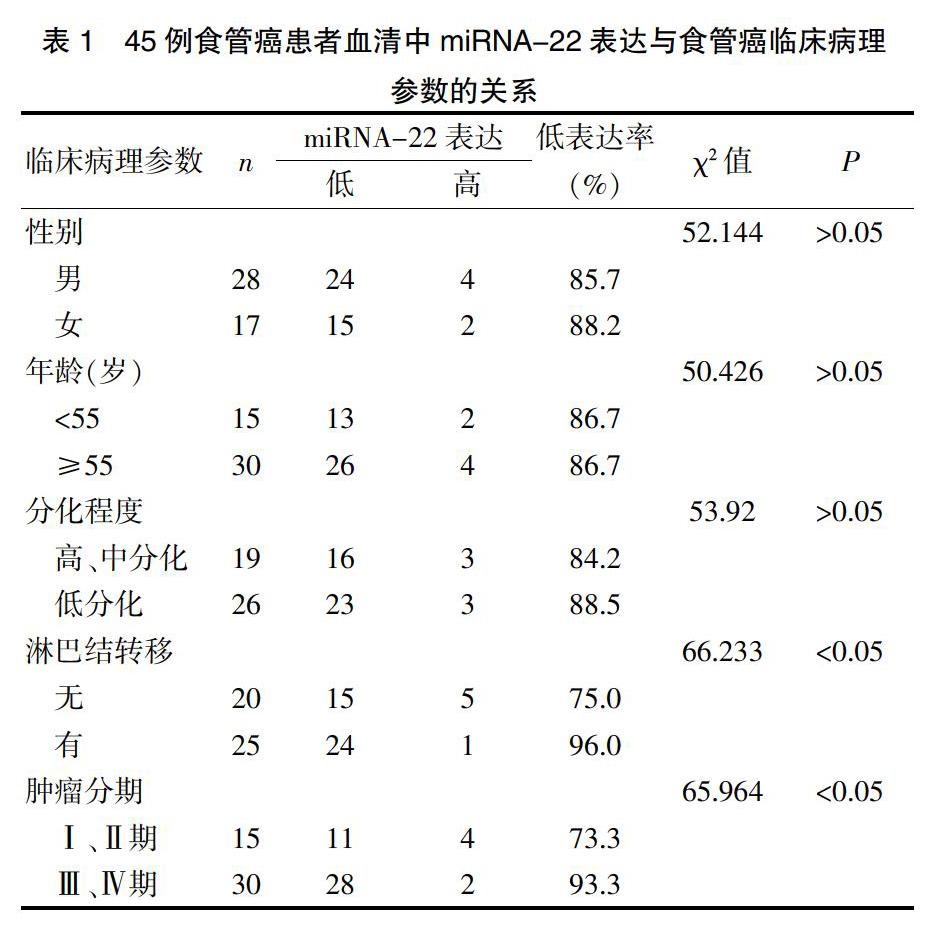
2.2 食管癌患者血清中miRNA-22的表达与临床病理参数间的关系
以食管癌患者血清中miRNA-22表达量的中位数为分界点,将食管癌患者分为低表达组和高表达组[5],分析各组与临床病理参数之间的关系(表1)。结果表明:T3、T4期食管癌患者血清中miRNA-22低表达率为93.3%(28/30),显著高于T1、T2期食管癌患者的73.3%(11/15),差异有统计学意义(χ2=65.964,P<0.05);且T分期越高,miRNA-22表达量越低,呈负相关关系(r=-0.523,P<0.05);有淋巴结转移者低表达率为96.0%(24/25),显著高于无淋巴结转移者的75.0%(15/20),差异有明显统计学意义(χ2=66.233,P<0.05);而miRNA-22的低表达率与患者的性别、年龄及肿瘤分化程度无明显相关性(P>0.05)。见表1。
3 讨论
Lee RC等[6]于1993年发现了一个22个碱基的小分子RNA-lin-4,其不能编码蛋白质,但却能抑制蛋白质翻译,抑制蛋白质合成。随后科学家们发现了大量具有类似调控基因功能的小分子非编码RNA,被称为微小核糖核酸(microRNA,miRNA)。2004年Calin GA等[7]发现,在肿瘤细胞与正常细胞之间,miRNA表达谱明显不同,约50%miRNA基因组定位于肿瘤相关的基因脆性位点上,多数可抑制肿瘤细胞的表达。既往研究表明:微小核糖核酸-22(micro-RNA-22,miRNA-22)在食管癌组织及细胞中的表达下调并与食管癌的临床病理特征密切相关[8,9]。因为利用手术切除的标本进行分子生物学方面的检测有一定的局限性,如标本来源的限制、无法连续检测及随访等,所以肿瘤患者外周血中循环miRNA的检测成为关注的热点。2008年Lawrie CH等[10]发现在弥漫性B细胞淋巴瘤患者的血清中miRNA-21表达水平很高,并證实其与无复发存活率增高密切相关。miRNA-21成为第一个血清miRNA标志物,从此开启了对血清中游离miRNA的研究。血清中游离miRNA的检测具有损伤小、稳定性良好、灵敏度高等优点,可能成为新的肿瘤标记物。如能将其应用于临床,可显著提高肿瘤检出率,促进肿瘤诊断学和治疗学的进展。
miRNA在食管癌中的研究,主要集中在組织和细胞中。聂龙等[11]研究发现在食管癌组织中miRNA-155的相对表达降低,可能抑制了机体抗癌作用,从而促进食管癌的发生与发展。蒋庆锋等[12]研究指出食管癌组织中miRNA-802表达下调,并通过调控靶基因RAB23的表达参与食管癌的发生、发展。孟雪梅等[13]采用实时荧光定量PCR法检测食管癌及其相应癌旁组织中miRNA -1299的表达水平,结果表明:miRNA-1299在食管癌组织中的表达水平明显低于相应的癌旁组织且与食管癌患者的临床分期具有相关性。符佳等[14]的研究显示:miRNA-127-3p在食管鳞状细胞癌组织及细胞中的表达均明显低于癌旁正常组织及正常食管细胞。李彦桦等[15]采用qRT-PCR法证实在食管鳞癌组织中miRNA-320a低表达,而miRNA-181a-5p高表达,且其靶基因均为TGF-β1。目前,国内一些学者已经开始研究血清中游离miRNA的表达情况。谢子钧等[4]研究表明食管癌患者血清中miRNA-10b的表达水平显著低于健康体检者。杨艳等[16]研究结果表明:食管癌患者血清中miRNA-451的表达水平明显高于健康对照者,且miRNA-451的表达水平与食管癌患者的临床分期和淋巴结转移有关。而马箐等[3]研究表明:在食管鳞癌患者血清中miRNA-320c高表达,但与肿瘤TNM分期及肿瘤病理分化程度无明显相关性。
本研究通过实时定量PCR法检测45例食管癌患者及45名健康对照者血清中miRNA-22的表达情况,并对患者临床病理参数进行对比,结果表明:食管癌患者血清中miRNA-22相对表达量明显低于健康对照者(χ2=70.352,P<0.05),这一结果与既往研究miRNA-22在食管癌组织及细胞中的表达下调相符[8,9],提示miRNA-22在食管癌发生中具有抑癌基因的作用,血清miRNA-22可作为食管癌诊断的分子标志物。本研究还发现,食管癌患者血清中miRNA-22低表达与患者淋巴结转移和高TNM分期(Ⅲ+Ⅳ)间具有明显的相关性(P<0.05),且T分期越高,miRNA-22表达量越低,呈负相关关系(r=-0.523,P<0.05),提示miRNA-22的表达水平可以作为评价食管癌TNM分期和淋巴结转移的一个辅助的评价指标,对患者预后评估有一定的参考价值。
研究表明,miRNA-22在胃癌组织中的表达下调,且其过表达可通过转录因子Sp1抑制肿瘤的浸润和转移[17]。miRNA-22在食管癌中的过表达是否可抑制其浸润和转移及其作用的机制需要进一步研究。另外,食管良性肿瘤、Barrett食管及食管腺癌患者血清中miRNA-22的表达水平及食管癌患者血清中miRNA-22的表达水平与放化疗敏感性之间的关系亦有待下一步开展。
综上所述,miRNA-22在食管癌患者血清中的低表达与食管癌的发生、浸润和转移密切相关,可能成为食管癌诊断及治疗的新的分子生物学标志。
[参考文献]
[1] 刘巧艳,王进海. 相关肿瘤标志物联合检测在食管癌中的诊断价值[J]. 中国肿瘤临床与康复,2019,26(12):1482-1485.
[2] 胡凤蓉,帖君,胡思隽,等. 微小核糖核酸一25在胃癌患者血清中的异常表达及其临床意义[J]. 中华消化杂志,2011,31(6):392-395.
[3] 马箐,丁元杰,马山蕊,等. 血清MicroRNA-320c表达对食管鳞癌的诊断价值及临床意义[J]. 肿瘤预防与治疗,2018,31(2):84-91.
[4] 谢子钧,陈刚,黄健,等. 血浆miR-10b 对食管癌的诊断价值[J]. 广东医学,2013,34(16):2465-2468.
[5] 朱宏达,马尘超,艾开兴. 微小RNA-214在胰腺癌中的表达及临床意义研究[J]. 中国癌症杂志,2014,24(8):594-598.
[6] Lee RC,Feinbaum RL,Ambros V,et a1.The C.elegans heterochronic gene lin-4 encodes small RNAs with antisense comple—mentaritytolin-14[J]. Cell,1993,75(5):843-854.
[7] Calin GA,Sevgnani C,Dumitu CD,et al. Human microRNA genes are fequently located at fragile sites and genomic regions involved in caccers[J]. Proc Natl Acad Sci USA,2004,101(9):2999-3004.
[8] 胡立华,陈鹏,常英娟,等. 微小RNA-22在食管癌中的表达及临床意义[J]. 中国现代医生,2016,54(16):21-23.
[9] 胡立华,陈鹏,张鉴颖,等. 微小RNA-22在食管癌和胃癌细胞及组织中的表达[J]. 中国基层医药,2016,23(22):3404-3407.
[10] Lawrie CH,Gal S,Dunlop HM,et a1. Detection of elevated levels of tumour—associated microRNAs in serum of patients with difuse large B—cell lymphoma[J]. Br J Haematol,2008,141(5):672-675.
[11] 聂龙,周方正,童琳,等. miRNA-155 在食管癌中的表达及与其临床病理特征的关系[J].实用癌症杂志,2018,33(6):878-880.
[12] 蒋庆锋,程金华,申思宁,等. miR-802和RAB23 在食管鳞癌中的表达水平及临床意义[J]. 医学研究杂志,2019,48(5):170-175.
[13] 孟雪梅,刘思桦,常胜,等. miR-1299在食管癌中的表达及其对食管癌细胞迁移和侵袭的影响[J]. 肿瘤,2019,39(8):623-631.
[14] 符佳,汪砥,江金琼,等. 食管鳞状细胞癌患者microRNA-127-3p 的表达水平及临床意义[J]. 中国现代医学杂志,2019,29(20):28-33.
[15] 李彦桦,李雨珊,张仁静,等. 微小RNA-181a-5p、320a及其靶基因TGF-β1在食管鳞癌中的表达[J]. 肿瘤预防与治疗,2019,32(5):395-401.
[16] 杨艳,杜云翔,张闯,等. microRNA-451在食管癌患者血清中的表达和疗效评估中的作用[J]. 新疆医科大学学报,2017,40(6):779-782.
[17] Guo MM,Hu LH,Wang YQ,et al. miR-22 is down-regulated in gastric cancer,and its overexpression inhibits cell migration and invasion via targeting transcription factor Sp1[J]. Med Oncol,2013,30(2):542-547.
(收稿日期:2020-06-03)

