嘉陵江上游唇鱼骨两性异形及其与年龄的关系研究
张富斌


摘 要:于2017年3—10月,在嘉陵江上游广元段共采集94尾唇鱼骨(Hemibarbus labeo),分析其两性异形现象。结果表明,嘉陵江上游唇鱼骨(H. labeo)存在两性异形现象,雌性个体较雄性个体大 (P<0.05)。对比同龄雌雄个体发现,唇鱼骨(H. labeo)雌性在头部和躯干部的形态性状比雄性更大,而尾部的差异相对不明显。单因素方差分析(One-way ANOVA)结果显示2龄雌雄个体间局部特征性状差异程度较3龄和4龄雌雄个体间差异程度小。主成分分析对2龄、3龄和4龄唇鱼骨(H. labeo)群体分别提取了2个、4个和2个主成分(Eigenvalue>1),累积贡献率分别为87.57%,85.55%和80.58%。通过5个特征性状(头长、头宽、体长、躯干距和背吻距)构建的判别函数,能够对唇鱼骨(H. labeo)雌雄个体进行较好的判别。
关键词:两性异形;唇鱼骨;主成分分析;嘉陵江
中图分类号:Q958.8 文献标识码:A DOI 编码:10.3969/j.issn.1006-6500.2020.07.006
Abstract: A total of 94 Hemibarbus labeo were collected during March to October, 2017, in upstream (Guangyuan section) of the Jialing River to analyze its sexual dimorphism phenomenon. Result indicated that a distinct sexual dimorphism was occurred to Hemibarbus labeo inhabited in upstream of the Jialing River. Data showed that female individuals were larger than male individuals(P<0.05). Morphology indices in head and trunk for female individuals were larger than male individuals in same age, while the difference in tail is relatively insignificant. One-way ANOVA analysis showed that the degree of difference in local characteristic traits between male and female individuals in age of two was samller than that in age of three and four. Principal component analysis extracted two, four, and two principal components(Eigenvalue>1) for the 2nd, 3rd, and 4th age populations of Hemibarbus labeo, which were in response for 87.57%, 85.55%, and 80.58% variations, respectively. Through the discriminant function constructed by 5 characteristic morphology indices (head length, head height, body length, trunk length, distance between dorsal fin and rhynchodaenm), the male and female individuals can be discriminated well.
Key words: sexual dimorphism; Hemibarbus labeo; principal component analysis; the Jialing River
兩性异形(Sexualdimorphism)是指同一种群内的雌雄个体间在外部形态、体色、或身体某些结构等方面存在差异[1-3],这种差异是动物对环境适应的表现,是动物界普遍存在的现象[4-6]。性选择、雌雄个体间食物竞争以及繁殖角色分化被认为是动物两性异形的主要原因[7]。研究结果表明,鱼类的两性异形多与生态适应有关,如棒花鱼(Abbottina rivularis),雌雄个体在生长过程中由于扮演的角色和承担的责任不同而出现显著的两性异形[8];似刺鳊鮈(Paracanthobrama guichenoti)雌性为了提高繁殖力,其个体通常大于同龄的雄性,此外,雌性个体的体高和腹鳍前距等比雄性个体大,以此来增加腹腔的体积,利于怀卵生殖[9]。诸多学者研究发现,两性异形大多与雌雄个体在繁殖过程中所受的性选择压力有关[10]。此外,可能还与栖息地环境有关[11]。另一方面,鱼类在不同生长阶段可能会表现出不同的形态特征和生活习性[12-13]。因此,研究不同年龄阶段鱼类两性异形将更有利于探讨鱼类对环境的适应机制。唇鱼骨(Hemibarbus labeo),隶属于鲤形目(Cyprini-
formes)、鲤科(Cyprinidae)、鱼骨属(Hemibarbus),广泛分布于我国各大江河与湖泊中[14]。唇鱼骨(H. labeo)营底栖生活,主要摄食水生无脊椎动物及软体动物,通常在2龄左右达性成熟,繁殖期集中在4—5月[15],且生长迅速,肉质鲜美。
嘉陵江,流域面积居长江众多支流之首,达16万km2[15]。嘉陵江上中下游生境异质性高,鱼类生物多样性高[16]。嘉陵江自上而下规划了16级梯级航电枢纽,但多集中于中下游区域[17],上游相对保持着自然流态,但也受到其他多方面的威胁,如挖沙采石,河道硬化等,对鱼类影响较大。近年来,由于栖息地破坏、水体污染、过度捕捞等多方面原因,导致嘉陵江唇鱼骨(H. labeo)的资源量在不断下降[18-19]。
基于此,本研究以嘉陵江上游唇鱼骨(H. labeo)为研究对象,分析唇鱼骨(H. labeo)两性异形,同时,探索唇鱼骨(H. labeo)两性异形与年龄之间的关系,以期了解唇鱼骨(H. labeo)对环境的适应机制,为唇鱼骨(H. labeo)资源保护提供必要的科学依据。
1 材料和方法
1.1 研究区域
本研究调查区域为嘉陵江广元江段(31°31′-32°56′N、104°36′-106°45′E)(图1)。广元属亚热带湿润季风气候,地处秦岭南麓,位于南北线的过渡地带。该地区年平均气温在16.1 ℃左右,年降雨量500~1 200 mm[20]。
1.2 样本采集和处理
于2017年3月至2017年10月(禁渔期按相关规定办理证件进行科研捕捞),逐月到广元段采集唇鱼骨(H. labeo)。样本采用定置刺网(50 m×1.5 m,网目:3 cm、5cm)和地笼采集。样品一旦采集后,立即浸泡在8%的福尔马林溶液中固定保存待用。
1.3 生物学性状测量
将唇鱼骨(H. labeo)从样本瓶取出,用清水清洗,随即用游标卡尺(精确到0.01 mm)测量各样本全长、体长、头长、头高、头宽等29 个形态指标(表1),各指标测量参照四川鱼类志[15]及相关论文资料[21-23]。随后,用电子天平称量样本的体质量及空壳质量(精确到0.01 g)。为了减少测量误差,所有测量均由同一个人完成。
1.4 年龄鉴定
在生物学性状测量完毕后,取各唇鱼骨(H. labeo)两侧背鳍基与侧线之间的鳞片10~20枚,剔除再生鳞、畸形鳞,用清水漂净并用载玻片制片,在解剖镜下对样本进行年龄鉴定,每尾样本选取5片左右的鳞片进行鉴定,间隔数天重复观察3次以上。年龄的确认对照殷名称[24]的方法。
1.5 数据处理
唇鱼骨(H. labeo)雌雄个体体长与体质量间的差异性采用独立样本T检验进行比较。控制体长变量,采用协方差(ANCOVA)分析雌性个体间除体长与体重外的其它性状差异。此外,同龄雌雄个体间性状差异采用单因素(One-way ANOVA)。剔除多重共线性较高的形态变量后进行主成分分析(Principal component analysis,PCA)和判别分析(Discriminant analysis)等。利用Canoco 5.0、SPSS 20.0、Excel 2016等分析软件对数据进行处理和分析,各性状采用平均值±标准误(Mean±SE)表示,显著水平设为0.05。
2 结果与分析
2.1 采样情况
本次调查共采集唇鱼骨(H. labeo)94尾,其中雌鱼32尾,雄鱼62尾。94尾唇鱼骨(H. labeo)的体长范围为99.57~234.00 mm,平均体长为170.59(±2.75,SE)mm;体质量范围为17.80~251.40 g,平均体质量为97.19(±5.00,SE)g。其中,雌鱼的体长范围为138.00~234.00 mm,其平均体长为190.16(±4.78,SE)mm;體质量范围为44.20~251.40 g,平均体质量为136.22(±10.11,SE)g。而雄鱼的体长范围为99.57~209.00 mm,体长平均值为160.49(±2.56,SE) mm;体质量范围为17.80~179.60 g,平均体质量为77.05(±3.37,SE) g。独立样本T检验结果表明,唇鱼骨(H. labeo)雌性个体的体质量和体长均显著性高于雄性(P<0.05)。
2.2 唇鱼骨(H.labeo)两性异形比较
协方差(ANCOVA)分析结果表明,在唇鱼骨(H. labeo)头部形态指标中,雌性的头长、头宽、头高、吻长、口角须长、眼后头长显著大于雄性(P<0.05);在躯干部形态指标中,雌性的体宽、躯干距、背吻距、背尾距、胸腹距、背鳍基长、背鳍高、臀鳍基长、臀鳍高显著大于雄性(P<0.05);在尾部形态指标中,雌性的尾柄长显著大于雄性(P<0.05);雌雄个体间其余形态指标差异不显著(P>0.05)(表1)。
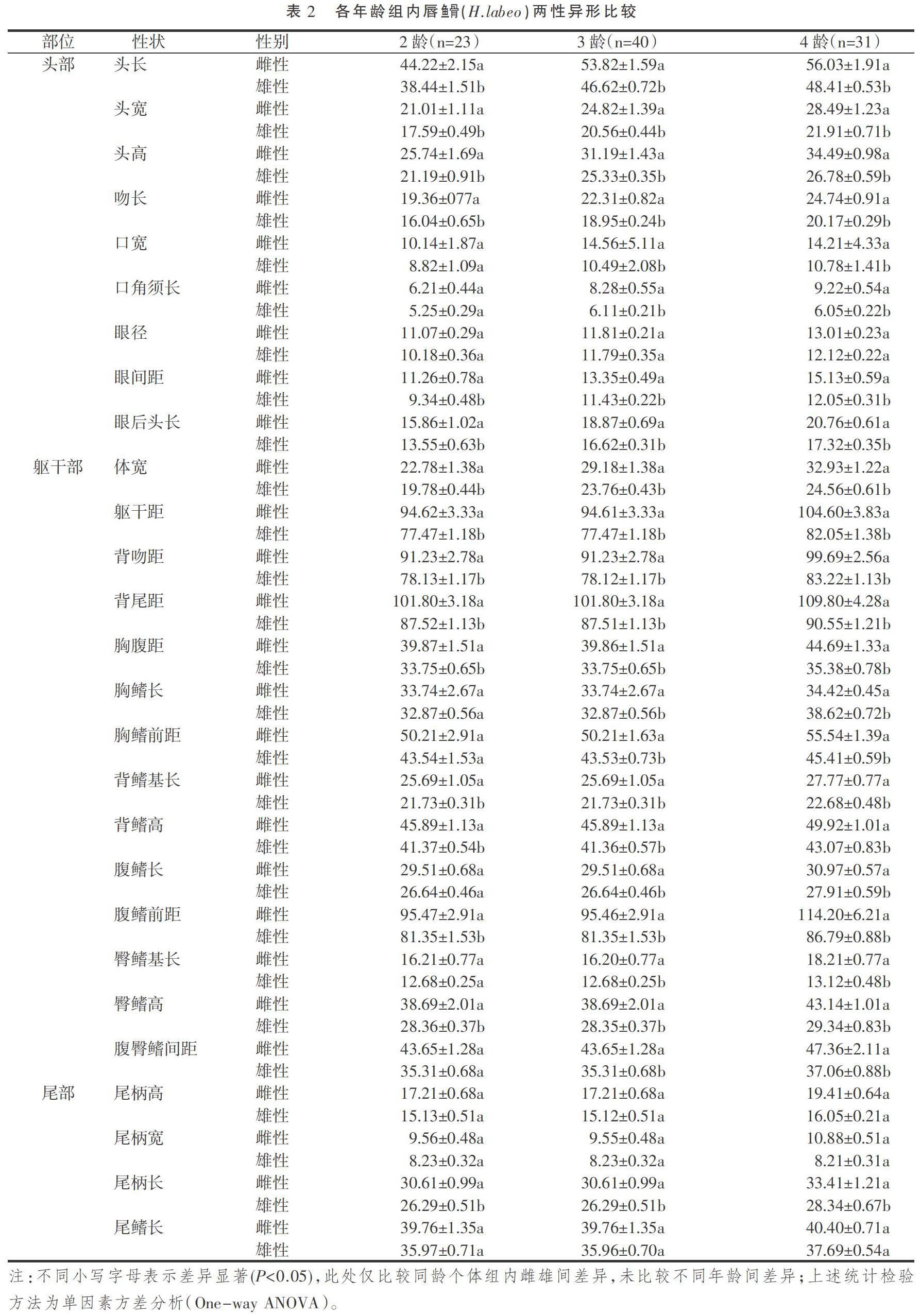
2.3 唇鱼骨 (H.labeo)不同年龄组的两性异形比较
94尾唇鱼骨(H. labeo)样本中,2龄个体23尾,其中,雌性8尾,雄性15尾;3龄个体40尾,雌雄12尾,雄性28尾;4龄个体31尾,雌性12尾,雄性19尾。单因素方差分析(One-way ANOVA)结果表明,在2龄个体中,雌雄个体在头部口宽、口角须长以及眼径三个性状指标差异不显著(P>0.05);在躯干部中,雌雄个体在胸鳍长、胸鳍前距、腹鳍长、臀鳍基长及腹臀鳍间距五个性状指标差异不显著(P>0.05);在尾部,雌雄个体在尾柄高、尾柄宽、尾鳍长三个性状指标差异不显著(P>0.05);2龄个体,雌雄间其余指标性状差异显著(P<0.05),雌性性状指标大于对应雄性性状指标。在3龄和4龄鱼体中,雌雄间都仅眼径、尾柄高、尾柄宽及尾鳍长四个指标差异不显著(P>0.05),其余所有指标差异显著(P<0.05),皆为雌性个体对应指标较雄性个体大(表2)。
2.4 主成分分析
形态数据经log转化后,按年龄组分别进行主成分分析。结果表明,2龄个体主成分分析共提取2个特征根大于1的主成分,共解释87.57%的变异;其中,体长、背吻距以及头长等在第一主成分有较高的负载系数,共解释81.70%的变异;而尾柄宽、头宽等性状在第二主成分有较高的负载系数,共解释5.87%的变异;以第一和第二主成分得分分值为源数据绘制散点图,能将2龄雌雄个体较好的区分(图2)。
3齡个体主成分分析共提取4个特征根大于1的主成分,共解释85.55%的变异;其中,躯干部性状在第一主成分有较高负载系数,共解释71.59%的变异;而头部性状在剩余的3个主成分占有较高负载系数;3龄雌雄个体在散点图中区分较明显(图3)。
4龄个体主成分分析共提取2个特征根大于1的主成分,共解释80.58%的变异;其中,躯干部背吻距、胸鳍前距以及躯干距等性状在第一主成分有较高的载荷系数,共解释77.10%的变异;而头长以及部分躯干部性状(背尾距、腹鳍长)在第二主成分占有较高的负载系数,共解释3.48%的变异;4龄雌雄个体在散点图中的空间分布分离明显(图4)。
2.5 判别分析
将唇鱼骨(H. labeo)形态数据作为待选参数进行逐步判别分析。最终筛选出5个对判别贡献大,特征显著的性状,包括头长(X1)、头宽(X2)、体长(X3)、躯干距(X4)和背吻距(X5),以此建立唇鱼骨(H. labeo)雌雄个体的Fisher线性判别函数,判别方程为:
雄:Y1= 46 554.55X1+36 973.881X2+11 043.438X3+7 071.434 X4-34 400.400 X5
雌:Y2= 46 610.029X1+37 093.632X2+12 078.002X3+6 618.022X4-34 976.548X5
利用所建立的判别函数,对94尾唇鱼骨(H. labeo)个体按年龄进行回判。判别结果表明,2龄雌鱼判别准确率最高,为87.50%,4龄雄鱼的判别准确率最低,为63.16%。从综合判别率看,3龄鱼的综合判别准确率最高,为75.00%,而4龄个体综合判别准确最低,为64.45%(表3)。
3 结论与讨论
3.1 唇鱼骨(H.labeo)两性异形的特征
雌雄个体大小差异是生物体两性异形最常见的形式,这种现象在鱼类中也较为普遍[3]。众多因素都会导致鱼类两性异形,包括种群间食物竞争、生态位分化、性选择压力、以及生育力选择等[4, 25-27]。鱼类的两性异形主要有3种类型。一是雌性个体大于雄性,这一现象通常被认为是雌性个体为了增强繁殖输出,利于种群扩大而来的一种适应策略,这种在鱼类中是最常见,如食蚊鱼(Gambusia affinis),这一策略可能也是食蚊鱼(G. affinis)能够快速入侵到众多水体的原因之一[28]。鱼类第二种两性异形的类型为雄性个体大于雌性个体,这可能与雄鱼追逐配偶,增加繁殖机会和繁殖成功率有关,这种现象通常见于雄鱼具有护巢行为或存在精子竞争的鱼类种群[29-30],如沙塘鳢(Odontobutis obscurus),具有筑巢、防御领土、护卵等抚育行为而表现出雄性大于雌性的现象[31]。最后一种类型为雌雄个体大小差异不显著,仅在某些局部存在一定的区别,常见的如温州厚唇鱼(Acrossocheilus wenchowensis)[32]、鲇(Silurus asotus)[33]等。
本研究结果表明唇鱼骨(H. labeo)属最普遍的类型,即雌性个体显著大于雄性(P<0.05)。另外,唇鱼骨(H. labeo)局部特征也呈现出显著的两性异形,雌性个体的头部、躯干部均比雄性个体大,这可能是在繁殖过程中扮演的角色不同造成的,雌性个体担负主要的繁殖角色,拥有较大的头部有利于获取更多的食物和能量,在资源争夺中占优势;躯干部大小是雌性个体生殖力大小的外在体现,雌性拥有较大的躯干部可能是受性选择压力影响的结果[33]。当然,本研究采样时期为3—10月,覆盖了唇鱼骨(H. labeo)的繁殖期,由于采集的雌性个体多为2龄或更高年龄,几乎全部属性成熟鱼类,雌性性腺的发育对躯干部有一定的影响,因此,在这时期内收集的样本可能对实验结果有一定的影响,下一步还需要延长非繁殖期样本的收集,以期能更全面了解其两性异形情况。
3.2 年龄对唇鱼骨(H.labeo)两性异形的影响
对唇鱼骨(H. labeo)不同年龄组内雌雄个体的两性异形研究结果表明,在头部形态中,3个年龄组中雌雄个体差异性没有较明显的变化,但比较而言,2龄鱼类在头部性状中具有差异显著性的数量较3龄和4龄少,这可能与鱼体自身大小有一定关系。鱼体躯干部的大小与鱼类繁殖能力具有一定联系,较大的躯干部是生殖力选择结果[34],为了提高繁殖力,雌性鱼体通常会选择增加躯干部大小从而增加腹腔容积[23, 35]。本研究中,在唇鱼骨(H. labeo)的躯干部性状中,3龄和4龄的雌性个体显著大于雄性个体的形态性状数量较2龄有所增加,这可能是因为唇鱼骨(H. labeo)在2龄时刚达性成熟,性腺发达程度较3龄和4龄低,而3龄和4龄雌性个体性腺发育完善,处于繁殖旺盛时期,雌性个体为提高个体生殖力,从而增大躯干部大小来加大腹腔的容积,而且躯干部增大不仅有利于怀卵量的增加,而且也更易受到成年雄性个体的青睐[4]。
本研究所提供的雌雄判别方程可以在不解剖鱼类的基础上初步对唇鱼骨(H. labeo)的性别进行判断,这也为鱼类资源保护提供了更多的途径。当然,本文提出的判别函数仅通过5个性状指标来计算,整体判别正确率为71.28%,难免存在一定的误判,这还需要在后续研究工作中加强非繁殖季节唇鱼骨(H. labeo)两性异形研究,同时,可以在其他区域展开相同的研究,以便提供更准确的判别。
致谢!
特别感谢熊淑蓉同志在试验过程中提供的帮助。
参考文献:
[1]CASSELMAN S J, SCHULTEHOSTEDDE A I. Reproductive roles predict sexual dimorphism in internal and external morphology of lake whitefish, Coregonus clupeaformis[J]. Ecology of freshwater fish, 2004, 13(3):217-222.
[2]林植華, 雷焕宗. 黄颡鱼的两性异形和雌性繁殖特征[J].动物学杂志, 2004, 39(6):13-17.
[3]潘瑛子, 刘海平, 周建设, 等. 西藏黑斑原鮡繁殖群体两性异形研究[J].水生生物学报, 2018, 42(6):1203-1209.
[4]林植华, 计翔. 浙江丽水中国石龙子的食性、两性异形和雌性繁殖[J].生态学报, 2000, 20(2):304-310.
[5]BLANCKENHORN W U. Behavioral causes and consequences of sexual size dimorphism[J]. Ethology, 2005,111(11):977-1016.
[6]姚冲学, 王智红, 王方, 等. 饰纹姬蛙的两性异形及雌性繁殖能力[J].动物学杂志, 2020, 55(3):317-322.
[7]HEDRICKA A V, TEMELESB E J. The evolution of sexual dimorphism in animals: Hypotheses and tests[J]. Trends in ecology & evolution, 1989, 4(5):136-138.
[8]林植华, 雷焕宗, 陈利丽, 等. 棒花鱼形态特征的两性异形和雌性个体生育力[J].四川动物, 2007, 26(4):910-913.
[9]林植华, 雷焕宗. 似刺鳊鮈的两性异形和雌性个体生育力[J].上海交通大学学报(农业科学版), 2006, 24(2):138-142.
[10]林植华, 雷焕宗, 林植云, 等. 花鱼骨(的两性异形和雌体繁殖输出[J].上海交通大学学报(农业科学版), 2005, 23(3):284-288.
[11]邱月, 陈亮, 陈策, 等. 乐山棒花鱼形态特征的两性异形和雌性个体生育力[J].生态科学, 2009, 28(5):448-451.
[12]WARD-CAMPBELL B M S, BEAMISH F W H. Ontogenetic changes in morphology and diet in the snakehead, Channa limbata , a predatory fish in western Thailand[J]. Environmental biology of fishes, 2005, 72(3):251-257.
[13]WOOTTON R J. Ecology of Teleost Fishes[M].Netherlands: springer, 1990.
[14]陈宜瑜. 中国动物志·硬骨鱼纲·鲤形目(中) [M].北京: 科学出版社, 1998.
[15]丁瑞华. 四川鱼类志[M]. 成都: 四川科学技术出版社, 1994.
[16]曾燏, 陈永柏, 李钟杰. 嘉陵江鱼类资源利用与保护现状[J].天津农业科学, 2014, 20(2):60-62,87.
[17]青弘. 嘉陵江流域鱼类多样性格局及中下游渔业资源变迁分析[D].重庆:西南大学,2010.
[18]蒋国福, 何学福. 嘉陵江下游鱼类资源现状调查[J].淡水渔业, 2008, 38(2):3-7.
[19]张缓缓. 嘉陵江中游蓬安段鱼类群落结构及重要经济鱼类种群生物学研究[D]. 南充:西华师范大学, 2016.
[20]乔梁. 嘉陵江流域四川广元段污染综合治理研究[D].成都:西南交通大学,2016.
[21]NOVAKOWSKI G C, CASSEMIRO F A S, HAHN N S, et al. Diet and ecomorphological relationships of four cichlid species from the Cuiabá River basin[J]. Neotropical ichthyology, 2016, 14(3):151-160.
[22]PESSANHA A L M, ARAUJO F G, OLIVEIRA R E M, et al. Ecomorphology and resource use by dominant species of tropical estuarine juvenile fishes[J]. Neotropical ichthyology, 2015, 13(2):401-412.
[23]胡月, 曾燏, 蒋朝明, 等. 嘉陵江下游蛇鮈的两性异形与雌性个体生殖力[J].应用生态学报, 2017, 28(2):658-664.
[24]殷名称. 鱼类生态学[M].北京: 中国农业出版社, 1995.
[25]HERLER J, KERSCHBAUMER M, MITTEROECKER P, et al. Sexual dimorphism and population divergence in the Lake Tanganyika cichlid fish genus Tropheus[J]. Frontiers in zoology, 2010, 7(1):1-10.
[26]CHU C Y C, LEE R. Sexual dimorphism and sexual selection: A unified economic analysis[J]. Theoretical population biology, 2012, 82(4):355-363.
[27]WINKLER J D, STOLTING K N, WILSON A B. Sex-specific responses to fecundity selection in the broad-nosed pipefish[J]. Evolutionary ecology, 2012, 26(3):701-714.
[28]樊晓丽, 林植华, 胡雄光, 等. 卵胎生入侵种食蚊鱼的两性异形和雌性繁殖输出[J].生态学报, 2016, 36(9):2497-2504.
[29]SNELSON F F. Systematics of the subgenus Lythrurus, genus Notropis(Pisces: Cyprinidae)[D]. New York: cornell university, 1972.
[30]PARKER G A. The evolution of sexual size dimorphism in fish[J]. Journal of fish biology, 1992, 41(Supplement B):1-20.
[31]樊曉丽, 林植华, 卢静, 等. 沙塘鳢形态特征的两性异形和雌性个体生育力[J].上海交通大学学报(农业科学版), 2009, 27(6):587-591,623.
[32]徐德钦, 林植华, 雷焕宗. 温州厚唇鱼形态特征的两性异形和雌性个体生育力[J].上海交通大学学报(农业科学版), 2006, 24(4):335-340.
[33]樊晓丽, 林植华, 丁先龙, 等. 鲶鱼和胡子鲶的两性异形与雌性个体生育力[J].生态学报, 2014, 34(3):555-563.
[34]MARK A E. Evolutionary compromise between a few large and many small eggs: comparative evidence in teleost fish[J]. Oikos, 1990, 59(2):283-287.
[35]MYHRE L C, FORSGREN E, AMUNDSEN T. Effects of habitat complexity on mating behavior and mating success in a marine fish[J]. Behavioral ecology, 2013, 24(2):553-563.

