黄瓜CsHSP20基因克隆和生物信息学分析
秦智伟,张君鸣,辛 明,单宝成,周秀艳
(1.农业农村部东北地区园艺作物生物学与种质创制重点实验室,哈尔滨 150030;2.东北农业大学园艺园林学院,哈尔滨 150030)
黄瓜产量是植物育种重要研究方向,通过杂种优势开展杂交育种可显著提高黄瓜产量,研究黄瓜杂种优势调控机制对提高黄瓜产量具有重要意义。黄瓜产量受各种因素影响,如温度、湿度、性状分化、病虫害等。其中高温胁迫在黄瓜夏季栽培十分常见,在黄瓜幼苗耐热性研究中,即使两个亲本为热敏品种,通过杂交也会使子一代黄瓜体内CAT、SOD 等酶活性显著提高,在高温胁迫方面表现出优于亲本的耐受力[1],增加黄瓜产量。
黄瓜是夏季蔬菜大棚栽培中广泛栽培的作物,在黄瓜生长过程中,高温胁迫破坏植物细胞,影响植物代谢系统使其产生次生代谢物[2]。高温胁迫影响植物生理过程,植物光合作用能力下降,加剧蒸腾,导致水分大量流失,严重影响黄瓜产量。当植物遭遇高温胁迫时,信号传导及分子伴侣转录能力增强,释放活性氧,同时体内与高温胁迫相关蛋白大量合成应对高温胁迫[3]。热激蛋白(HSPs)是指当植物遭遇热胁迫时,在植物体内迅速大量诱导并合成的一类应激蛋白,可防止植物体内其他蛋白质发生变性,保证植物本身蛋白质原有空间构象不会因高温胁迫而发生改变,所有生物均包含不同数量和类型热激蛋白[4]。热激蛋白又称为“逆境蛋白”[5-6],属于保守的蛋白[7]。在植物正常成长发育中,植物体内热激蛋白数量较少,但当植物温度过高,遇到热胁迫刺激时,该蛋白快速且大量合成[8],被称为热激反应(Heat shock response,HSR)[9]。Ritossa 在研究品种为黄猩猩的果蝇响应热激过程中发现[10],果蝇体内首次发现蛋白质,将受高温胁迫时才被诱导并表达的该类蛋白质命名为热激蛋白。植物中不同热激蛋白相对分子质量不同,不同植物具有不同数量和类型热激蛋白,可将热激蛋白区分为20、60、70、100和小分子HSP家族(sHSPs)[11-12]。在多种类型的热激蛋白中,小分子热激蛋白是热激蛋白大家族中的一部分,在植物中分布最广,含量最高,主要应对植物高温胁迫[13]。热激蛋白家族通常还表现明显的杂种优势,例如,在高温条件下,陆地棉杂交子一代花粉表现耐高温超亲和中亲优势,花粉活力有明显杂交优势特性,而体内HSP90 基因和sHSP2 基因大量表达还可显著增加热胁迫下花粉生存能力[14]。研究表明,水稻中OsHsp20 基因在水稻生长期差异表达,说明该基因参与水稻营养和生殖生长过程,该基因家族均存在明显杂种优势[15]。小热激蛋白不仅参与植物耐热胁迫时调控机制且均具有较强杂种优势。热激蛋白在植物耐热性方面存在显著的杂种优势,利用杂种优势增加黄瓜品种耐热性和探索不同分子在黄瓜对热胁迫的响应中的调控机制对提高黄瓜产量至关重要。
本研究选取黄瓜产量杂种优势表现显著杂交组合“C15-114”(D1104-2-4×D0708-2),通过转录组测序筛选得到关键基因并克隆,预测其蛋白质性质、结构和亲缘关系等,利用生物信息学分析和研究,找寻该基因与黄瓜产量杂种优势间关系,了解该基因功能,为开展该基因在黄瓜产量杂种优势中的调控机制研究奠定基础。
1 材料与方法
1.1 材料
根据同亲回归法(c.p.r)[16],父本统一为黄瓜品种“D0708-2”,分别与其他4 个母本“D1101-1-2、D0528-2、D1104-2-4、D1158-2”自交系杂交,试验选取4 个杂交组合中产量杂种优势最为显著品种“D1104-2-4×D0708-2”杂交种C15-114 为试验材料。
1.2 试验药剂
Trizol 购自Invitrogen 公司,凝胶回收试剂盒、DNA 聚合酶购自北京全式金生物技术有限公司,反转录试剂盒购自北京百泰克生物技术公司,dNTP、T3克隆载体均购自TaKaRa公司。
1.3 方法
1.3.1 黄瓜C15-114RNA提取和检测
将黄瓜品种C15-114叶子提取至干净且无菌研钵中,添加液氮并快速充分研磨。Trizol 法提取总RNA。使用琼脂糖电泳检测提取的RNA纯度。
①在灭菌的干净研钵中加入液氮,将研钵预冷,选取约100 mg黄瓜叶片组织,置于研钵中加液氮并迅速研磨,将叶片组织制成粉末,转入1.5 mL预冷无菌离心管中。
②加入1 mL Trizol,上下颠倒数次充分摇匀,在室温内存放5 min;
③加入0.2 mL 氯仿,剧烈摇荡15 s,设置离心机参数为4 ℃,12 000 r·min-1,离心15 min;
④取0.45~0.55 mL 上层清液置于新无菌离心管中,加入与清液同等数量异丙醇,反复晃动摇匀,室温下静置10 min,4 ℃,12 000 r·min-1离心15 min;
⑤抽取弃掉上层清液,向离心管中放入1 mL 75%DEPC-乙醇,涡旋震荡洗涤白色固体,4 ℃,7 500 r·min-1离心5 min(再重复操作1次此步骤);
⑥弃掉上层清液,将无菌离心管放置在干燥滤纸上,室温下静置5~10 min干燥沉淀物;
⑦加入30 μL DEPC-水溶解RNA,-80 ℃冰箱保存待用;
⑧取1 μL RNA,利用紫外分光光度计(SMA 3000)检测RNA浓度。
1.3.2 cDNA第一链合成
根据第一链合成Fast Super RT Kit cDNA 说明书,通过以下步骤将先前提取RNA反转录为cDNA第一链。
①在冰浴上,无菌微型离心管中配置RNA 消化反应混合液:gDNase 1 μL,10×Buffer 1 μL,总RNA约1 μg,Rnase-free H2O加至总体系 10 μL。
② 42 ℃水浴2 min。
③ 取出,加入1 μL Stop Buffer,65 ℃水浴2 min。
④在灭菌过微型离心管中制备反转录混合液,反转录体系包括:消化反应液内总RNA 0.2~2 μg,Reverse transcriptase MIX 10 μL,Oligo(dt)Primer 1 μL,ddH2O 加至总体系 20 μL。在 PCR仪上50 ℃条件下反转录反应20~50 min,72 ℃,2 min。
⑤利用紫外分光光度计(SAM3000)测定cDNA浓度,-20 ℃保存备用。
1.3.3 引物设计
通过软件Primer Premier v6.0 在线设计克隆CsHSP20 全长所需引物,上游引物序列:CsH⁃SP20-F,5' TGAACCTGCTCCTACTCC 3';下游引物序列:CsHSP20-R,5' GGAGTAGGAGCAGGT TCA 3'。以黄瓜EFla为内参基因,EFla-F:5' CC AAGGCAAGGTACGATGAAA 3';EFla-R: 5'AGA GATGGGAACGAAGGGGAT 3',引物序列由哈尔滨华大科技有限公司合成。
1.3.4CsHSP20克隆
通过RT-PCR 扩增,反应体系20 μL:模板cDNA 2.5 μL;上游引物0.5 μL,下游引物0.5 μL;dNTP 2 μL;10×PCR Buffer 2 μL;Taq酶0.2 μL;加入 ddH2O 至总体系20 μL。PCR 反应程序为:94 ℃预变性5 min;94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸 1 min,35 个循环;72 ℃延伸10 min;4 ℃保存。电泳检测扩增产物,通过回收试剂盒将该目的片段回收。将目的片段连接到pGEM-T载体,感受态细胞转化,筛选白色菌落阳性产物测序。
1.3.5 生物信息学分析
在NCBI上用Blast分析该基因序列;通过Prot⁃param 预测氨基酸数量、理论等电点、脂肪系数、相对分子质量及蛋白质其他各项理化性质;通过TMPRED 预测该蛋白质是否存在明显可跨膜区域;通过SignalP 4.1在线预测蛋白质相关信号肽情况;利用WOLF PSORT Prediction 作亚细胞定位;通过Protscale 分析该蛋白质亲水性;通过SOPMA预测其二级结构。登陆BAKER-ROSETTASERVER在线预测该蛋白质三级结构;登录NCBI 网站,使用Blast 查找蛋白质中同源基因,并使用MEGA 在线软件为基因构建系统树。研究确定该蛋白质各项生物信息,了解该基因部分功能。
2 结果与分析
2.1 黄瓜总RNA提取及检测
总RNA 提取检测结果如图1 所示,提取情况正常,无蛋白污染RNA,可用于后续试验操作。
2.2 基因克隆
将PCR 扩增得到目的片段检测,结果发现该片段长度为1 820 bp。通过测序,结果显示与黄瓜基因组数据库中基因(Csa3G020080)编码区序列相同,相似度为100%,无碱基发生突变,表明成功获得该目的基因,克隆成功。
2.3 生物信息学分析
2.3.1 蛋白质理化性质分析
分析蛋白质理化性质是蛋白质研究过程中的关键和基础。利用NCBI Blast对比,结果表明,该蛋白含有alpha-crystallin-Hsps_p23-like superfamily结构域,将该蛋白基因命名为CsHSP20。登陆Prot⁃param(https://web.expasy.org/cgi-bin/protparam/ prot⁃param)分析氨基酸理化性质,结果表明,CsHSP20蛋白包括212个氨基酸,理论等电点为5.43,理论相对分子质量为23796.60,原子组成:C1021H1650N306O335S7,原子总数:3 319,不稳定系数:62.34(不稳定系数大于40),说明属于不稳定蛋白,脂肪系数75.38(见图3)。
2.3.2 CsHSP20蛋白跨膜区域
蛋白质跨膜区域通常为α螺旋,且跨膜区蛋白质中大多数氨基酸为疏水性氨基酸。通过软件TMPRED(http://www.ch.embnet.org/software/TMPRED_from.html/)预测CsHSP20 蛋白是否存在跨膜区域,结果显示CsHSP20蛋白不存在明显跨膜区域,不是可跨膜蛋白(见图4)。
2.3.3 蛋白质信号肽
蛋白质信号肽一般为一条短肽链,长度为5~30 个氨基酸,位于蛋白质氨基酸序列N 端。信号肽主要功能为促进蛋白质连续进入分泌途径并将蛋白质运送至细胞外。不存在跨膜结构的蛋白质不是一种膜蛋白,无法穿过细胞膜,一般不会存在蛋白质信号肽。利用Signalp 4.1(http://www.ge⁃nome.cbs.dtu.dk/servioes/signalp/)分析预测CsHSP20蛋白质信号肽情况。结果表明该蛋白质并不存在明显信号肽(见图5)。
2.3.4 CsHSP20蛋白亚细胞定位
仅当蛋白质位于一个独特的在亚细胞中的位置时,通过亚细胞定位软件WOLF PSORT(http://www.genascriopt.com/psort.httpl/)预测亚细胞定位,结果表明,CsHSP20蛋白定位于线粒体中(见表1)。
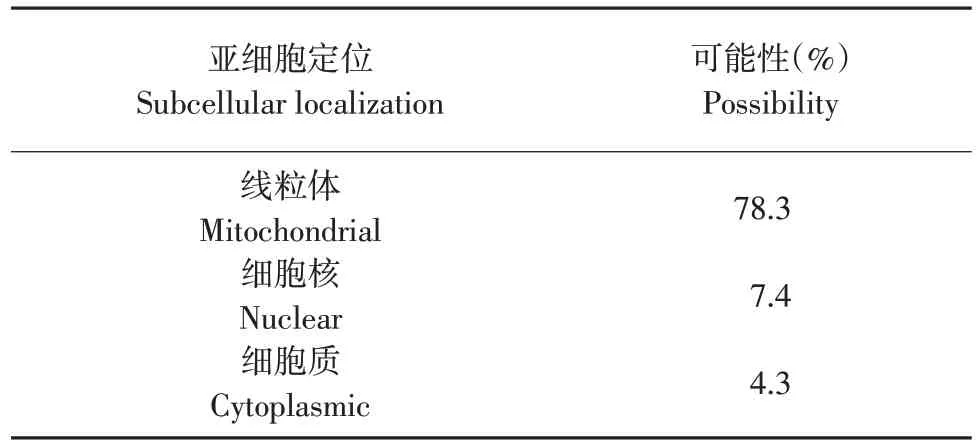
表1 CsHSP20蛋白亚细胞定位预测Table 1 Subcellular localization of CsHSP20 protein
2.3.5 蛋白质亲水性与疏水性
通过 ProtScale(http://www.expasy.org/cgibin/prots cale.pl/)预测该基因编码蛋白亲疏水性,结果表明,CsHSP20 蛋白第29 个氨基酸处有最大疏水值1.533,第161个氨基酸处有最小疏水值-3.533,平均亲水值为-0.646,是一种亲水蛋白质(见图6)。
2.3.6 蛋白质二级和三级结构预测
SPOMA(http://www.ibcp.fr/predict.html/)预测该蛋白质二级结构,结果表明CsHSP20 中有33 条延伸主链,共占多肽链15.57%;α 螺旋氨基酸有62个,占多肽链29.25%;还有9 个形成β-折叠,占多肽链4.25%;共有108 个氨基酸呈无规则卷曲,占比最多,占多肽链50.94%(见图7)。
利用BAKER-ROSETTASERVER 在线软件(http://www.srobetta.bakerlab.org/) 预测 CsHSP20 蛋白三级结构模型(见图8)。
2.3.7 蛋白系统进化树
登陆NCBI 网站下载15 个编码蛋白为HSPs 家族蛋白不同物种基因作同源性比对,将下载的所有蛋白质序列输入MEGA5.0 软件,通过Neighbor-Joining 法将16 个HSP 蛋白质序列放入系统进化树中。由图9 可知,CsHSP20 与南瓜XP022923528.1属于同一个分支,同源关系最近;与李子梅XP008238549.1、 辣 椒 PHU28444.1、 烟 草XP016503526.1 亲缘关系较近; 与青蒿PWA77118.1 亲缘关系最远。说明CsHSP20 在葫芦科相似物种间亲缘关系更近。
3 讨论与结论
大部分小分子热激蛋白,其蛋白序列C端均存在一个α晶体蛋白(ACD)保守结构域,该结构域中含80~100个氨基酸序列[17-18],参与细胞中多个生命活动进程,影响细胞正常生命活动。在高等植物体内大概含有20种以上的sHSPs[19]。大部分小热激蛋白具有保守性及反应短时性等特点[20],植物在正常生长条件下无法检测体内小热激蛋白含量,但遭遇逆境胁迫时小热激蛋白被快速激活并大量表达。小热激蛋白合成及表达受各类胁迫影响,在非生物胁迫中,热胁迫与小热激蛋白合成相关性最高[21]。在植物中小热激蛋白属于一种核基因编码蛋白,存在于各类细胞器[22]。小热激蛋白家族主要由以下大的亚家族组成:①定位于细胞质或细胞核的 CI、CII、CIII、CIV、CV、CVI 和 CVII 亚家族;②定位于内质网的ER 亚家族;③定位于过氧化物的酶体中PO 亚家族;④定位于质体的P 亚家族;⑤定位于线粒体的MI和MII亚家族[23-24]。植物中小热激蛋白数量高于真核生物,植物种类和生存环境影响体内小热激蛋白数量和种类不同。目前在多种植物中均检测得到不同数量小热激蛋白,拟南芥中有19 个sHSPs 基因,水稻中有23 个sHSPs 基因,大白菜中鉴定得到27 个sHSPs 基因,番茄中至少鉴定有42 个sHSPs 基因,小麦中鉴定有至少27 个sHSPs 基因,大豆中鉴定有51 个sHSPs基因,在辣椒中鉴定有35个sHSPs基因。定位在不同细胞器中小热激蛋白,其功能也不同。当植物遭遇热胁迫时,相比于定位在其他细胞器中小热激蛋白,线粒体的小热激蛋白作用更显著,会加快表达并发挥其功能。在线粒体中的小热激蛋白遇到高温胁迫时大量表达,确保光系统Ⅱ中蛋白质复合物正常合成,细胞完成正常的电子传递及ATP 合成,保证植物正常生长。在黄瓜夏季栽培中,黄瓜产量与耐热性密切相关,定位在线粒体中的小热激蛋白使黄瓜植株易于应对高温胁迫,保证黄瓜品质,显著增加产量。
在多种植物中耐热胁迫与产量性状之间具有显著的杂种优势现象,相比于亲本,杂种子一代耐热性显著提高,杂交种更利于应对高温胁迫,提高杂交种果实品质,产量也高于亲本。研究表明棉花产量存在十分明显杂种优势,杂交种产量往往比两个亲本高,叶片光合作用强弱影响棉花产量。棉花叶片光合作用与温度关系密切,高温胁迫导致叶片光合作用能力下降,棉花产量也因此受影响[25]。且不同小麦品种之间也存在明显耐热性差异,而小麦耐热性状(膜热稳定性)同样存在较高杂种优势,杂交种F1耐热性普遍强于双亲[26],通过杂交可显著提高小麦品种耐热性,提高小麦品质和产量。耐热胁迫与植物产量杂种优势间存在密切联系,而小热激蛋白主要参与植物耐热胁迫,通过研究小热激蛋白在黄瓜夏季栽培中的功能,可有效预防黄瓜夏季栽培面临的高温胁迫,提高黄瓜产量。CsHSP20编码的蛋白质是一种定位在线粒体上不具有跨膜结构的蛋白,作为小热激蛋白家族中一员,在黄瓜植株遭遇高温胁迫时可能发挥重要作用,但当植株遭遇高温胁迫时,CsH⁃SP20 具体调控机制尚不明确。后续可探究CsH⁃SP20 在黄瓜耐热胁迫中发挥的重要作用及其调控机制,以及CsHSP20 在黄瓜植株杂种一代耐热性遗传特点。
本文从黄瓜杂种优势显著组合材料转录组测序结果中,筛选出影响黄瓜产量相关基因,通过PCR 技术成功获得该蛋白基因,利用生物信息学研究发现该基因所编码蛋白属于sHSPs 蛋白家族,确定为一种小热激蛋白,将其命名为CsHSP20。明确该蛋白由212 个氨基酸组成,分子式为C1021H1650N306O335S7,属于一种亲水蛋白,亚细胞定位于线粒体中,不存在明显信号肽且不具有跨膜结构,与南瓜亲缘关系最为接近,属于一个分支。本研究为后续开展CsHSP20基因在黄瓜产量杂种优势中的具体调控机制研究奠定基础。

