堆肥土著微生物演替响应抗酸化菌剂研究
宋彩红,齐 辉,魏自民,席北斗
(1.聊城大学生命科学学院,山东 聊城 252000;2.东北农业大学生命科学学院,哈尔滨 150030;3.中国环境科学研究院环境基准与风险评估国家重点实验室,北京 100012)
近年来,关于堆肥过程接种外源微生物菌剂问题受到关注。堆肥土著微生物种类和数量可满足堆肥需要,因此无需额外接种[1-2]。接种微生物菌剂在提高堆肥效率方面效果不稳定,并可能在与堆肥土著微生物竞争过程中死亡[3]。Nakasaki 等认为特殊物料堆肥单纯依靠土著微生物,存在堆肥效率低下、质量差问题,需接种功能微生物菌剂[4]。餐厨垃圾富含油脂等易降解有机质,堆肥初期易出现小分子有机酸累积现象,导致堆料酸化、微生物活性受抑制,堆温延滞上升,甚至发酵崩溃[5-6],研究表明接种高效有机酸降解菌剂可有效解决此问题[7-8]。
有机酸降解菌剂主要分为单一菌种[4-5,8]和混合培养复合菌系[9],单一菌种菌剂对堆肥环境适应能力较差、效果不稳定,通过接种毕赤酵母,可有效解决餐厨垃圾堆肥初期酸化抑制问题,但该菌剂在高温期无法存活[4]。课题组前期研究表明,抗酸化微生物复合菌系AAMC 接种,不但可有效提高餐厨垃圾堆肥效率,还显著提高腐殖酸数量和结构稳定性,改善堆肥品质[10]。堆肥是多种微生物发挥功能复杂体系[11],接种微生物与土著微生物存在竞争关系,土著微生物间存在竞争与协作关系[1]。目前,AAMC 菌剂与堆肥土著微生物关系不清,菌剂接种效果不稳定,限制后期实际应用。本研究通过对比AAMC 接种堆肥、添加化学缓冲剂堆肥和自然堆肥,从细菌、真菌和放线菌三大类群全方位揭示堆肥土著微生物演替响应AAMC菌剂规律,揭示堆肥土著微生物与AAMC 关系,以期为AAMC工厂化应用提供理论指导。
1 材料与方法
1.1 试验材料
餐厨垃圾取自中国环境科学研究院职工食堂,堆肥前对餐厨垃圾预处理,具体方法参见前期研究[10];麸皮取自顺义实验基地附近农户,本研究作为调理剂使用,调节堆料含水率和C/N,堆料具体性质见表1。
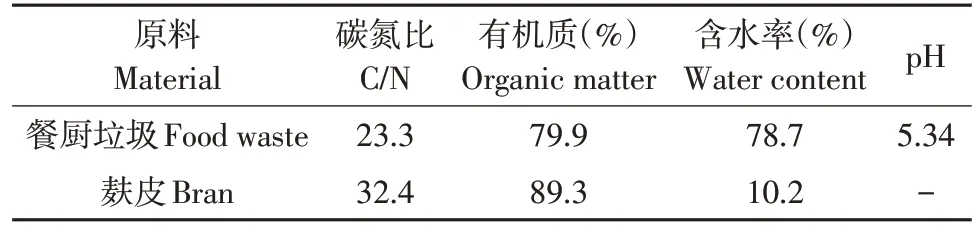
表1 堆肥材料理化性质Table 1 Physicochemical characteristics of composting substrates
1.2 AAMC筛选和驯化
AAMC筛选、驯化和构建方法已在前期研究中展示[10],此处不再赘述。该复合菌系由2种Pseudo⁃monas、2 种Bacillus、1 种Dysgonomonas、1 种Lac⁃tobacillus和1种Aeribacillus菌种组成。
1.3 试验设计
将餐厨垃圾与麸皮按比例充分混合均匀,得到堆肥混合物理化性质如下:C/N为25.6;含水率为60.6%。设置3 个堆肥组,结果见表2。①接种组:堆肥前于堆肥混合物接入处于对数期抗酸化复合菌系AAMC(菌体浓度为1×108CFU·mL-1),接种量为1.25 mL 菌液·kg-1堆料(以干基计);②加碱组:添加碱性化合物MgO 和K2HPO4,以缓解堆肥初期密集酸化导致pH 下降,添加量分别为0.05 mol·L-1MgO·kg-1堆料和0.1 mol·L-1K2HPO4·kg-1堆料(以干基计);③设立自然堆肥组为空白对照。采用在线监测反应器堆肥[12],试验过程中使通风量保持在0.5 L·min-1·kg-1,实时监测堆温和含水率,定期翻堆。在堆肥30 h、2 d和30 d取样,分别作为升温期、高温期、降温和腐熟期样品,置于-20 ℃保存,用于PCR-DGGE分析。

表2 堆肥试验设计Table 2 Composting experimental design
1.4 理化指标分析
温度:堆肥装置在线监测记录;C/N、pH和有机质分别采用元素分析仪、pH计和马弗炉测定,方法参照文献[7,10];含水率:采用差重法测定[10]。
1.5 微生物群落分析
采用PCR-DGGE 技术检测堆肥细菌、真菌和放线菌群落多样性,DNA 提取和纯化采用MOBIO Power Soil 基因组提取试剂盒(美国Mobio)。细菌PCR体系和扩增程序、DGGE条件、优势条带切胶回收参见文献[13],真菌扩增引物为Fung-GC(GC-clamp-5' ATTCCCCGTTACCCGTTG-3' GC-clamp:5' CGCCCGCCGCGCCCCGCGCCCGGCCCGCCGCCC CCGCCCC 3')和 NS1(5' GTAGTCATATGCTTGTCTC 3')PCR 体系:10×Buffer 5 μL、dNTP 4 μL、MgCl24 μL、引物(10 μM)各1 μL、ExTaq(大连TaKaRa)1.5 U、模板DNA 20~50 ng、灭菌超纯水补齐至50 μL。扩增程序:94 ℃ 5 min;94 ℃ 30 s,60~50 ℃30 s,72 ℃ 1 min,10 个循环;94 ℃ 30 s, 58 ℃30 s,72 ℃ 1 min,20个循环;72 ℃ 10 min。DGGE条件:胶浓度为6%~12%(M·V-1),上样量为15 μL,60 ℃下 65 V 电泳 16 h,SYBREGreen 染色。优势条带切胶回收参见文献,其中第二轮pcr扩增引物和程序同上。放线菌PCR 体系和扩增程序、DGGE 条件、优势条带切胶回收参见文献[14],细菌、真菌和放线菌测序工作均由北京市理化分析测试中心完成。
1.6 数据分析
通过Quantity one v4.62软件将DGGE凝胶图谱数字化后,按照Vivas 等[15]方法对DGGE 图谱中各泳道微生物作香农指数(H')和辛普森指数(D)分析,H'通过公式H'=-ΣPilnPi计算,D通过公式D=ΣPi2计算,其中,Pi是泳道中条带相对信号强度。
2 结果与分析
2.1 细菌演替规律分析
2.1.1 细菌DGGE图谱分析
图1 显示3 个处理堆肥过程DGGE 条带种类和分布差异较大,接种组DGGE条带数显著高于对照和加碱组,说明接种AAMC 增加细菌多样性。条带1、5、21、22、32、33、34、35、36、37 和39为接种组特有条带,而这些条带并非来源于所接种AAMC,说明接种AAMC可能激发新细菌种类产生,尤其是在升温期。条带A、B、C、D、E、F、G为AAMC中主要细菌种类。
由图1可知,条带A~G在接种组中均为优势条带,说明来源于餐厨垃圾堆肥AAMC 适应餐厨垃圾堆肥环境良好,发挥其有机酸降解功能。与对照组相比,加碱组高温期DGGE 条带数显著降低,这可能与其较高堆温有关,Nakasaki 等研究表明,高温对细菌有筛选作用[4]。
2.1.2 细菌群落多样性分析
H'反映物种丰度和分布均匀性,与物种多样性呈正相关[16]。D反映物种多样性,呈负相关[17]。由图2 可见,接种和加碱组H'在堆肥过程中均呈现先降后升变化趋势,由堆肥温度变化对细菌群落结构跃迁影响所致;D均呈现先升后降变化趋势,反映高温对细菌群落筛选作用,这与H'研究结论一致。对照组H'和D变化较小,这与其堆肥过程较平稳温度变化有关[3]。在堆肥周期中,接种组H'均高于加碱组和对照组,D低于其他两组,尤其在升温期,说明接种AAMC 可提高餐厨垃圾堆肥细菌多样性,与接种菌剂可引入微生物有关,也与所引入AAMC 在餐厨垃圾堆肥中良好定殖状况和激发新细菌种类产生有关(见图1)。在高温期,加碱组H'明显低于对照组,D高于对照组,添加化学缓冲剂降低细菌群落多样性,而在堆肥腐熟期,随温度降低和细菌对碱性环境适应,多样性恢复。
2.1.3 细菌优势群落分析
优势条带测序结果见表3。39个条带被成功测序。接种组特有条带1、5、21、22、32、33、34、35、36、37和39,分别属于Legionella、Aerib⁃acillus、Deinococcus、 Uncultured bacterium、Aneu⁃rinibacillus、Sphingobacterium、Escherichia、Sphin⁃gobacterium、Flavobacterium、Bacillus和Pusillimo⁃nas。课题组前期揭示上述Legionella、Deinococ⁃cus、Escherichia和Bacillus是乙酸和丙酸代谢途径关键酶来源菌[3],说明接种AAMC 激发乙酸和丙酸降解关键细菌产生,接种组升温期(此阶段正对应对照组酸化抑制期)检测条带34(Escherichia)和37(Bacillus),这可能是接种组避免初期酸化抑制原因之一。Karadag 等报道Sphingobacterium和Flavo⁃bacterium与木质素降解有关[18],而木质素降解过程与腐殖酸合成紧密相关[19]。接种组特有条带33、35和36 属于此两属,且这3 个条带分别来自接种组升温期、腐熟期和高温期,说明接种AAMC在堆肥周期内可激发木质素降解细菌产生,这与接种组堆肥较高腐殖化程度相关[10]。
课题组前期通过宏蛋白质组学揭示乙酸和丙酸降解关键细菌还有:Bacillus(条带14、16、17、18、19、28、29、31 和 37)、Pseudomonas(条带4、6、9 和 26)、Staphylococcus(条带 20)和Strepto⁃coccus(条带7和13)[3]。由于餐厨垃圾堆肥酸化抑制主要发生在初期阶段,对比不同处理升温期乙酸和丙酸降解关键细菌。对照组检测到4、6、9、13四个条带,属于Pseudomonas和Streptococcus两个属;加碱组有7、13、19、28 四个条带,属于Streptococcus和Bacillus两个属;接种组有 13、17、28、29、31 五个条带,再加上接种组分布在升温期特有条带34 和37,共检测到7 个乙酸和丙酸降解关键细菌种类,分别属于Streptococcus、Bacillus和Escherichia3 个属。上述结果显示堆肥升温期接种组乙酸和丙酸降解关键细菌多样性明显高于加碱组和对照组,这可能是接种AAMC 能克服初期酸化抑制主要原因。与对照组相比,加碱组在升温期乙酸和丙酸降解关键细菌多样性并无明显差异,仅是细菌种类不同。
此外,检测到乳酸产生菌Lactobacillus[20](条带8、10和11)和Weissella[5](条带3),3个处理在升温期都检测到乳酸产生菌(接种组:3种;加碱组:2种;对照组:2 种),在腐熟期对照组仍检测到所有4种乳酸产生菌,加碱组检测到1种,接种组未检测到。研究表明Aeribacillus(条带5)分泌羧甲基纤维素酶,此酶主要参与多糖和木质纤维素降解[21]、Mei 等发现Serratia(条带 25)和Aneurinibacil⁃lus(条带 32)具有降解木质素能力[22]。Thermobacil⁃lus(条带38)是嗜热细菌,具有木聚糖降解功能。上述木质纤维素降解菌在接种组检测到3种,在对照组检测到2种,在加碱组仅检测到1种,且在腐熟期仅有接种组检测到两种木质素降解菌(条带25和32),其他两组均未检测到,这可能与接种组较高腐殖酸程度有关[10]。Sporosarcina(条带15)是耐酸菌,在低pH 条件下可阻止H+进入其细胞质[23],仅在对照组检测到,对照组堆料长期处于酸化状态。Francis 等报道Pantoea agglomerans(条带24)是兼性厌氧菌,以乙酸为电子供体、Fe(Ⅲ)为电子受体作电子传递,同步降解复杂有机物[24]。
本研究在接种组堆肥周期内均检测到Pantoea agglomerans分布,说明Pantoea agglomerans对接种组堆肥过程中乙酸代谢发挥重要作用,对接种组克服酸化抑制起积极作用。在加碱组升温期检测到Pantoea agglomerans,说明Pantoea agglomer⁃ans在加碱组缓解堆肥初期酸化抑制过程中发挥重要作用。

表3 细菌DGGE条带测序比对结果Table 3 Sequence analysis of bacterial DGGE bands
2.2 真菌演替规律分析
2.2.1 真菌DGGE图谱分析
图3 展示3 个堆肥处理真菌DGGE 条带分布,本研究检测到土著真菌(对照组检测到条带)有条带 1、2、4、5、7、9、10、11、12、13、14、15和17。与对照组相比,接种组土著真菌条带10、14和15消失,而新检测到条带6、8和16,说明接种AAMC(细菌)也对堆肥真菌群落演替产生影响,这种影响包括促使某些土著真菌消亡和激发新真菌种类产生。与接种组类似,加碱组土著真菌条带14、15和17消失,而新检测到条带3、8、16和18,说明添加化学缓冲剂也对真菌跃迁产生影响。与其他两处理相比,在升温期接种组真菌种类明显降低,而其细菌多样性明显升高(见图1 和3),原因是细菌多样性提高对真菌群落生长和繁殖产生抑制作用。
2.2.2 真菌群落多样性分析
由图4可知,在堆肥过程中,对照组H'变化不明显;加碱组H'显著下降;接种组H'先升后降。一般来说,由于高温对微生物筛选作用,在高温期堆肥微生物多样性降低,进入腐熟期后随堆温降低,多样性回升[5]。对照组H'平稳变化趋势与其堆肥过程中较低堆温对真菌筛选作用微弱有关。接种组H'变化趋势与上述规律不一致,原因是AAMC 接种激发3 个DGGE 条带均分布在高温期,对高温有较强抵抗力(见2.2.3)。D在3个处理中变化趋势与H'完全相反,说明D结果佐证H'分析结果良好。
2.2.3 真菌优势群落分析
图3中18种DGGE条带被成功测序,结果见表4。本研究前期结果显示Saccharomyces(条带1和8)和Candida(条带3 和7)是乙酸和丙酸降解关键真菌[3]。升温期,对照组并未检测到此4 种条带,而接种组检测到条带7和8,加碱组检测到条带1、3、7 和8,原因可能是接种AAMC 和添加化学缓冲剂能克服和有效避免初期酸化抑制。接种组新激发产生条带6、8 和16,分别属于Melanocarpus、Sac⁃charomyces和Aspergillus,前期研究显示Melanocar⁃pus能分泌漆酶,主要作用于木质素降解,Saccha⁃romyces与乙酸和丙酸代谢紧密相关(前述内容已有分析),Aspergillus主要作为用于纤维素降解[3]。条带6在接种组高温和腐熟期为优势菌,在其他两处理均未检测到,由于在堆肥过程中木质素降解与腐殖质合成紧密相关,推测接种组高温期和腐熟期Melanocarpus存在与其较高腐殖质含量和腐殖化程度有关。条带16 在接种组和加碱组高温期为优势菌,说明这两个处理在高温期纤维素降解即活跃,揭示接种和加碱组加速堆肥进程。

表4 真菌DGGE条带测序比对结果Table 4 Sequence analysis of fungal DGGE bands
此外,还检测到Eremothecium cymbalariae(条带2)、Galactomyces geotrichum(条带5)、Neurospo⁃ra(条带 4、12 和 18)、Schizosaccharomyces pombe(条带10)、Thermomyces lanuginosus(条带11)、De⁃baryomyces(条带 9)、Paracoccidioides(条带 14)、Yarrowia lipolytica(条带13)和未培养真菌(条带15和17)。Leeuw 等报道Eremothecium是重要植物病原菌[25],本研究在加碱和对照组高温期及接种组腐熟期均检测到此种真菌。Galactomyces geotrichum可降解甲基红等染料,常用于纺织和造纸等行业染料剂处理[26]。Galactomyces geotrichum在 3 个堆肥处理均为优势菌,可视为餐厨垃圾堆肥土著真菌。Lin 等报道Neurospora可分泌胞外脂肪酶,在餐厨垃圾富含油脂降解过程中发挥重要作用[27]。本研究除条带18仅在加碱组高温期检测到外,条带4和12 在3 个处理堆肥过程中均分布。Thermomyces lanuginosus为耐热真菌,在木聚糖(半纤维素成分)降解过程中发挥重要作用[28]。本研究在3 个堆肥处理升温期和接种组高温期均检测到Thermomy⁃ces lanuginosus。Debaryomycessp.具 有 较 强 耐 盐性,在木糖发酵产木糖醇过程中有大量应用[29]。这种耐盐真菌在3 个堆肥处理堆肥周期均为优势菌,与餐厨垃圾物料含盐量较高有关。Yarrowia lipolyti⁃ca可分泌胞外脂肪酶,主要作用于油脂类降解[30]。条带13 在加碱和对照组升温期及接种组腐熟期均为优势菌。
2.3 放线菌演替规律分析
2.3.1 放线菌DGGE图谱分析
图5 展示3 个堆肥处理放线菌DGGE 条带分布,本研究检测到土著放线菌(对照组检测到条带)有条带1、2、3、7、8、9、12、14、15、21、22、23、25、27、28、31、34 和35。与对照组相比,除条带9、23、31 和34 外,其他土著真菌条带在接种组中全部消失,而新检测到11 个放线菌条带(条带 5、10、13、19、20、24、26、29、30、32和33),这些现象说明接种AAMC(细菌)对放线菌群落跃迁产生显著影响,这种影响包括促使某些土著放线菌消亡和激发新放线菌种类产生。与加碱组类似,除条带9、21、23、31 和34外,其他土著真菌条带在加碱组中全部消失,而新检测到条带 4、6、11、16、17、18、24、26、32 和33,说明添加化学缓冲剂也对放线菌群落演替产生显著影响。在升温期加碱组放线菌种类明显低于接种和对照组,而在高温期放线菌种类相比升温期大幅增多,此时放线菌种类多于接种和对照组,说明虽放线菌类最适生长pH呈碱性,但在投加化学缓冲剂后较短时间内,餐厨垃圾堆肥体系pH突然升高并未促进放线菌类生长,对其生长有抑制作用,这种抑制作用随堆肥进程转成促进作用。
2.3.2 放线菌群落多样性分析
由图6可知,接种组H'变化平稳,而加碱和对照组H'均呈先升后降变化趋势,与Tran等[5]研究结论不一致,原因是接种和加碱组由于人为调控添加微生物菌系和化学缓冲剂打破堆肥过程放线菌演替一般规律,可一定程度削弱温度对放线菌群落结构跃迁影响,而这种削弱作用在加碱组更明显,与放线菌最适生长pH 呈碱性有关。对照组温度较低,无明显高温对放线菌群落组成筛选作用。在升温期,加碱组H'(1.38)明显低于接种(2.07)和对照组(2.15),而在高温期H'有一个显著升高(2.63),这与前述结果一致。D在3 个处理中变化趋势与H'完全相反,说明D结果佐证H'分析结果良好。
2.3.3 放线菌优势群落分析
优势条带测序结果见表5。

表5 放线菌DGGE条带测序比对结果Table 5 Sequence analysis of actinobacterial DGGE bands
35 个条带被成功测序。本研究前期结果显示,Corynebacterium(条带29)、Mycobacterium(条带5和20)和Rhodococcus(条带10、32和34)是乙酸和丙酸降解关键放线菌[3]。升温期,不同处理检测到上述条带数分别为接种组4个、加碱组2个、对照组1个,说明接种AAMC(细菌)提高乙酸和丙酸降解放线菌种类,有效避免堆肥初期酸化抑制问题。本研究检测到多种Acidothermus(条带16、17、26 和28)和Streptomyces(条带7、9、21、27 和31)放线菌种类,Mohagheghi等报道Acidothermus是嗜热、嗜酸放线菌,具有降解纤维素能力[31]。加碱组高温期检测到条带16、17 和26,接种组升温期检测到条带26,对照组高温期检测到条带28。Streptomyces有效降解木质纤维素[32],在对照组检测到5 个Streptomyces种类,加碱组和接种组分别检测到3 个和2 个Streptomyces种类。由上述结果可知,接种AAMC 或添加化学缓冲剂并未显著提高纤维素或木质纤维素降解放线菌种类。
此外,在本研究餐厨垃圾堆肥过程中检测到Frankia(条带 1、4 和 8)、Nocardioides(条带 2 和30)、Saccharomonospora(条带24 和33)、Salinispo⁃ra(条 带 12 和 35)、Thermomonospora(条 带 6 和11)、Arthrobacter humicola(条带 14)、Geoderma⁃tophilus arenarius(条带 3)、Kocuria(条带 19)、Leif⁃sonia bigeumensis(条带 18)、Micrococcus(条带 13)、Tropheryma whippelii(条带15)和3 种未培养放线菌种类(条带22、23 和25)。Yin 等报道Frankia放线菌具有固氮作用,对照组检测到两种Frankia放线菌,加碱组检测到1 种,而接种组未检测到[33]。Webb 等报道Saccharomonospora有降解农药五氯苯酚能力,所有堆肥处理均检测到2 种Saccharo⁃monospora放线菌[34]。Salinispora产生抗生素,仅在对照组检测到2种Salinispora放线菌[35]。Sakon 等报道Thermomonospora分泌内切和外切纤维素酶[36],本研究仅在加碱组高温期检测到2种Thermomonos⁃pora放线菌种类。
3 结 论
a.AAMC中7种主要细菌在接种组中均为优势条带,说明AAMC 在接种组定殖状况良好,适应餐厨垃圾堆肥环境良好。
b.乙酸和丙酸降解关键微生物:接种组共检测到7 个细菌种类,2 个真菌种类和4 个放线菌种类,显著高于加碱(细菌:4个,真菌:4个,放线菌:2个)和对照组(细菌:4个,真菌:0个,放线菌:1 个),说明接种AAMC 可激发乙酸和丙酸降解关键微生物产生。
c.接种AAMC激发木质素降解细菌和真菌种类产生,但并未显著提高木质纤维素降解放线菌种类;接种AAMC 显著增加堆肥过程细菌多样性,对真菌和放线菌多样性影响不明显,但均显著改变3个类群群落结构跃迁规律,包括激发新微生物种类产生并促进某些土著微生物消亡。添加化学缓冲剂显著改变土著微生物演替规律。

