原发性干燥综合征并间质性肺疾病患者细胞因子表达水平及其临床意义
黄菁梅 谢宝钊 李水贤 杨柳 陆雪 钟金河 卢品伶
原发性干燥综合征(Primary sjogren′s syndrome,pSS)是一种以泪腺与唾液腺等外分泌腺分泌减少为特点的慢性炎症性自身免疫病,主要以口、眼干燥为主要表现,并可累及肺、肾、肝等重要器官[1-2],其中,间质性肺疾病(interstitial lung disease,ILD)是pSS患者肺部受累的主要表现,也是pSS患者最常见的并发症之一[3]。干燥综合征并间质性肺疾病(pSS-ILD)可导致感染与呼吸衰竭,是pSS患者死亡的主要原因之一[4-5]。目前关于pSS-ILD的病因尚未完全清晰,但有研究报道可能与多种炎症细胞因子的释放导致肺部炎症有关[6],已知IL-6、IL-8、IL-10以及TNF-α等炎症细胞因子与多种自身免疫性疾病有关[7],但在pSS-ILD患者中尚未见有关报道。本研究通过比较IL-6、IL-8、IL-10以及TNF-α等细胞因子在单纯pSS患者与并发ILD的pSS患者中的表达水平,旨在探究这些细胞因子与pSS患者并发ILD的关系。现报道如下。
资料与方法
一、一般资料
选取2017年1月至2019年12月在我院接受治疗的50例pSS患者作为研究对象,纳入标准为:①经临床确诊为pSS[8];②年龄>18岁;③无其他自身免疫性疾病;④具有自主行为能力。排除标准:①合并肺部恶性肿瘤患者;②伴有其他原因导致的肺部严重损伤疾病者(如慢性阻塞性肺疾病、肺结核、支气管扩张等);③长期服用可导致肺纤维化的药物;④伴有慢性心、肝、肾功能不全者;⑤既往明确诊断为肺癌、急性呼吸窘迫综合征、其他间质性肺疾病(如特发性肺间质纤维化、结节病等)者。根据是否合并ILD分为干燥综合征并间质性肺疾病组(pSS-ILD组)与干燥综合征不合并间质性肺疾病组(pSS-n-ILD组)。另选择同期在我院进行体检且性别、年龄等一般资料与pSS患者均衡可比的20名健康人群作为对照组。本研究经我院医学伦理委员会审批同意,所有研究对象均签署知情同意书。
二、细胞因子检测方法
所有研究对象均于清晨空腹状态下抽取静脉血3 mL,置于无菌试管中,进行10min的3000r/min的离心处理,取上层血清于-80℃低温下保存。使用西门子公司生产的试剂盒与试剂通过酶联免疫法(ELISA)对患者血清IL-6、IL-8、IL-10、TNF-α表达水平进行测定,所有操作步骤严格按照试剂盒说明书进行。
三、ILD诊断方法
根据患者肺部高分辨率CT(high resolution CT,HRCT)检查结果判断是否合并ILD的依据,将HRCT结果中出现蜂窝肺、磨玻璃影或网格状影的患者判定为合并ILD。收集两组患者性别、年龄、病程、免疫球蛋白以及是否吸烟等资料。
四、统计学分析

结 果
一、pSS患者与健康人群细胞因子表达水平比较
两组IL-6、IL-8、IL-10及TNF-α表达水平差异均有显著性(P<0.05)。其中pSS组患者IL-6、IL-8、TNF-α表达水平显著高于对照组,IL-10表达水平显著低于对照组,差异均具有统计学意义(P<0.05)(见表1)。

表1 pSS组与对照组IL-6、IL-8、IL-10及TNF-α表达水平比较
二、pSS患者合并ILD现状及一般资料对比情况
本研究50例pSS患者中,合并ILD的占30.0%(15/50),未合并的占70.0%(35/50),对两组患者的基线资料进行对比发现,合并ILD与未合并ILD患者的年龄、性别、平均病程、免疫球蛋白(IgG、IgA、IgM)以及吸烟情况,差异均无统计学意义(P<0.05)(见表2)。
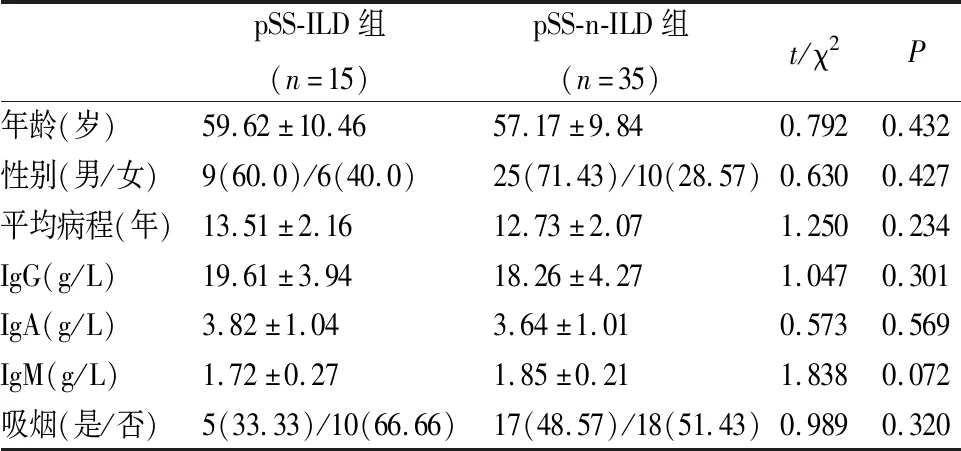
表2 pSS-ILD组与pSS-n-ILD组患者一般资料比较
三、pSS-ILD组与pSS-n-ILD组细胞因子水平比较
两组IL-6、IL-8、IL-10及TNF-α表达水平均具有显著差异(P<0.05)。其中pSS-ILD组患者IL-6、IL-8、TNF-α表达水平显著高于pSS-n-ILD组,IL-10表达水平显著低于pSS-n-ILD组,差异均具有统计学意义(P<0.05)(见表3)。

表3 pSS-ILD组与pSS-n-ILD组细胞因子水平比较
四、pSS患者IL-6、IL-8、IL-10及TNF-α表达水平预测ILD的ROC曲线分析
IL-6、IL-8、IL-10及TNF-α水平在评价pSS患者并发ILD的AUC分别为:0.667、0.712、0.894、0.733(见图1与表4)。
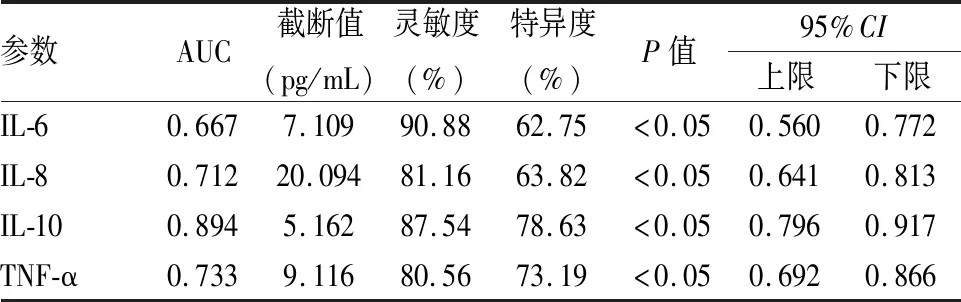
表4 IL-6、IL-8、IL-10及TNF-α指标的ROC曲线分析结果
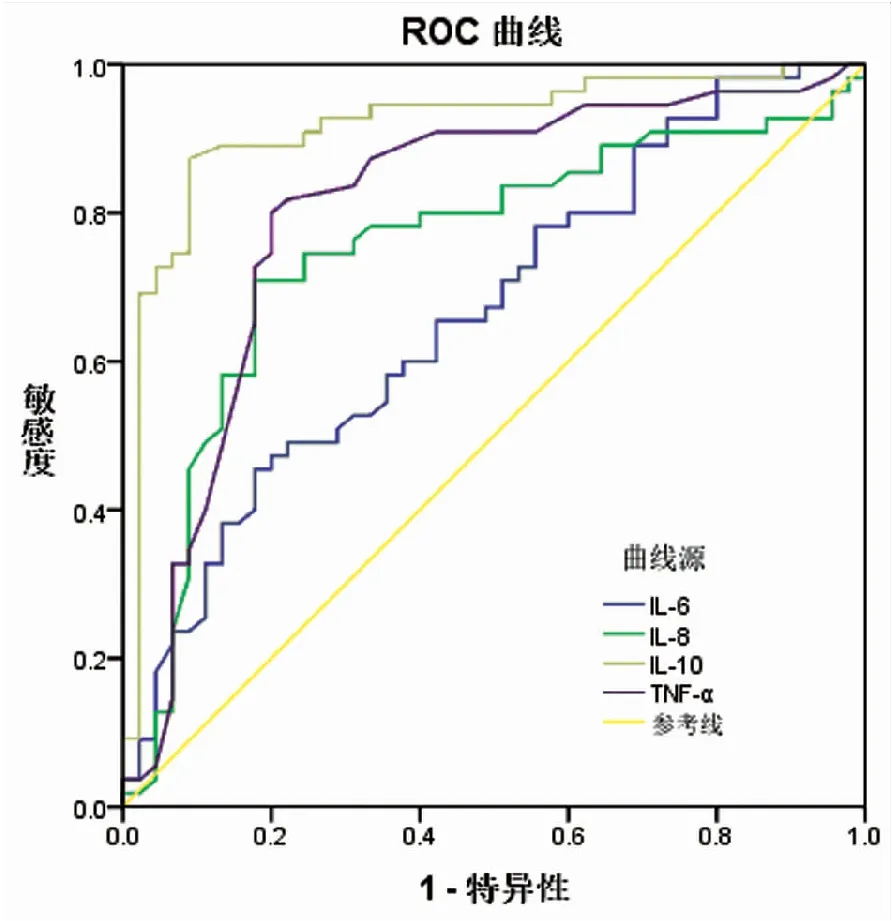
图1 pSS患者IL-6、IL-8、IL-10及TNF-α表达水平预测ILD的ROC曲线分析
讨 论
pSS是一种全球性疾病,随着世界人口老龄化的进展,其发病率呈上升趋势,在我国老年群体中,pSS的发病率超过4%,是危害我国国民健康的重要疾病之一[9]。pSS患者除表现为明显的外分泌腺体分泌减少外,也会伴有皮肤病变、骨骼肌肉疼痛以及重要脏器与系统的损害作用,其中肺是pSS最易受累的腺体外器官,有流行病学研究显示,约有8%~75%的pSS患者因累及肺部而出现ILD(因检测方法与诊断标准不同,累及率存在较大差别)[10]。pSS-ILD患者通常存在明显的呼吸困难与限制性肺通气功能障碍,同时肺弥散功能降低,最终可能发展为弥漫性肺纤维化,导致患者出现呼吸衰竭而死亡,有研究显示,pSS-ILD患者死亡率可超过60%[10]。目前关于pSS-ILD的病因尚未完全清晰,临床上认为其与遗传、病毒感染以及性激素异常等多种因素共同作用有关[11],而近期研究认为慢性炎症与pSS-ILD关系密切,因此,目前对于pSS-ILD的治疗也更多从减轻患者炎症反应出发,通过减轻患者炎症反应来阻止或改善其肺间质纤维化进展[12]。但pSS-ILD与炎症细胞因子的关系仍需大量研究进一步证实。
本研究中,pSS患者与健康人群体内IL-6、IL-8、IL-10及TNF-α表达水平均具有显著差异,进一步比较发现,合并ILD的患者血清IL-6、IL-8、TNF-α等炎症因子表达水平显著高于未合并ILD患者,而IL-10表达水平却较未合并ILD的患者低,分析其原因:pSS患者合并ILD可能与机体多种炎症因子过多分泌导致肺泡炎症有关,IL-6是炎症细胞因子的核心成员,它可由激活的T细胞、成纤维细胞及巨噬细胞等在受到外界刺激时产生的一种促炎因子,能有效反应机体炎症状态,已被证实,在多种机体免疫疾病中起到重要作用[13]。IL-8是主要由单核细胞产生的炎症因子,可促进中性粒细胞趋化,被证实在小支气管炎和囊性纤维化的发病中发挥重要作用[14]。TNF-α是一种人肿瘤坏死因子,能够作用于T细胞,产生多种炎症因子,诱发机体炎症反应,同时,其末端的羧基重复结构能通过与IL-8等炎症因子的糖蛋白结合,增强炎症因子活性,进而加重机体炎症反应[15]。合并ILD的pSS患者血清IL-6、IL-8及TNF-α均显著高于未合并的pSS患者,这提示pSS-ILD患者体内存在较为严重的炎症反应。大量炎症因子长期浸润肺部,可能会促进肺纤维细胞增生与细胞外基质的合成,进而导致肺纤维化的发生与发展。
IL-10是一种具有抑制炎性反应作用的细胞因子,参与机体炎症与免疫反应,与血液、消化及心血管系统疾病关系密切,几乎能由所有的淋巴细胞合成,而在人体内主要由T细胞亚群:Treg细胞合成与分泌。其抑制炎症反应的机制为抑制单核巨噬细胞释放炎症介质,从而抑制LPS与IFN-γ导致的IL-6、IL-8及TNF-α等促炎因子分泌,降低机体炎症反应[16]。IL-10在抑制炎症因子分泌的同时还能下调刺激因子CD86与粘附因子CD54的表达。合并ILD的pSS患者血清IL-10表达水平显著降低,这可能是疾病状态下,Treg细胞被抑制,导致IL-10分泌减少[17]。经ROC曲线分析发现,IL-10预测pSS患者并发ILD的效能最高,且当pSS患者IL-10低于5.162 pg/mL时,发生ILD的可能性明显上升,这可能跟IL-10表达水平过低时,不足以对抗机体炎症反应,导致大量炎症因子浸润肺部,造成肺部损伤有关。本研究通过分析pSS患者血清IL-6、IL-8、IL-10及TNF-α表达水平与ILD的关系,揭示了IL-10等炎症细胞因子在pSS患者肺间质受累中可能具有重要作用,为明确pSS-ILD发病机制与治疗提供新的参考思路。但本研究还存在样本量较小的不足,可能会使结果存在偏倚,且尚未对炎症细胞因子与pSS-ILD患者疾病严重程度进行研究,望今后纳入更大样本进行更全面的研究。
综上所述,血清IL-6、IL-8、IL-10及TNF-α细胞因子与pSS患者并发ILD关系密切,IL-10表达水平在预测pSS患者并发ILD上具有较高效能,临床上应对IL-10呈低表达的pSS患者予以重点关注。

