工程微生物合成苯丙酸类化合物及其衍生物的研究进展
牛福星,杜云平,黄远斌,周荷田,刘建忠
(1中山大学生命科学学院合成生物学研究所,生物无机与合成化学教育部重点实验室,广东省水生经济动物良种繁育重点实验室,广东广州510275;2温氏食品集团股份有限公司,广东云浮527400)
苯丙酸类化合物是苯丙素类化合物中的一类,是指含C6-C3单元的天然有机酸,包括苯丙烯酸类和苯乳酸类化合物。许多苯丙酸类化合物具有显著的生物学活性,而广泛应用于食品、医药、香料、化妆品、农业等领域。
在植物中,苯丙酸类化合物是经莽草酸途径生成的芳香族氨基酸的衍生物,其人工生物合成途径如图1所示。苯丙氨酸、酪氨酸在苯丙氨酸解氨酶(PAL)、酪氨酸解氨酶(TAL)的作用下分别生成肉桂酸(cinnamic acid)和对香豆酸(p-coumaric acid)。它们又会被进一步羟化或甲基化从而生成其他苯丙烯酸类化合物。对香豆酸在羟化酶(C3H)的作用下生成咖啡酸(caffeic acid),而咖啡酸又在O-甲基转移酶(COM)的催化下生成阿魏酸(ferlulic acid)。苯丙氨酸前体苯丙酮酸(PP)在乳酸脱氢酶作用下生成苯乳酸;而酪氨酸前体对羟基苯丙酮酸在乳酸脱氢酶作用下则生成对羟基苯乳酸。
微生物与植物具有类似的初级代谢途径,如芳香族生物代谢途径。随着代谢工程、合成生物学的发展,工程微生物已成为苯丙酸类化合物生物合成的一种有效的方法。因此,本文对近年来工程微生物生物合成苯丙酸类化合物的进展做一综述,最后对其未来发展方向进行了展望。
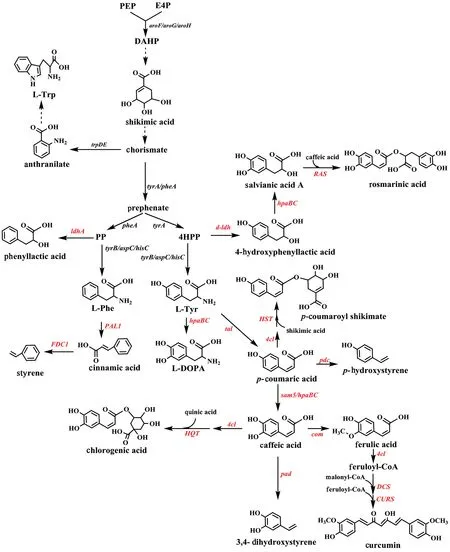
图1 苯丙酸类化合物及其衍生物的人工生物合成途径Fig.1 The artificial biosynthetic pathway of phenylpropanoids and their derivatives Black:endogenous genes;Red:exogenous genes.
1 苯丙烯酸类化合物
1.1 肉桂酸及其衍生物
肉桂酸又名β-苯丙烯酸、3-苯基-2-丙烯酸。它在医药、农药、香料等方面的应用中起着重要作用。医药方面,它是合成治疗脑动脉硬化药物肉桂苯哌嗪、治疗冠心病药物心可安等的重要前体;同时也可以抑制多种肿瘤细胞的增殖。农药方面,它可以用于杀菌剂、除草剂以及食品保鲜防腐剂等。香料方面,它是食品安全国家标准食品添加剂使用标准(GB 2760—2014)规定范围内所允许使用的香料之一。Bang等[1]在过量生产L-苯丙氨酸的大肠杆菌中质粒表达马里蒂姆链霉菌(Streptomyces maritimus)苯丙氨酸解氨酶基因pal,实现了从头合成肉桂酸,在2 L反应器中pH-Stat补料发酵可产6.9 g/L肉桂酸。Gottardi等[2]研究发现在酿酒酵母中发光杆菌(Photorhabdus luminescens)的苯丙氨酸解氨酶比拟南芥酶具有更高的催化活性。在此基础上,他们优化了生物合成途径后构建了一株工程酵母,实现了从头合成肉桂酸,摇瓶发酵可产37.9 mg/L肉桂酸。
苯乙烯是肉桂酸的脱羧产物,是合成聚合物、共聚物、塑料及合成橡胶等的重要单体,2020年全球需求将超过4100万吨。美国亚利桑那州立大学Nielsen团队[3]在高产苯丙氨酸的大肠杆菌NST74中,质粒共表达拟南芥(Arabidopsis thaliana)的苯丙氨酸解氨酶PAL2和酿酒酵母的肉桂酸脱羧酶FDC1,摇瓶发酵产260 mg/L苯乙烯。为了避免苯乙烯对宿主菌的毒性,随后该团队[4]应用二(2-乙基己基)邻苯二甲酸酯萃取发酵技术,使工程菌苯乙烯产量提高至836 mg/L。中国科学院青岛生物能源与过程研究所咸漠团队[5]采用相似策略构建了一株含双质粒的工程大肠杆菌以从头合成苯乙烯,通过豆蔻酸异丙酯萃取发酵使工程大肠杆菌苯乙烯产量提高至350 mg/L。Jeong团队[6]采用双质粒系统分别表达马里蒂姆链霉菌pal基因和酿酒酵母FDC1基因,并将其引入高产苯丙氨酸的工程大肠杆菌中,采用萃取与气提相结合的高密度发酵技术,5 L罐发酵60 h产5.3 g/L苯乙烯。今年,美国可再生与可持续能源研究所Gill团队[7]首先将拟南芥PAL2和酿酒酵母FDC1基因整合到苯丙氨酸产生菌大肠杆菌NST74染色体上,构建了一株苯乙烯产生菌;随后利用iCREATE技术对PAL2和FDC1基因的核糖体结合位点(RBS)序列进行了优化,接着采用同样的iCREATE策略对54个转录因子进行了突变进化以提高工程菌对苯乙烯的耐受性和产量,获得了一株工程大肠杆菌,在1 L罐中后期补料气提发酵可产3.15 g/L苯乙烯。测序发现,工程菌染色体上的转录抑制因子lexA发生了E45I氨基酸突变。由于酿酒酵母本身含有肉桂酸脱羧酶基因FDC1,只需引入苯丙氨酸解氨酶基因,便可合成苯乙烯。美国亚利桑那州立大学Nielsen团队[8]在酿酒酵母中质粒表达拟南芥苯丙氨酸解氨酶基因PAL2,从而构建了能产苯乙烯的酿酒酵母。为了提高酿酒酵母合成苯丙氨酸的能力,他们首先通过传统诱变育种筛选到一株间-氟-DL-苯丙氨酸抗性菌,使其苯丙氨酸产量提高到357 mg/L;随后,通过强化表达耐受反馈抑制的DAHP合酶ARO4K229L基因和阻断竞争性途径苯丙酮酸的消耗,使苯乙烯产量提高60%,达到29 mg/L。链霉菌具有降解生物质、同化木糖(如戊糖)及纤维二糖、低聚木糖等低聚糖的良好能力,因此日本神户大学Fujiwara等[9]构建了一个能利用单糖或低聚糖的产苯乙烯的浅青紫链霉菌(Streptomyces lividans)-浅青紫链霉菌共培养系统,以葡萄糖为碳源时,摇床发酵可产30 mg/L苯乙烯。
1.2 对香豆酸及其衍生物
对香豆酸又名对羟基肉桂酸,具有抗氧化、抗菌和抗突变活性,也是许多重要化合物及药物的前体或中间体。对香豆酸既可以在苯丙氨酸解氨酶和肉桂酸羟化酶催化作用下由苯丙氨酸生成,也可以在酪氨酸解氨酶催化作用下直接由酪氨酸生成。由于肉桂酸羟化酶是一种细胞色素P450酶,在原核宿主细胞中难以表达,因此,通常采用酪氨酸解氨途径来合成对香豆酸。丹麦技术大学和瑞典查尔姆斯理工大学Nielsen团队[10]在敲除竞争性途径酶基因ARO10和PDC5的基础上,强化表达合成途径酶基因从而构建了一株产对香豆酸的酿酒酵母。工程酵母强化表达约翰逊黄杆菌(Flavobacterium johnsoniaeu)酪氨酸解氨酶基因tal、去反馈抑制的DAHP合酶基因ARO4K229L、去反馈抑制的分支酸变位酶基因ARO7G141S及大肠杆菌的莽草酸激酶基因aroL。所构建的酿酒酵母在1 L发酵罐中分批补料发酵产1.9 g/L对香豆酸。随后,该课题组[11]比较分析了两个常用的酿酒酵母宿主菌对对香豆酸合成的影响,发现酿酒酵母CEN.PK更有利于对香豆酸的合成,同时发现敲除一些转运蛋白基因能明显促进对香豆酸的合成。最近,该课题组[12]通过引入磷酸酮醇酶途径以增加赤藓糖-4-磷酸(E4P)的供给以及通过启动子置换优化糖酵解途径和芳香族氨基酸合成途径间碳通量的分配,使工程酵母对香豆酸产量提高到12.5 g/L,对葡萄糖的产率达到154.9 mg/g。虽然大肠杆菌[13]、蓝细菌(SynechocystisPCC 6803)[14]和假单胞菌(Pseudomonas putidaKT2440)[15]都已成功用作合成对香豆酸的宿主菌,但其产量都远低于酿酒酵母。
对香豆酸在脱羧酶作用下脱羧生成对羟基苯乙烯。对羟基苯乙烯又称为4-乙烯基苯酚,是一种重要的化工原料,用于生产许多重要的工业聚合物;同时也在光阻、光刻和半导体制造中发挥重要作用。Qi等[16]在苯丙氨酸高产菌大肠杆菌NST74中利用质粒共表达黏红酵母(Rhodotorula glutinis)酪氨酸/苯丙氨酸解氨酶基因PAL和植物乳杆菌(Lactobacillus plantarum)对香豆酸脱羧酶基因pdc,在14 L发酵罐中补料发酵可产0.4 g/L对羟基苯乙烯。Kang等[17]构建了一个由西班牙糖丝菌(Saccharothrix espanaensis)酪氨酸解氨酶基因tal和解淀粉芽孢杆菌(Bacillus amyloliquefaciens)酚酸脱羧酶基因pad组成的对羟基苯乙烯合成途径,并将其转化到苯丙氨酸高产大肠杆菌中,摇床发酵36 h能产355 mg/L对羟基苯乙烯。由于链霉菌基因组含有丰富的酚酸脱羧酶基因,因此链霉菌也已成功用作合成对羟基苯乙烯的宿主菌。日本神户大学Kondo团队[18]比较了3种不同链霉菌的酚酸脱羧酶基因,发现斯氏链霉菌(Streptomyces sviceus)的酚酸脱羧酶催化对香豆酸脱羧生成对羟基苯乙烯的效果最佳。该团队[19]随后比较分析了9个不同链霉菌分解代谢对香豆酸的能力,发现白斑链霉菌(Streptomyces mobaraense)的降解能力最强,为此他们将球形红杆菌(Rhodobacter sphaeroides)酪氨酸解氨酶基因引入白斑链霉菌中,从而构建了产对羟基苯乙烯的白斑链霉菌。恶臭假单胞菌因具有很强的溶剂耐受能力,也已成功用作对羟基苯乙烯的宿主菌。Verhoef等[20]在溶剂耐受菌恶臭假单胞菌(Pseudomonas putidaS12)中质粒表达黏红酵母酪氨酸/苯丙氨酸解氨酶基因PAL和植物乳杆菌对香豆酸脱羧酶基因pdc,从而构建了一株产对羟基苯乙烯的恶臭假单胞菌。在此基础上敲除阿魏酸辅酶A合成酶基因fcs以阻断对香豆酸的分解,进一步提高了对羟基苯乙烯的产量。为了降低产物的细胞毒性,采用有机相萃取发酵技术,工程菌对羟基苯乙烯的产量达到17.6 g/L。
1.3 咖啡酸及其衍生物
咖啡酸及其衍生物是一类普遍存在于一些植物中的次生代谢产物。咖啡酸及其衍生物具有抗氧化、清除自由基、抗炎、抑菌、抗病毒、抗感染、增强免疫力、抗癌、止血等活性。目前大肠杆菌、酿酒酵母已成功用于合成咖啡酸,并实现了从头合成[21]。美国佐治亚大学Yan团队[22]在比较了不同红细菌Rhodobacter的酪氨酸解氨酶(TAL)后,将来源于荚膜红细菌(Rhodobacter capsulatus)的tal和大肠杆菌的4-羟基苯乙酸3-羟化酶基因hpaBC引入产酪氨酸的大肠杆菌中,首次从头合成了咖啡酸,摇床发酵48 h可产50.2 mg/L咖啡酸。随后,美国麻省理工学院的Zhang和Stephanopoulos[23]构建了由黏红酵母tal和西班牙糖丝菌(Saccharothrix espanaensis)对香豆酸3-羟化酶基因sam5编码酶组成的另一个咖啡酸合成途径,并将该外源途径引入产酪氨酸的大肠杆菌中,在2 L发酵罐中发酵4 d可产106 mg/L咖啡酸。佐治亚大学Yan团队[24]在将高产苯丙氨酸的大肠杆菌ATCC31884改造为酪氨酸产生菌的基础上,引入由黏红酵母tal和大肠杆菌HpaBC组成的咖啡酸合成途径,使大肠杆菌摇床发酵可产766.68 mg/L咖啡酸,是目前文献报道的从头合成咖啡酸的最高值。日本神户大学Kawaguchi等[25]构建了一个由铜绿假单胞菌(Pseudomonas aeruginosa)HpaBC和链霉菌(Streptomycessp.WK-534)酪氨酸氨裂解酶(FevV)组成的咖啡酸合成途径,将其引入酪氨酸产生菌后,在外加纤维素酶条件下,从硫酸盐纸浆中边糖化边发酵,可生产233 mg/L咖啡酸。天津大学元英进团队[26]在比较了不同来源的HpaB和HpaC之后,合成了一个咖啡酸途径,将其引入酿酒酵母中,创制了第一个合成咖啡酸的酿酒酵母,以葡萄糖为原料摇床发酵可产289.4 mg/L咖啡酸。全细胞生物催化是将细胞生长与产物合成完全隔开的一种生物制造技术。它尤其适合高毒性产物的生物制造。对香豆酸和咖啡酸等苯丙烯酸类化合物固有的抑菌活性,导致对大肠杆菌同样具有很高的毒性。为了避免对香豆酸和咖啡酸高毒性的抑制作用,佐治亚大学Yan团队[24]利用表达EchpaBC的酪氨酸产生菌,进行全细胞生物催化对香豆酸合成咖啡酸,产量达到3.82 g/L。目前文献报道的咖啡酸产量最高值是利用全细胞生物催化对香豆酸而获得的,达到10.2 g/L[27]。从已报道的咖啡酸产量数据来看,全细胞生物催化的咖啡酸产量远远高于以葡萄糖为原料从头合成的产量。究其原因,可能是咖啡酸对宿主细胞的高毒性引起的。
在植物中,咖啡酸常与奎宁酸、莽草酸、马来酸、邻氨基苯甲酸或甘油共轭生成酯化物。而且这些酯化物比咖啡酸具有更好的溶解性、稳定性和抗氧化能力。绿原酸就是其中一个重要代表,它是咖啡酸与奎宁酸的共轭酯化产物,广泛存在于咖啡、杜仲、金银花和野菊花等植物中。韩国建国大学Ahn团队[28]首先构建了一株产绿原酸的工程大肠杆菌,该工程菌质粒表达了烟草(Nicotiana tabacum)羟基肉桂酸辅酶A奎宁酸转移酶基因HQT、水稻(Oryza sativa)对香豆酸辅酶A连接酶基因4CL和内源莽草酸/奎宁酸脱氢酶基因ydiB。发酵24 h后,工程菌以咖啡酸为原料可合成450 mg/L绿原酸。他们的研究表明,NtHQT能催化奎宁酸与咖啡酸-CoA、对香豆酸-CoA或阿魏酸-CoA间的酯化反应,但咖啡酸-CoA是其最佳的酰基供体,其次是对香豆酸-CoA和阿魏酸-CoA。随后,该团队[29]将所构建的以咖啡酸为原料的绿原酸产生菌与产咖啡酸的工程大肠杆菌进行共培养,实现了以葡萄糖为原料的绿原酸从头合成,摇床发酵可产78 mg/L绿原酸。烟草中也含有羟基肉桂酸辅酶A莽草酸转移酶基因HST。NtHST能催化莽草酸与对香豆酸-CoA、咖啡酸-CoA或阿魏酸-CoA间的酯化,分别生成对香豆酸-莽草酸酯、咖啡酸-莽草酸酯或阿魏酸-莽草酸酯。该团队[28]研究发现在以莽草酸为酰基受体时,对香豆酸-CoA是NtHST的最佳酰基供体。在敲除了aroL基因的大肠杆菌中质粒表达NtHST和Os4CL,可催化对香豆酸生成235 mg/L对香豆酸-莽草酸酯[28]。随后,该团队[29]利用NtHST构建了一株大肠杆菌,实现了从头合成对香豆酸-莽草酸,摇床发酵48 h可产236 mg/L对香豆酸-莽草酸酯。
3,4-二羟基苯乙烯是苯乙烯衍生物。Kang等[17]构建了一个由西班牙糖丝菌酪氨酸解氨酶基因tal和对香豆酸-3-羟化酶基因sam5、解淀粉芽孢杆菌酚酸脱羧酶基因pad组成的3,4-二羟基苯乙烯合成途径,并将其转化到苯丙氨酸高产大肠杆菌中进行表达,摇床发酵36 h能产63 mg/L 3,4-二羟基苯乙烯。
1.4 阿魏酸
阿魏酸又称为4-羟基-3-甲氧基肉桂酸。它具有抗辐射、抗氧化、抗血栓、降血脂、降低心肌缺血和耗氧量、抗菌、抗病毒、抗癌等功能。临床上已用于治疗冠心病、肾病、肺动脉高压、脑梗死、阿尔茨海默病等。阿魏酸广泛存在于伞形科、毛莨科及禾本科等植物中,如当归、川芎、升麻、三棱等。阿魏酸是咖啡酸甲基化产物,咖啡酸在O-甲基转移酶(COMT)的催化下生成阿魏酸。韩国生物科学与生物技术研究所Kang等[30]构建了一个由西班牙糖丝菌酪氨酸解氨酶基因tal、对香豆酸-3-羟化酶基因sam5和拟南芥O-甲基转移酶基因com编码酶组成的阿魏酸合成途径,并将该途径引入合成酪氨酸的大肠杆菌中,实现了阿魏酸的从头合成,摇床发酵36 h可产196 mg/L阿魏酸。阿魏酸也可由丁香酚通过丁香酚羟化酶(或者香草醇氧化酶)、松柏醇脱氢酶和松柏醛脱氢酶催化生成。Overhage等[31]在真氧产碱菌H16中用质粒表达假单胞菌丁香酚羟化酶基因ehyAB、松柏醇脱氢酶基因calA及松柏醛脱氢酶基因calB,所构建工程菌能生物转化丁香酚生成阿魏酸,生产力达到2.9 mmol/(L·h)。随后,该课题组[32]又构建了一株质粒表达简青霉(Penicillium simplicissimum)的香草醇氧化酶基因vaoA、假单胞菌松柏醇脱氢酶基因calA及松柏醛脱氢酶基因calB的大肠杆菌,所构建大肠杆菌在30 L发酵罐中可在30 h内将丁香酚生物催化生成14.7 g/L阿魏酸,摩尔转化率达到93.3%。
姜黄素是姜黄中的一种黄色的二酮化合物,具有抗氧化、抗炎、抗菌、抗肿瘤、护肝、降脂、抗动脉粥样硬化、抑制肥胖、抗老年痴呆等生物活性,广泛应用于食品、医药、化妆品和禽畜养殖等行业。阿魏酸经过对香豆酰辅酶A连接酶(4CL)、二酮辅酶A合酶(DCS)和姜黄素合酶(CURS)三个酶的连续催化反应生成姜黄素。葡萄牙米尼奥大学Rodrigues课题组[33]将由拟南芥4CL、姜黄DCS和姜黄CURS2组成的姜黄素合成途径引入大肠杆菌中,实现了从阿魏酸到姜黄素的合成。随后,该课题组[34]对工程菌的培养条件进行了优化,使以阿魏酸为原料合成姜黄素的产量提高到959.3μmol/L(353 mg/L)。韩国生物科学与生物技术研究所Kang等[35]将西班牙糖丝菌酪氨酸解氨酶基因tal、对香豆酸-3-羟化酶基因sam5、拟南芥O-甲基转移酶com由烟草4cl、姜黄苯二肽CoA合成酶基因DCS和姜黄素合成酶基因CURS2编码酶组成的姜黄素合成途径引入合成酪氨酸的大肠杆菌中,实现了姜黄素的从头合成,然后采用多重基因组工程(MAGE)技术对合成途径的6个基因的表达水平进行了优化,使姜黄素产量提高了38.2倍,达到3.8 mg/L。
1.5 左旋多巴
左旋多巴(L-DOPA)是治疗帕金森病的药物。由于帕金森病患者人数的逐年增加,对药物的需求也逐年增加,左旋多巴全球市场规模达每年250 t、1.01亿美元市值。目前左旋多巴的生物制造方法主要有:①酪氨酸酶法;②酪氨酸苯酚裂解酶法;③对羟基苯乙酸3-羟化酶法[36]。酪氨酸酶能催化两个反应:一是催化酪氨酸生成左旋多巴,即甲酚酶活性;二是催化左旋多巴氧化生成多巴醌,即邻苯二酚酶活性。酪氨酸酶的这种特性不利于左旋多巴的合成。酪氨酸苯酚裂解酶能催化裂解酪氨酸生成丙酮酸、氨和酚的可逆反应。当丙酮酸、氨和邻苯二酚为底物时,酪氨酸苯酚裂解酶便能催化左旋多巴的合成。由于酪氨酸苯酚裂解酶是酪氨酸诱导酶,需要添加酪氨酸进行诱导,从而增加了左旋多巴从含酪氨酸的培养液中提取的难度。而且酪氨酸苯酚裂解酶法需要丙酮酸和邻苯二酚参与,无法以葡萄糖为原料从头合成,从而限制了其应用。对羟基苯乙酸3-羟化酶法能直接羟化酪氨酸生成左旋多巴,以便从头合成,受到了学者的广泛关注。墨西哥国立自治大学Munoz等[37]最早构建了一株产左旋多巴的大肠杆菌,他们将非P450酶的大肠杆菌W的对羟基苯乙酸3-羟化酶基因hpaBC引入酪氨酸高产大肠杆菌中,在1 L反应器中分批发酵40 h,可产1.51 g/L左旋多巴。本课题组[38]首先利用单重基因组工程手段,对转录调控因子tyrR和csrA、葡萄糖磷酸转移酶系统、竞争性途径酶基因zwf和pheLA、合成途径关键酶基因进行了敲除/置换和整合,构建了一株无质粒的产左旋多巴大肠杆菌,然后采用MAGE技术对23个靶基因进行修饰,进一步提高左旋多巴产量,所构建工程大肠杆菌在5 L发酵罐中后期补料发酵60 h可产8.67 g/L左旋多巴。Das等[39]构建了一株产左旋多巴的工程大肠杆菌,该菌敲除了丙酮酸激酶I基因pfkF、转录因子tyrR和磷酸甘油酸脱氢酶基因serA,双质粒表达酪氨酸氨基转移酶基因tyrB、分支酸变位酶基因tyrA、分支酸合成酶基因aroC、3-磷酸莽草酸1-羧乙烯基转移酶基因aroA、莽草酸激酶Ⅱ基因aroL、hpaBC。工程菌以甘油为碳源、在5 L发酵罐中后期补料发酵产12.5 g/L左旋多巴。江南大学周景文团队[40]通过对HpaB的定向进化,获得了3个突变体,将其中hpaBG295R的突变体置换产左旋多巴大肠杆菌的野生型hpaB基因,进一步提高了左旋多巴的产量,在5 L发酵罐中后期补料发酵48 h可产25.53 g/L左旋多巴。
2 苯乳酸类化合物
2.1 苯乳酸
苯乳酸是一种广谱的新型天然防腐剂,对多数革兰氏阳性、阴性菌和真菌都有明显的抑菌作用。经聚合后生成比聚乳酸具有更强的热稳定性、机械强度、柔韧性和紫外吸收能力的新型的生物基聚合物聚苯乳酸。在医学上,可作为丹参素替代品用于治疗冠心病,具有止血止痛疗效,抗血小板聚集和扩张冠状动脉等功能。在化妆品行业,具有除皱、亮肤的美容功效。作为新型的抑菌剂,特别对肠道致病菌具有良好的抑制作用,苯乳酸类化合物成功应用于畜禽养殖业,代替抗生素成分并提高鸡肉品质,提高蛋鸡的免疫能力以及鸡蛋的质量,减少猪的肠道致病菌并提高生产性能。因此,苯乳酸在食品、医药、化妆品、生物材料和养殖行业有广阔的应用前景。工程微生物生产苯乳酸的方法主要有两种:一是全细胞生物催化苯丙氨酸/苯丙酮酸法;二是微生物发酵从头合成法。乳酸脱氢酶能催化苯丙酮酸生成苯乳酸,但反应需要消耗NADH。因此辅因子NADH的再生是该反应的一个关键因素。葡萄糖脱氢酶和甲酸脱氢酶的催化反应能生成NADH,已成功作为全细胞生物催化生成苯乳酸的辅因子再生系统。Zhu等[41]利用质粒表达植物乳杆菌乳酸脱氢酶和巨大芽孢杆菌葡萄糖脱氢酶的大肠杆菌,全细胞生物催化苯丙酮酸生成L-苯乳酸,产量达到103.8 mmol/L。但该工艺需要消耗葡萄糖作为葡萄糖脱氢酶的底物以实现NADH再生。Zhang和Li[42]应用表达灰盖鬼伞菌(Coprinopsis cinereus)苯丙氨酸氧化酶和植物乳杆菌乳酸脱氢酶的大肠杆菌,全细胞生物催化苯丙氨酸生成1.62 g/L L-苯乳酸、转化率为28%。天津科技大学贾士儒团队[43]构建了一株质粒表达奇异变形杆菌(Proteus mirabilis)L-氨基酸解氨酶基因L-aad、植物乳杆菌乳酸脱氢酶基因L-ldh和博伊丁假丝酵母(Candida boidinii)甲酸脱氢酶基因FDH的大肠杆菌,经RBS序列优化和采用共底物辅因子再生手段,使重组大肠杆菌在葡萄糖的辅助下,全细胞生物催化苯丙氨酸生成L-苯乳酸的产量进一步提高至54.0 g/L。但苯丙氨酸和苯丙酮酸价格高,限制了全细胞生物催化法的产业化。科学家们希望能构建工程微生物以葡萄糖为原料从头合成苯乳酸。日本大阪市技术研究所Koma等[44]将合成苯丙氨酸的大肠杆菌的acs和mtlA基因置换成钩虫贪铜菌(Cupriavidus necator)乳酸脱氢酶基因ldhA,从而构建了从头合成苯乳酸的大肠杆菌,摇床发酵产6.0 mmol/L苯乳酸。日本神户大学Fujita等[45]在合成苯丙氨酸的大肠杆菌NST37中质粒表达荧光威克汉酵母(Wickerhamia fluorescens)苯丙酮酸还原酶基因pprA及去反馈抑制pheAfbr和aroGfbr,构建了一株产D-苯乳酸的重组大肠杆菌,工程菌在0.4 L发酵罐中后期补料发酵144 h可产29.2 g/L D-苯乳酸。他们研究也发现,用乳酸片球菌(Pediococcus acidilactici)乳酸脱氢酶基因L-ldhA置换pprA基因,所构建的工程菌生成的是L-苯乳酸、摇瓶发酵的产量为1.9 g/L。
2.2 4-羟基苯乳酸及其衍生物
4-羟基苯乳酸具有与苯乳酸同样的性质,它是酪氨酸/4-羟基苯丙酮酸的衍生物。日本大阪市技术研究所Koma等[44]将合成酪氨酸的大肠杆菌的乙酰辅酶A合成酶基因acs置换成钩虫贪铜菌乳酸脱氢酶基因ldhA,从而构建了从头合成羟基苯乳酸的大肠杆菌,摇床发酵产8.1 mmol/L羟基苯乳酸。
丹参素(salvianic acid A)是丹参水溶性成分中的主要药效成分之一。它具有保护心肌、抑制血小板凝集及抗凝、抗动脉粥样硬化及降血脂、抗血栓形成、扩张冠状动脉、抗脑缺血、抗氧化、增强免疫和抗癌等功效。天津大学赵广荣团队[46]在大肠杆菌中构建了1个由戊糖乳杆菌(Lactobacillus pentosus)D-乳酸脱氢酶和大肠杆菌HpaBC组成的丹参素合成途径,在优化了整个合成途径及敲除了竞争性途径后,所构建工程菌在摇瓶中后期补料发酵70 h可产7.10 g/L丹参素。为了避免质粒易丢失和质粒上抗性素抗性基因所带来的抗生素污染问题,该课题组[47]随后利用基因置换技术,将丹参素外源合成途径及需要强化表达的内源基因整合到大肠杆菌染色体的相应位置,从而构建了一株无质粒、无抗生素标记的合成丹参素大肠杆菌,工程菌摇瓶后期补料发酵60 h可产5.6 g/L丹参素。Li等[48]建立了一个由嗜压热球菌(Thermococcus barophilus)D-扁桃酸脱氢酶TbManDH、弯曲高温单孢菌(Thermomonospora curvata)苯丙氨酸4-羟化酶TcPAH和嗜酸硫杆菌(Sulfobacillus acidophilusTPY)羟基苯乙酸3-羟化酶SaHpaBC组成的嗜热酶无细胞合成系统,在50℃反应12 h能催化苯丙酮酸生成39.2 mmol/L丹参素,摩尔转化率达到85%。
迷迭香酸是一种天然存在的水溶性羟基肉桂酸酯化合物,常见于迷迭香、紫苏和鼠尾草等植物中。具有抗氧化、抗抑郁、抗炎、抗菌、抗病毒和抗肿瘤等活性,已广泛用于食品、药物和化妆品等领域。在迷迭香酸合成酶作用下,丹参素与咖啡酸进行酯化生成迷迭香酸。Bloch和Schmidt-Dannert[49]在比较了不同来源的酶基因后,构建了一个迷迭香酸外源合成途径,该途径由德氏乳杆菌(Lactobacillus delbrueckii)2-羟基酸脱氢酶(HdhA)、大肠杆菌HpaBC、球形红杆菌Tal、拟南芥4CL2和香蜂草(Melissa officinalis)迷迭香酸合成酶(RAS)构成;采用三质粒表达系统在大肠杆菌中表达该外源合成途径,首次实现了迷迭香酸的从头合成,工程菌可合成1.8μmol/L迷迭香酸。他们研究同样发现酪氨酸等前体的供给是迷迭香酸合成的主要瓶颈。Jiang等[50]构建了另一个由不同酶组成的迷迭香酸的人工合成途径,该途径由戊糖乳杆菌D-乳酸脱氢酶突变体LdhY52A、大肠杆菌HpaBC、拟南芥4CL和彩叶草(Coleus blumei)RAS组成;将该人工合成途径引入酪氨酸产生菌中实现了迷迭香酸的合成。在添加咖啡酸条件下全细胞生物催化产约130 mg/L迷迭香酸。迷迭香酸合成途径是典型的分流-汇合途径,碳流经4-羟基苯丙酮酸分流成咖啡酸和丹参素两个合成途径,然后咖啡酸和丹参素进行酯化反应生成迷迭香酸,即碳流又汇集在一起。为了平衡这些分支途径的碳代谢流,美国新泽西州立大学Li等[51]构建了3个大肠杆菌组成的共培养系统,使迷迭香酸从头合成的产量提高到172 mg/L。江南大学蔡宇杰团队[52]构建了一个无细胞系统,在ATP和CoA循环再生条件下,以咖啡酸为原料无细胞系统反应1 h产320.04 mg/L迷迭香酸。
3 合成生物学策略的应用
苯丙酸类及其衍生物是分枝酸(chorismate)的衍生物(图1)。分枝酸的总合成方程式为:10Glucose+12ATP+12NAD++6NADPH=6Chorismate+12ADP+12NADH+6NADP++12H3PO4+12H2O+12H+(1)
由此可看出分枝酸的理论产率为60%(摩尔分数)。表1为工程微生物合成苯丙酸类化合物及其衍生物的代表性进展,从其微生物合成的产量来看,与理论最大值还有相当大差距,即使是目前文献报道的苯丙氨酸(72.9 g/L、28.3%)[53]和酪氨酸(43.14 g/L、10.6%)[54]的最大值,与理论产率相比也有一定差距。近年来合成生物学的应用大幅度提高了工程微生物的合成效率。虽然应用于苯丙酸类及其衍生物微生物合成的合成生物学策略文献还鲜有报道,但是,为了给苯丙酸类及其衍生物的人工微生物创建提供借鉴,在此对应用于其他芳香化合物的合成生物学策略进行总结和评述。
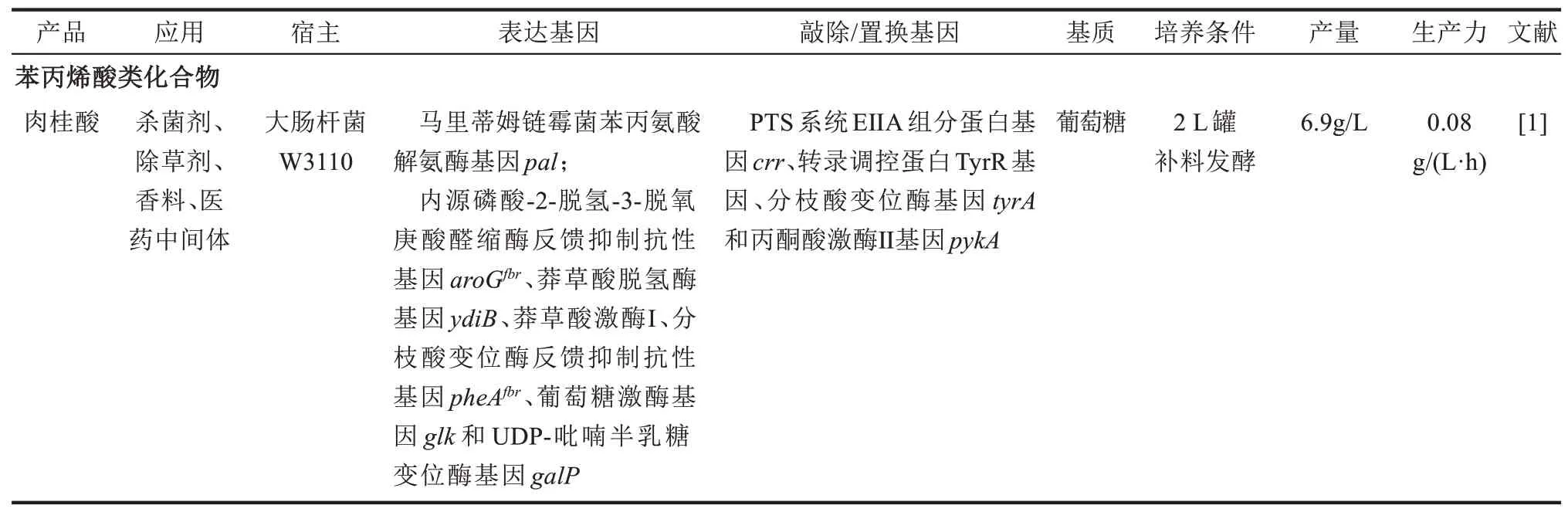
表1 代表性的工程微生物合成苯丙酸类化合物及其衍生物Tab.1 Representative microorganisms engineered for the production of phenylpropanoids and their derivatives
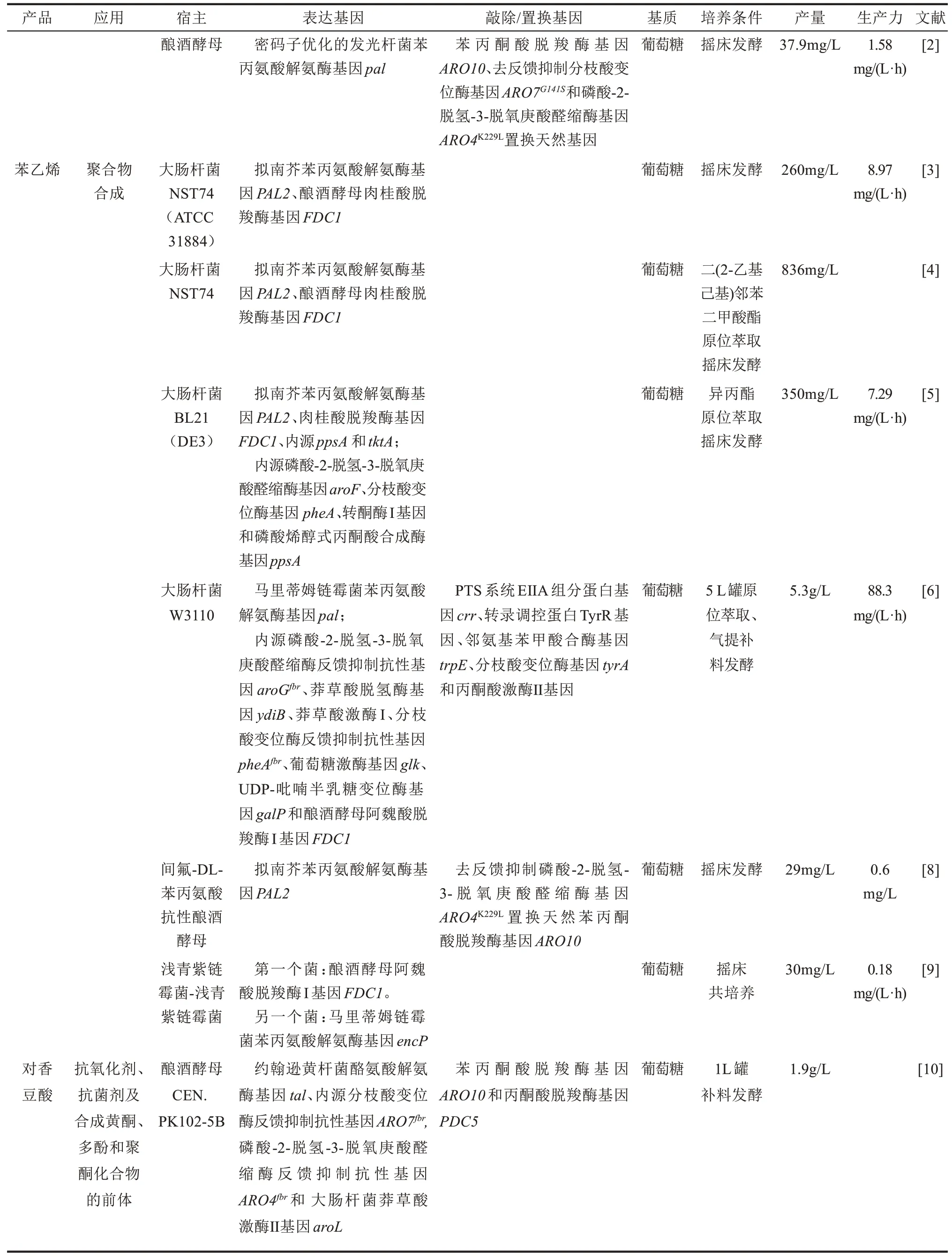
续表
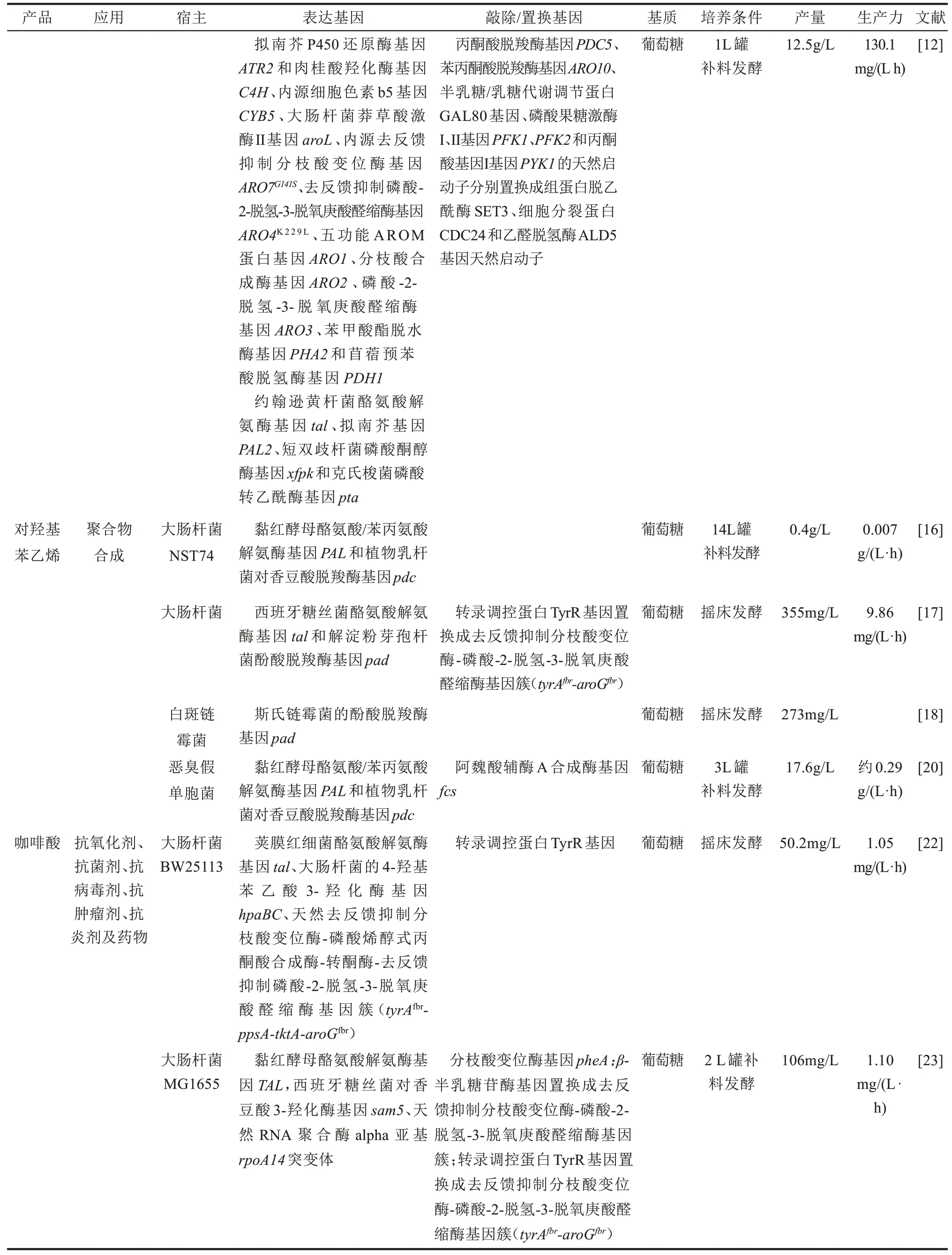
续表
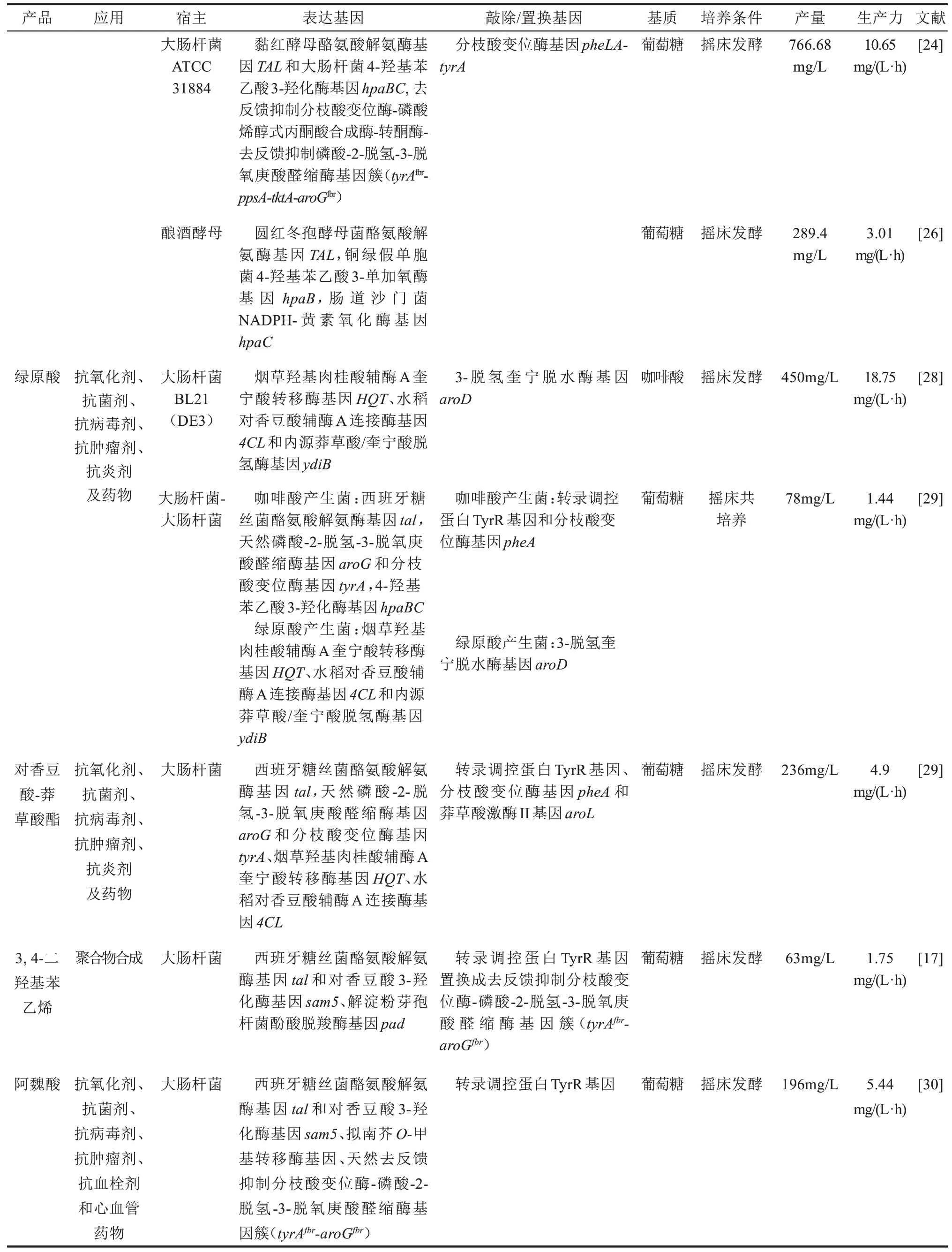
续表

续表

续表
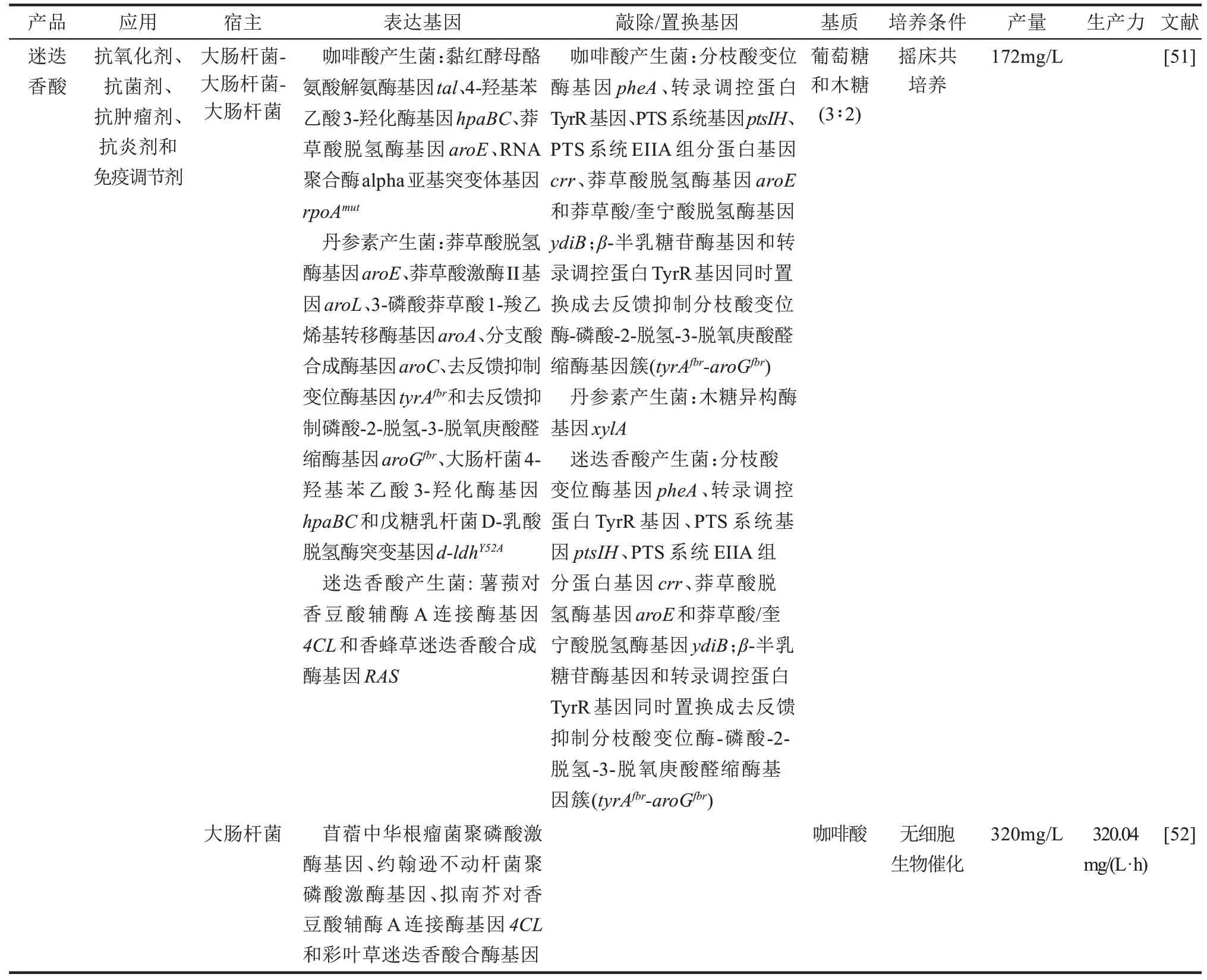
续表
基于传统代谢工程的基因敲除和过表达的静态调控往往会导致代谢通量在各个途径分配的不平衡、有毒中间代谢产物的积累,影响细胞生长,抑制产物的合成。而动态调控能根据胞内外环境的变化自动调控基因表达,协调各个途径的代谢通量分布,优化细胞生长,促进产物的合成。为了避免竞争途径敲除对细胞生长的影响,日本九州大学Hanai团队[55]研发一种代谢拨动开关(metabolic toggle switch)以调控TCA循环与产物的合成。利用这种代谢波动开关对进入TCA循环的柠檬酸合成酶基因gltA与外源合成途径进行了动态调控。在未添加IPTG时,表达gltA而关闭异丙醇合成途径的表达,驱使碳代谢流进入TCA循环供细胞生长;而添加IPTG诱导后,关闭gltA的表达而开始表达异丙醇合成途径,驱使碳代谢流进入异丙醇合成途径。采用这种代谢波动开关使大肠杆菌合成异丙醇的产量和产率,与静态调控相比分别提高了3.7倍和3.1倍。TCA循环同样是苯丙酸类及其衍生物合成的竞争途径和细胞生长的必需途径。利用这种代谢波动开关动态调控TCA循环的策略同样适合于苯丙酸类及其衍生物的合成。山东大学梁泉峰团队[56]采用相同的策略构建了一个代谢波动开关调控莽草酸的降解途径,以促进大肠杆菌莽草酸的合成。要积累莽草酸就必须阻断莽草酸代谢,即敲除莽草酸激酶编码基因,但这样又会导致宿主菌变成营养缺陷菌从而影响细胞生长。为此,他们构建了一个阿拉伯糖诱导的代谢波动开关来动态调控莽草酸激酶编码基因aroK的表达。在没有添加阿拉伯糖时调控装置上的aroK基因得以表达,合成芳香族氨基酸供细胞生长之用;生长到一定时候,添加阿拉伯糖诱导调控装置上的tetR,阻断aroK基因的表达,积累莽草酸。由于苯丙酸类及其衍生物的合成往往采用芳香族氨基酸的营养缺陷株作为宿主菌,因此,这种代谢波动开关策略同样可以用于合成苯丙酸类及其衍生物的人工微生物的创建。但是上述代谢波动开关需要添加诱导剂,对扩大生产不利。群体感应是一种天然的细胞与细胞间通信形式,可根据细胞密度而自动调控下游基因的表达。本课题组[57]研发出了一种同时具有激活和抑制作用的Esa群体感应系统,应用该系统对对羟基苯乙酸合成途径进行了动态调控,使大肠杆菌合成对羟基苯乙酸的产量,与静态调控途径相比提高了46%。美国MIT的Dinh和Prather[58]构建一个含lux和esa双组分的分层群体感应系统,对合成途径和竞争性途径同时进行依赖群体感应的自动上调和下调控制,大幅度提高了大肠杆菌合成柚皮苷和水杨酸的产量。
体内生物传感器能灵敏地识别和实时检测胞内或环境中目标小分子代谢物。体内生物传感器由响应和报告两个系统组成。目前学者报道了许多体内生物传感器,Shi等[59]对体内生物传感器的进展和应用进行了很好的综述。生物传感器在人工微生物创建领域主要用于:①选育高产突变株;②动态调控途径;③选育突变酶;④体内检测。目前报道的芳香化合物生物传感器主要有基于TyrR、OR5P3、TnaC、DmpR、PcaU、TtgR、HucR、ShiR、NahR、XylS、HbpR、QsuR和MarR等转录因子传感器、核糖开关传感器和启动子传感器[59-60]。中国科学院微生物研究所唐双焱团队对HucR进行饱和突变构建了莽草酸[61]、白藜芦醇[62]、阿魏酸和香兰素[63]传感器。最近,该团队[63]通过HucR的饱和突变,构建了一个能同时响应阿魏酸和香兰素、但对后者活性更强的传感器。应用该双功能传感器对由阿魏酸到香兰素的合成途径进行顺序串级动态调控,使大肠杆菌合成香兰素的产量远高于群体感应和静态调控的合成途径。在此顺序串级动态调控系统中,生长初期合成途径在高浓度基质阿魏酸的诱导下开始低水平地表达、合成香兰素;随着香兰素的合成,合成途径的表达受香兰素的高活性反馈诱导而逐渐加强。本课题组何馨[64]应用基于HucR的莽草酸传感器依次从ARTP诱变库和基因组改组(genome shuffling)库中选育出一株改组菌,莽草酸产量提高了91%、生物量提高了36%。Siedler等[65]报道了一个基于枯草芽孢杆菌PadR的对香豆酸传感器,该传感器能灵敏地响应对香豆酸,但对肉桂酸和咖啡酸活性低,而且可应用于大肠杆菌和谷氨酸棒杆菌。
启动子是合成生物学最基本的元件。Mahr等[66]从含2000个大肠杆菌启动子的Alon文库中筛选得到mtr启动子,能响应苯丙氨酸;并应用基于Pmtr的传感器从MNNG诱变的大肠杆菌文库中选育出一株高产苯丙氨酸的突变菌株。中国科学院天津工业生物技术研究所张大伟团队[67]依据酪氨酸运输蛋白基因tyrP的启动子序列设计构建了12个具有不同强度的苯丙氨酸启动子,并利用其中的P8启动子置换产苯丙氨酸大肠杆菌的aroK天然启动子,对aroK进行动态调控,使大肠杆菌合成苯丙氨酸的产量和产率分别提高了36%和22%。
近年来,学者发展了多种反式作用基因表达敲低工具,如合成小分子调控RNA(sRNA)和CRISPR干扰(CRISPRi),以便从全基因组快速筛选出需修饰的靶基因。韩国先进科技学院Lee团队发展了一种称为合成sRNA的技术。该团队[68]合成并分析了抑制88个基因的sRNA对大肠杆菌合成酪氨酸的影响,发现联合对tyrR和csrA进行sRNA调低能大幅度提高酪氨酸产量。随后该团队[69]又应用该技术结合丙酰辅酶A传感器,从大肠杆菌1858个基因的合成sRNA库中筛选得到对14个能促进丙酰辅酶A合成的sRNA,其中对pabA进行sRNA调控使大肠杆菌合成白藜芦醇的产量提高4.2倍。江南大学周景文团队[70]对产柚皮素大肠杆菌的30个竞争途径基因进行了CRISPRi干扰,发现同时对fabF、fumC、fabB、sucC和adhE进 行CRISPRi干 扰可使柚皮素产量提高7.4倍。本课题组沈玉平[71]利用CRISPRi技术对产对羟基苯乙酸大肠杆菌内源的所有76个与NADPH消耗有关基因进行了CRISPRi干扰,发现对yahk和yqjH的抑制增加了NADPH的供给,使对羟基苯乙酸的产量分别提高了67.1%和45.6%。
4 展望
随着代谢工程与合成生物学的发展,虽然已成功构建了一些合成苯丙酸类化合物的工程微生物,并取得了很大进展,但其生产水平与产业化还有很大差距,仍有许多工作需要进行。为了实现苯丙酸类化合物生物制造的工业化生产,除了采用前述用于其他芳香化合物人工微生物创建的合成生物学策略之外,还可从以下几个方面进一步提高人工微生物的生产效率。
(1)提高宿主菌对苯丙酸类化合物的耐受性。大多数苯丙酸类化合物都具有抗菌活性,对宿主细胞具有很强的生长毒性,从而限制了目标产物的合成。实验室适应性进化是提高细胞耐受性最常用的策略。但耐受性提高并不能保证目标产物产量的提高,为此我们提出了一种生物传感器介导的实验室适应性进化技术。利用可以检测目标化合物的生物传感器在经适应性进化获得的耐受菌的突变库中,高通量地选育出耐受性和产量都得到提高的进化菌。本课题组[72]采用这种策略选育出了一株耐2.0%蒎烯、蒎烯产量也提高了77%的大肠杆菌。除此之外,也可过表达全局调控因子或外排泵等运输蛋白[73]。尤其采用全局调控机制工程(gTME)技术,对全局调控因子,如δ因子、cAMP受体蛋白、调控基因irrE和bssS等,进行定向进化以提高宿主菌的鲁棒性。
(2)氧化应激工程可能是苯丙酸类化合物代谢工程的一种新策略。氧化应激是指体内活性氧自由基(ROS)产生与抗氧化间的不平衡,将导致细胞损伤。宿主细胞为了避免受到氧化应激引起的细胞损伤,将诱导包括抗氧化酶在内的氧化应激蛋白的表达,以清除ROS。若人为地对宿主细胞中有关氧化应激蛋白进行抑制,宿主为了避免受到损伤,必然要诱导合成更多的抗氧化剂来清除ROS。本课题组[74]采用这种氧化应激工程策略使大肠杆菌合成虾青素的产量提高了78%。大部分苯丙酸类化合物都具有抗氧化活性,采用这种氧化应激工程的策略可望进一步促进苯丙酸类化合物的合成。
(3)模块共培养工程是代谢工程的一种新策略。该策略将复杂的生物合成长途径理性地分隔成多个途径,将其置于各自合适的宿主细胞中高效表达,然后将不同模块菌进行共培养以实现目标产物的合成。模块共培养工程策略已成功用于一些芳香化合物的合成生物学制造,如红景天苷[75]和白藜芦醇[76]。我们同样成功将模块共培养工程策略用于人工合成大肠杆菌的蒎烯生物制造中。采用模块共培养大肠杆菌合成蒎烯的产量是单菌培养的2.9倍[72]。
(4)系统代谢工程能从系统水平上对细胞进行全局调控,进一步促进目标产物的合成。本课题组[77]前期研究证实了比较组学分析与CRSIPRa/CRISPRi相结合技术能快速地找到目标产物合成的瓶颈,从而进行反向代谢工程,是一种快速发现代谢工程新靶点的高效技术手段。通过对具有不同苯丙酸类化合物合成能力的工程微生物的比较组学分析,挖掘具有显著差异的基因和蛋白,然后采用CRSIPRa/CRISPRi技术确认差异基因/蛋白与表型之间的关系,找到工程微生物合成苯丙酸类化合物的瓶颈,进行反向代谢工程进一步提高人工微生物合成苯丙酸类化合物的产量。本课题组[78-79]采用以组学为核心的系统代谢工程策略对多个人工微生物细胞工程进行了全局调控,大幅度促进了目标产物的合成。

