NOD/SCID小鼠皮下及肾包膜下子宫内膜癌移植瘤模型的实验研究*
黄 燕 ,江 明,杨晓清,张 磊,任 萍,杨颖莉,张玉泉*
(1 南通大学附属医院妇产科,南通 226001;2 南通大学医学院核受体与肿瘤研究实验室;3 南通大学附属医院超声科)
子宫内膜癌是女性生殖道的常见肿瘤,国内发病率逐年上升。因此对子宫内膜癌发病机制的研究及探讨有效的预防治疗手段极为重要。动物模型的建立为研究肿瘤生物学行为及药物试验提供了至关重要的手段。
非肥胖糖尿病/严重联合免疫缺陷(non-obese diabetic/severe combined immunodeficient,NOD/SCID)小鼠是一种严重联合免疫缺陷鼠,不易发生免疫逃逸,是一种目前比较理想的可建立人源化动物模型的小鼠,为肿瘤药物实验治疗提供了极好的体内平台。关于动物模型的建立方法包括皮下接种、肾包膜下种植、原位模型、腹膜种植等[1-5]。皮下接种模型虽然操作简单,肿瘤表浅易于观察,但肿瘤组织血供条件和淋巴引流较差,造成浸润和转移率低。肾包膜下种植具有丰富的血液供应和淋巴引流[6]。目前为止,已使用良性或恶性组织成功建立的肾包膜下模型包括:人子宫内膜癌[7]、人子宫肌瘤[8-9]、前列腺癌[10]、乳腺癌[11]、卵巢癌[12-14]。
为此,选用人子宫内膜癌细胞株Ishikawa[15]和HEC-1-A[16]建立NOD/SCID小鼠肾包膜下及皮下动物模型,为开展子宫内膜癌树突状细胞疫苗的研究治疗提供更好的动物模型。
1 材料与方法
1.1 材料来源
1.1.1 肿瘤细胞系 HEC-1-A:人中分化子宫内膜癌细胞株(美国ATCC),置于含10%胎牛血清的Mc-Coy′s 5a培养液(美国Gibco公司)培养。Ishikawa:人高分化子宫内膜癌细胞株(上海复旦大学),置于RPMI-1640培养液(美国HyClone公司)培养。
1.1.2 实验动物 54只NOD/SCID小鼠购于上海斯莱克动物有限公司,饲养于南通大学实验动物中心无特殊病原体(specific pathogen free,SPF)级屏障环境中[SYXK(苏)2012-0031],均为雌性,8~9周龄,22~25 g。本实验方案经南通大学动物实验伦理委员会批准。
1.1.3 主要试剂 绿色荧光蛋白(green fluorescent protein,GFP)病毒转染试剂购自Cyagen公司,setting solution工作液由本实验室自行配置,胶原蛋白由本实验室经大鼠尾自行提取,三溴乙醇购自美国Sigma公司,小动物成像仪购自美国UVP(BioDoc-It Imager System)。
1.2 动物模型建立
1.2.1 细胞培养 将Ishikawa细胞株和HEC-1-A细胞株分别置于含10%胎牛血清的1640培养液和McCoy′s 5a培养液中,培养、转染GFP,于37 ℃、5%CO2、饱和湿度的培养箱中培养,使其贴壁生长,待细胞铺满瓶底80%时,0.25%胰酶消化,离心后细胞沉淀物使用相应培养基重悬行细胞计数,将所需细胞分别按浓度(1×105、2×105和4×105)再次离心,去上清,备用。大鼠胶原蛋白和setting solution工作液2∶1于4 ℃混匀,将相应细胞用上述混合液(50 μL)重悬,滴入培养皿,于培养箱中静置0.5 h形成固体凝胶后加入培养液,24 h内备用[17]。
1.2.2 皮下移植瘤动物模型的建立 皮下组共18只小鼠,随机分为GFP-HEC-1-A和GFP-Ishikawa,分别按接种细胞浓度分为1×105、2×105和4×105组,每组3只。SPF级屏障环境内,NOD/SCID小鼠使用Avertin(0.5 mL/25 g)腹腔内注射麻醉,消毒小鼠颈背部,以无菌手术器械切开小鼠颈背部皮肤,钝性分离皮下组织,将2个肿瘤细胞胶原蛋白凝胶块(相同浓度)植入双侧背部近腋窝下。缝合皮肤,待小鼠麻醉清醒后置于屏障环境中继续饲养,每天观察其精神活动及饮食等情况,并观察移植瘤的大小及表皮变化等。8周后,将成瘤小鼠处死,使用小动物成像仪拍照,取肿瘤组织,计算肿瘤体积和成瘤率。
1.2.3 肾包膜下移植瘤动物模型的建立 肾包膜组共36只小鼠,随机分为GFP-HEC-1-A和GFPIshikawa,分别按接种细胞浓度分为1×105、2×105和4×105组,每组6只。SPF级屏障环境内,NOD/SCID小鼠Avertin(0.5 mL/25 g)腹腔内注射麻醉,消毒小鼠背部,以无菌手术器械作正中切口1 cm,钝性分离皮下组织,分别切开左、右侧背部肌肉,暴露肾脏,纱布保护肾脏并起固定作用,显微镊于体式显微镜下轻轻夹起肾包膜,将制备好的肿瘤细胞胶原蛋白凝胶块小心植入小鼠肾包膜下,将肾脏还纳腹腔,逐层缝合(图1)。待小鼠麻醉清醒后置于屏障环境中继续饲养。8周后,将成瘤小鼠处死,使用小动物成像仪拍照,取肿瘤组织,计算肿瘤体积和成瘤率。
1.3 肿瘤组织病理及实时荧光定量(real time-polymerase chain reaction,RT-PCR)检测 对肿瘤组织进行肉眼观察,并使用4%甲醛固定后制作石蜡切片,进行HE染色,观察其病理学改变及侵犯程度。通过免疫组化检测雌激素受体(estrogen receptor,ER)α、ERβ 和Ki-67在肿瘤组织中的表达水平。并使用RT-PCR检测肿瘤组织中ERα 和ERβ 的mRNA表达情况(表1)。
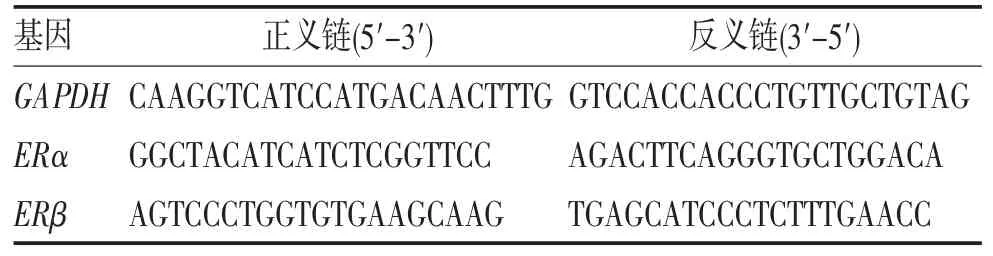
表1 RT-PCR引物序列
1.4 统计学方法 动物模型肿瘤体积计算公式:肿瘤体积=1/2×A×B2(A,长;B,宽)[6],成组数据以表示,组间比较采用秩和检验(Mann-Whitney U test)分析。RT-PCR采用t检验分析。P<0.05为差异有统计学意义。分别采用SPSS 19.0、Sigma Plot 12.5、Adobe Photoshop CS5作为统计与作图软件。
2 结果
2.1 GFP转染肿瘤细胞形态观察及体外生长曲线测定 采用倒置相差显微镜观察经GFP转染的Ishikawa(图2A)和HEC-1-A(图2B)细胞,24 h后即可见荧光标记的细胞,72 h后荧光强度明显增强。细胞形态与未转染细胞无明显区别。对未经转染和转染GFP的细胞分别取第15代测其生长曲线,数据显示转染GFP后对细胞生长无明显影响(图2C)。
2.2 不同种植部位实验结果 采用3种不同的细胞浓度(1×105、2×105和4×105)分别建立Ishikawa皮下组、Ishikawa肾包膜组、HEC-1-A皮下组及HEC1-A肾包膜组。各组小鼠接种结果如表2。随着肿瘤细胞浓度的升高,肿瘤体积逐渐增大,具有剂量依赖效应(图2D)。Ishikawa皮下组及HEC-1-A皮下组分别于移植后3周及10 d内均可于表皮触及圆形或椭圆形,表明光滑,位置固定的实性瘤体。8周后,所有小鼠采用脱颈椎处死,如图3A所示,皮下移植瘤呈圆形或类圆形,质中,外侧被覆不完整结缔组织包膜,界限清楚,切面均匀一致,呈灰白色,部分见腺腔样结构。肾包膜组可见瘤体呈类圆形或不规则实体状,黄白色,隆出肾脏表面,部分嵌入肾实质,与腹膜及肝脏黏连严重(图3B)。荷瘤小鼠约35 d后出现明显消瘦,活动力及反应力下降,但均能存活至8周。8周后,所有小鼠被处死并放入IVIS LuminaⅡ型生物发光荧光小动物活体成像系统仓内,进行荧光激发后显示肿瘤部位表达绿色荧光,所有小鼠均未出现肿瘤远处转移(图3C)。
采用皮下接种Ishikawa细胞,当细胞浓度是1×105时,成瘤率为33.3%,当细胞浓度是2×105和4×105时,成瘤率均为66.7%。将1×105个细胞接种于肾包膜下,8周后处死小鼠时未见肿瘤形成,而细胞浓度调整为2×105时,成瘤率为33.3%,细胞浓度为4×105时,成瘤率为50%。尽管皮下组与肾包膜组数据无统计学意义(P=0.161),且肾包膜成瘤体积比皮下组稍小,但如图2D所示,随着肿瘤细胞浓度增加,成瘤率及肿瘤体积均逐渐增加。
使用HEC-1-A建立动物模型,其成瘤率均为100.0%,且肾包膜组明显优于皮下组(P=0.047),4×105是最适合的建模浓度(分别与细胞浓度为1×105和2×105相比,P=0.010、0.012)。
表2 皮下及肾包膜下移植瘤体积比较()
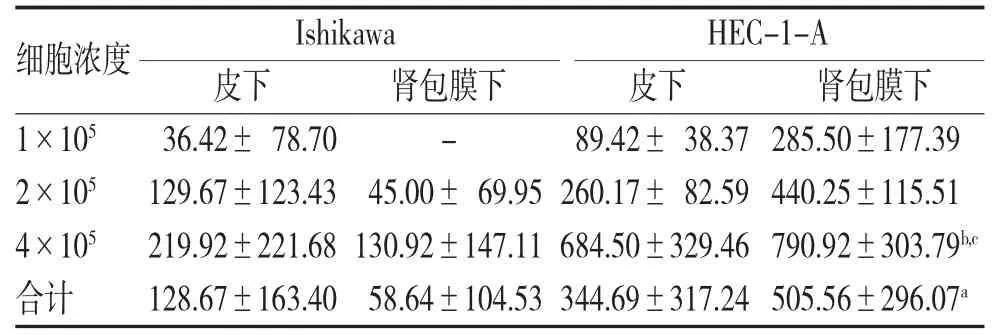
表2 皮下及肾包膜下移植瘤体积比较()
注:不同浓度下肿瘤体积比较。与HEC-1-A皮下组比较,aP<0.05;与HEC-1-A 1×105 组比较,bP<0.05;与HEC-1-A 2×105 组比较,cP<0.05。
2.3 组织病理学检测 制成HE切片后,光镜下观察可见Ishikawa组瘤细胞均匀一致,类圆形或多边形,胞浆丰富嗜酸性,核分裂象少,皮下组未见腺管结构形成,其肾包膜组可见腺管样结构形成(图4A~B)。HEC-1-A组瘤细胞排列紊乱,核大深染,可见核分裂象,皮下组及肾包膜组未见腺管样结构形成,这可能与该细胞株恶性程度较高有关(图4C~D)。肾包膜组均可见肿瘤细胞不同程度的侵犯基底膜,转移至肾脏(图4B、D)。卵巢、子宫、肝脏、脾脏及肺均未见明显癌细胞浸润。
抗体ERα、ERβ 和Ki-67免疫组化染色后,肿瘤细胞核内或核膜出现棕黄色颗粒是ERα、ERβ 阳性,肿瘤细胞核内出现棕黄色颗粒是Ki-67阳性。Ishikawa组ERα 呈阳性表达,ERβ 呈弱阳性表达(图4E~F),HEC1-A组ERα 和ERβ 呈弱阳性表达(图4H~I),Ki-67均呈阳性表达(图4G、4J)。
2.4 RT-PCR检测 测定移植瘤组织ERα 和ERβ的mRNA含量,结果表明Ishikawa中ERα和ERβ 的含量均显著高于HEC-1-A(PERα=0.007 7,PERβ=0.009 0)(图5)。
3 讨论
目前子宫内膜癌的动物模型主要包括诱发性肿瘤模型和移植性肿瘤模型。移植瘤动物模型的建立方法包括皮下注射法、皮下种植、原位种植等。考虑小鼠相应器官与人器官微环境的相似性,原位模型的建立能更好地反映人子宫内膜癌的生长环境,模拟其生物学行为,但小鼠子宫宫腔与外界是相通的,若肿瘤细胞从阴道流失,则模型建立失败,或者肿瘤细胞从子宫远端流出,会导致腹腔内广泛种植。因此,本实验选择了肾包膜下和皮下建立动物模型。
而与皮下动物模型相比,肾包膜下可更精确地反映肿瘤细胞的生物学行为。本研究采用子宫内膜癌细胞株建立了NOD/SCID肾包膜下移植模型。之前的研究[7-9,11-12,17]表明,将肿瘤细胞接种于免疫缺陷小鼠的肾包膜下可形成肿瘤,并可见肿瘤转移,故该模型对研究新型的抗肿瘤药物较为理想。首先,肾包膜下对移植瘤具有丰富的血液供应;其次,肾包膜下成瘤可见腺癌有腺腔样结构形成;第三,肿瘤细胞突破基底膜,转移至肾脏。从实验技术方面来说,肾包膜种植需要熟练的实验技巧,且操作过程均需要在显微镜下完成,肾包膜极其透薄脆弱,若操作过程中损伤肾实质,则会导致肾脏的大出血。故肾包膜下建模具有一定的难度。
建立模型时还需要考虑细胞株的选择、细胞数量的确定以及观察时间的确定。本实验选取了Ishikawa和HEC-1-A两种细胞株,均来源于人子宫内膜腺癌,且已被广泛使用。目前多项研究[18-19]采取新鲜手术组织或原代培养细胞建立了人子宫内膜癌动物模型,但原代组织量少及不易获得并不适合建立动物模型用于生物学治疗评估,而且永生化细胞系已具有稳定特性,而原代培养细胞的特性是否能永生化不可知。Ishikawa,高分化人子宫内膜癌细胞株,ER表达阳性;HEC-1-A,中分化人子宫内膜癌细胞株,ER表达阴性,但少数学者[20-21]提出HEC-1-A表达野生型ER。为此本研究采用免疫组化和RTPCR测定移植瘤中ERα 和ERβ 的表达量,结果表明Ishikawa表达ERα、ERβ 相对较低,HEC-1-A也有ERα 的表达,但ERβ 表达极低,证实其基本保留了原始细胞系的基因差异。
ER是研究子宫内膜癌的一个重要的预后因素,包括ERα 和ERβ 两种亚型,为经典的核受体,二者结构相似。子宫内膜癌是激素依赖性肿瘤,与雌激素有密切关系。与正常的子宫内膜组织相比,恶性子宫内膜组织中ERα/ERβ 比例下调[22-25]。另有研究[24-26]表明ERβ 与子宫内膜癌的肌层浸润有密切关系。部分研究[25]表明在低级别子宫内膜癌中,ERα 表达相对较多;而在高级别病变中,ERβ 表达更占优势。尽管ERα 和ERβ 均与子宫内膜癌的预后有密切关系,然而迄今为止其内在联系仍然是未知的。因此我们选取了Ishikawa和HEC-1-A两种细胞株,为ER亚型研究提供可靠的动物模型。
细胞数量的确定是建立动物模型的另一个至关重要的问题,一般来讲,细胞数量越多,肿瘤生长越快。故本实验中选取了3种不同的细胞浓度以探索合适的细胞浓度,结果表明,在Ishikawa组,尽管肾包膜组与皮下组没有统计学意义,细胞数量为4×105时肿瘤生长最快;在HEC-1-A组肾包膜组明显优于皮下组,也是细胞数量为4×105时肿瘤生长最快。研究[27]指出,将肿瘤细胞与胶原蛋白混合后进行移植可以提高肿瘤细胞分化及血管形成,以往研究[28]多采用人工重构基底膜材料,而本研究将大鼠尾部提取的胶原蛋白与肿瘤细胞混合,形成凝胶。与以往采用细胞悬液注射法相比,避免了液体流动干扰,造成人为肿瘤转移,且保证了细胞数量的精确性。
综上所述,采用高浓度HEC-1-A肿瘤细胞与胶原蛋白混合后建立NOD/SCID小鼠肾包膜下移植模型具有一定的优势。首先,肾包膜移植法较原位移植法更易实现,且同样为肿瘤生长提供了微环境,包括肿瘤细胞、肿瘤相关纤维细胞、细胞外间质等,可作为信号通路和生长因子的研究模型;其次,肾包膜下具有丰富分血液供应和淋巴引流,除了可为肿瘤生长提供良好的营养环境,还可对移植瘤小鼠模拟给药途径,研究抗癌药物在癌症发展过程中的疗效,故肾包膜下移植瘤模型常用于评价肿瘤对药物的敏感性。皮下建模似乎更适合Ishikawa,是目前最常用的建模方法,采用高浓度Ishikawa肿瘤细胞与胶原蛋白混合接种,易于操作,且可清楚观察肿瘤的形成过程。
本实验建立的人子宫内膜癌NOD/SCID小鼠动物模型,为研究子宫内膜癌的发生发展提供了新的平台,特别是为探索人子宫内膜癌治疗手段及药物评估提供了良好的动物模型,具有较广的应用前景。

