2019年FDA批准新药中孤儿药分析
周冲,刘军田,肖杰
(山东省食品药品审评认证中心,山东 济南 250014)
罕见病(rare disease)又称孤儿病,是指患病率极低的疾病。世界卫生组织(WHO)将罕见病定义为患病人数占总人口0.65‰~1‰的疾病或病变。不同国家或地区通常根据患病人群的比例或总数来制定罕见病的认定标准[1-2]。目前,我国尚无关于罕见病的官方定义,2010年中华医学会医学遗传学分会建议将患病率低于五十万分之一或新生儿发病率低于万分之一的遗传病定义为罕见遗传病。以我国14亿人口的基数,这也是一个相对比较庞大的病患人群。
目前我国对于罕见病相关政策的制定仍处于相对初始阶段,但国家和社会对罕见病的关注和重视程度不断提高。2017年2月,国务院印发《“十三五”国家药品安全规划》,提出鼓励针对罕见病的有临床价值的新药和临床急需仿制药研发上市,实行优先审评审批,保证罕见病用药的市场供应。2020年2月25日,中共中央、国务院印发了《关于深化医疗保障制度改革的意见》,提出探索罕见病用药保障机制。孤儿药(orphan drug)是指用于诊断、预防和治疗罕见病或罕见状态的诊断试剂、疫苗、药物、医疗器械等。笔者对2019年美国食品药品监督管理局(FDA)批准的新药的基本情况、新药与孤儿药的优先审批权、病例数等进行了分析对比,以期为我国罕见病政策的制定和相关药品的研发提供思路。
1 基本情况
2019年FDA共批准了48个新药(即NMEs),该数量仅次于2018年的59个,位居1983年以来批准数量的第二名[3-6]。48个新药中,孤儿药有21个,占43.8%。
美国是最早建立罕见病和罕见病用药管理制度的国家,并制定了一系列法案等鼓励孤儿药的开发。FDA对孤儿药的扶持政策也使近年孤儿药的审批数量逐年增加[3,7-8],近几年FDA批准的新药中孤儿药均达到40%左右,在2018年更是达到了57%。笔者对近5年以来获批的新分子实体数量、孤儿药数量及孤儿药占比进行了分析汇总(见图1)。
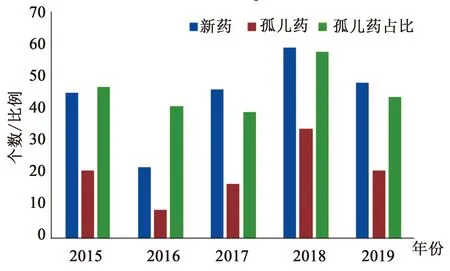
图1 2015—2019年FDA批准新药、孤儿药数量及孤儿药占比
2 孤儿药审批情况
2.1 孤儿药与新药获得优先审批权情况对比 目前,除标准审查(standard review)(药物的治疗性质与已上市药物相似的适用标准审查方式)外,FDA还有4种非常有效的新药优先审批方式:优先审查(priority review)、突破性治疗(breakthrough therapy)、加速审批(acceleratedapprova1、快速通道(fast track)[9]。2019年FDA获批的孤儿药获得优先审批权的比例远远高于新药中平均比例,且正常审批的比例远低于新药中平均水平,体现了FDA在审批过程中对孤儿药的政策倾斜。笔者对比了新药和孤儿药中获得优先审批权的数量及比例,见下表1。

表1 2019年FDA批准新药、孤儿药获得优先审批权情况汇总
2.2 孤儿药获得优先审批权情况汇总分析 优先审批政策可以缩短孤儿药研发阶段时间,使患者能够早日用上有效药物,并有利于制药企业更快地收回研发成本,提高其新药研发积极性。2019年FDA批准的48个新药从正式接收到最终批准,走正常审批程序的品种有18个,平均用时15.2个月(按从受理到正式批准计算,下同)(Fluorodopa F 18和Nourianz这两个品种审批时间均在10年以上,如果不计算在内的话,其余品种平均审批时间为10个月)。而21个孤儿药中,只有两个品种是走正常审批程序,其余均不同程度获得了优先审批权,平均审评时间为8.1个月,审评时间在8个月及以下的有15个品种,占全部孤儿药品种的71.4%;审批时间最短的罕见病儿科用药Trikafta,更是在3个月内完成审批。
2019年批准的21个孤儿药中,获得3种优先审批权的品种有6个,两种优先审批权的品种有4个,充分体现了FDA在孤儿药的审批上给予的优惠政策。各孤儿药品种获得的优先审批权具体见表2。

表2 孤儿药品种获得的优先审批权情况
2.3 孤儿药病例数等情况分析汇总 FDA不止在上市申请中给予孤儿药诸多优先审批权,在临床试验中孤儿药也可以采用较为宽松的试验设计[10]。笔者对FDA公布新闻稿(press release)的孤儿药品种和其他新药品种临床数据,如适应证、病例数进行对比分析(见表3),孤儿药的病例数明显少于其他新药:纳入统计的15个孤儿药品种的平均病例数为205.6,14个新药品种的平均病例数为1 690.1。孤儿药中只有治疗囊性纤维化的Trikafta病例数在500例以上,其余品种的病例数均在500以下,获得罕见儿科疾病优先审查证书(rare pediatric disease priority review voucher program)的治疗杜氏肌营养不良的Vyondys 53更是只有25例病例即获得批准。其他新药中只有治疗乳腺癌的Enhertu、治疗尿路上皮癌的Padcev和治疗膀胱癌的Balversa获得了突破性治疗的优先审批权,病例数在200例以下,其余品种的病例数均在500左右甚至1 000以上。罕见病患者人数较少,临床试验寻找病例的难度增加,成本提高;通过科学评估孤儿药的临床试验,进行合理试验设计,在不降低安全性、有效性的前提下,适当降低孤儿药的临床试验病例数,在临床阶段可能是一个切实、可行的方法。

表3 部分孤儿药品种病例数等情况

表3(续)
2.4 孤儿药研发企业分析 孤儿药的研发投入成本巨大,可能需要研发团队几年甚至几十年的资金投入。近年来发达国家孤儿药的审批数量逐年增加,开发孤儿药已成为大型制药企业重要的发展策略[10]。笔者对21个2019年新批准孤儿药的生产企业进行统计分析(见表4),发现Novartis、Genentech、Daiichi Sankyo、Vertex这样的制药巨头开始加入孤儿药新药的研发的行列。

表4 2019年孤儿药获准生产企业汇总
3 建议
目前我国的罕见病政策还在探索阶段,尚未立法。笔者对2019年FDA批准新药中孤儿药进行统计分析,旨在详细了解FDA对孤儿药的审批提供的优惠政策,同时为我国制定适合我国国情的孤儿药政策提出以下建议。
3.1 国家重视,政策引导 建议根据我国国情制定罕见病相关的优惠政策,并写入相关法律法规,为孤儿药的研发提供良好的环境。如:鼓励制药企业与医疗单位、跨国企业沟通,为制药企业与科研机构的研发合作创造平台;同时政府给予适当的政策优惠、补贴,使企业研发成本降低等。
3.2 开发经典,古方今用 罕见病在我国古代是中医“疑难杂症”的一部分[11],建议发挥中医中药的作用,如开展国家中医中药开发计划,建立国家平台,集合相关中医药专家的力量开发经典古方中治疗疑难杂症的药方,古方今用。
3.3 提供优惠,让利于民 适当参考欧美国家的一些经验,制定适合我国国情的政策,适当给予孤儿药研发企业在审评审批或税费等方面的优惠,如:对符合条件的孤儿药可给予优先审评审批或者附条件批准;孤儿药的部分研发费用可作为税费减免;根据发病率等情况分析,在保证药品安全、有效的前提下,适当减少临床试验例数等。
3.4 多措并举,细化政策 笔者对比、查阅了2019年FDA批准的21个孤儿药新药,在2018年《第一批罕见病目录》中的很少。建议针对欧美新批准的孤儿药适当实行注册进口、税费优惠政策,使我国的相关病患能够及早用上国外新批准的孤儿药。目前,国外已经确认的罕见病有7 000多种,我国的罕见病认定工作还有很长的路要走,扩大罕见病目录范围,可以使更多药物能享受到孤儿药审评审批的福利,更重要的是使更多患者有药可用。罕见病病例中,因病致贫、因病返贫的病例非常常见,适当提高孤儿药的医保报销比例,可以减轻罕见病患者的经济负担。
4 讨论
国家和社会对罕见病的关注和重视程度不断提高[12],例如国家药品监督管理局于2020年3月30日发布的《药品注册管理办法》(2020年7月1日起施行)中专门对“药品加快上市注册程序”的4种情形进行了明确规定,其中就包括了对治疗罕见病的药物可采取优先审评审批的政策。我国孤儿药的研发还处于起步阶段,以我国14亿人口的基数来计算,孤儿药在我国将有巨大的市场。笔者希望能够通过以上分析研究,为国家相关政策的制定和罕见病药物研发提供一些思路,同时建议我国尽早出台符合我国国情的孤儿药研发、税费、医保等方面的政策,推动我国孤儿药产业的快速、长远发展,造福罕见病患者。

