高粱抗病基因SbSGT1的克隆及原核表达
陈美晴 陈 俊 蒋君梅 王营锴 屈志广 方远鹏 任明见 谢 鑫
(1贵州大学农学院,贵州 贵阳 550025;2国家小麦改良中心贵州分中心,贵州 贵阳 550025)
高粱[Sorghum bicolor(L.) Moench]是一种重要的耐旱禾本科植物,在中国已有近两千年的种植历史[1-2],是我国最早栽培种植的禾谷类作物之一。高粱具有较强的抗旱、耐涝、抗盐碱的抗逆境特性和对环境的强适应性,属于高产稳产的作物,也是饲料、酿酒、生产生物燃料以及造纸的重要原料[3-5]。但近年来,随着种植规模的不断扩大,各种病害对高粱的危害也越来越严重[6-7]。研究表明,植物可以通过启动其抗病基因,改变体内的生理生化途径来抵抗病原菌的侵染[8-11]。因此,运用分子生物学技术对高粱重要抗病基因进行研究,对培育优良高粱抗病品种具有重要意义。
SGT1(suppressor of G-Two allele of skp1)基因最早在酵母中发现[12]。研究报道,SGT1 基因起着正调控植物抗病性的作用[13]。SGT1 基因沉默或突变会导致多种植物R基因介导抗病性的丧失,相反,超表达SGT1 基因则会增强植物的抗病性[13-15]。此外,SGT1还参与调控植物的非宿主抗性[16-19]。同时,SGT1 是植物抗病反应过程中的信号转导调控基因和防卫反应信号中的重要组件[20]。植物SGT1 蛋白的氨基酸序列包含5 个结构域:1 个重复结构域TPR、2 个可变区(VR1 和VR2)、1 个CS 基元以及1 个SGS 基元,其中TPR、CS、SGS 为保守区域。目前,人们已在水稻[21]、拟南芥[22-23]、大豆[24]、甘薯[25]、烟草[26]、中间偃麦草[27]、茄子[28]、甘蓝[29]、小麦[30]等植物中克隆了SGT1 基因,但鲜见SGT1 基因在高粱中研究报道。
本研究在高粱品种BTx236 中克隆得到1 个SGT1基因,并将其命名为SbSGT1。通过对SbSGT1 序列进行生物信息学系统分析,构建其原核表达载体pET-28a-SbSGT1,对蛋白可溶性表达条件进行优化,并采用Western blot 对所表达的蛋白进行鉴定,以期为抗病高粱品种改良提供参考。
1 材料与方法
1.1 试验材料
1.1.1 供试植物 高粱品种BTx623,由中国科学院植物研究所景海春老师馈赠。取健康的高粱种子于室温下在清水中浸泡24 h 催芽,然后将其播种于灭菌营养土中,25℃光照/黑暗交替12 h 培养10 d。取整株材料用液氮速冻,置于-80℃超低温冰箱保存备用。
1.1.2 菌株和质粒 大肠杆菌BL21(DE3)、JM109(DE3)和Rosetta(DE3)感受态细胞均购自上海唯地生物技术有限公司;中间载体pEASY-Blunt 购自北京全式金生物技术有限公司;大肠杆菌DH5α 感受态细胞,原核表达载体pET-28a 由贵州大学植物病理教研室保存。
1.1.3 试剂、酶及抗体 RNA 提取试剂盒购自天根生化科技(北京)有限公司;反转录试剂盒购自普洛麦格(北京)生物技术有限公司;蛋白质分子量标准品购自赛默飞世尔科技(中国)有限公司;异丙基-β-D-硫代吡喃半乳糖苷 (isopropyl-beta- Dthiogalactopyranoside,IPTG)以及聚丙烯酰胺凝胶电泳(sodium dodeylsulphate polyacylamide gel electrophoresis,SDS-PAGE)有关试剂(过硫酸铵、四甲基乙二胺、丙烯酰胺、亚甲基双丙烯胺)均购自生工生物工程(上海)股份有限公司;FastPfu 高保真酶购自北京全式金生物技术有限公司;限制性内切酶、T4 DNA连接酶等均购自赛默飞世尔科技(中国)有限公司;一抗Anti His 和二抗Goat Anti-Mouse IgG(H+L)-HRP 购自北京华大蛋白质研发中心有限公司。
1.2 试验方法
1.2.1 高粱总RNA 提取及cDNA 的合成 取保存的高粱BTx623 品种材料,利用RNA 提取试剂盒提取苗期总RNA,并在RNA 中加入适量DNase Ⅰ消化RNA中残留的DNA,参考Promega 反转录试剂盒说明书,以总RNA 为模板反转录得到cDNA。
1.2.2SbSGT1 基因的克隆 根据已报道的水稻SGT1 基因(基因号为LOC_Os01g43540)的蛋白序列,利用BLASTP 搜索高粱基因组数据库(https:/ /phytozome)找到高粱同源基因SbSGT1(基因号为Sb03g028430)。根据其核酸序列设计引物,以SbSGT1-F: GCGAATTCATGGCCGCGTCGGATCT(下划线为限制性核酸内切酶EcoRⅠ酶切位点)和SbSGT1-R: CGCTCGAGTTAGTATTCCCACTTCTTGAGCT(下划线为限制性核酸内切酶XhoⅠ酶切位点)为引物对SbSGT1 基因进行扩增。
PCR 反应体系(50 μL): FastPfu Fly DNA Polymerase 1 μL、5×buffer 10 μL、2.5 mmol·L-1dNTPs 4 μL、cDNA 模板1 μL、10 μmol·L-1上下游引物各1 μL,ddH2O 32 μL。PCR 扩增程序:95℃预变性2 min,95℃变性20 s,58℃退火20 s,72℃延伸1 min,循环35次。采用1%琼脂糖对PCR 产物进行检测。PCR 产物经切胶回收、纯化后,连接到pEASY-Blunt 克隆载体。连接产物通过热激法转化至大肠杆菌DH5α 感受态细胞,转化产物涂布于含有抗生素的LB(Luria-Bertani)平板上,37℃过夜培养后,挑选单克隆送至北京擎科生物科技有限公司测序。
1.2.3 序列的生物信息学分析 在 NCBI 的Genebank 数据库中下载SGT1 相关物种的同源序列,利用DNAMAN 软件中的Homology Tree 构建不同植物的SGT1 蛋白系统进化树,并将这些物种的同源SGT1蛋白进行氨基酸序列比对;采用Protparam(http:/ /web.expasy.org/protparam/)预测SbSGT1 蛋白的基本理化性质;利用Protscale (http:/ /web. expasy. org/protscale/)预测SbSGT1 蛋白的亲水性及疏水性;使用在线网站(http:/ /www.softberry.com/cgi-bin/programs/proloc/protcompan.pl)进行蛋白的亚细胞定位。分别使用MLRC(https:/ /npsa-prabi.ibcp.fr/cgi-bin/secpred_mlr.pl)和SWISS-MODEL(http:/ /swissmodel. expasy.org/)预测SbSGT1 蛋白的二、三级结构;采用TMHMM Server(http:/ /www. cbs.dtu.dk/services/)对SbSGT1蛋白质跨膜区进行预测分析。
1.2.4 pET-28a-SbSGT1 重组质粒的构建 以1.2.2中扩增正确的SbSGT1 基因为模板,采用酶切连接的方法进行重组载体的构建。酶切体系(50 μL):10×buffer 5 μL、EcoRⅠ1 μL、XhoⅠ1 μL、质粒5 μL(约1 μg),ddH2O 38 μL。酶切产物经电泳鉴定,用琼脂糖凝胶试剂盒回收。回收后的产物通过T4 DNA 连接酶连接到经相同双酶切的pET-28a 表达载体中,16℃连接16 h,构建pET-28a-SbSGT1 重组质粒。
1.2.5 高粱SbSGT1 蛋白的可溶性表达 首先通过热激法将重组质粒pET-28a-SbSGT1 分别转化到大肠杆菌表达菌株BL21(DE3)、JM109(DE3)和Rosetta(DE3)中,以0.8 mmol·L-1IPTG、25℃、10 h 诱导表达。收集6 mL 菌液,12 000 r·min-1离心2 min,向菌体加入400 μL 裂解液[50 mmol·L-1Tris(pH 值7.5)、1 mmol·L-1EDTA、100 mmol·L-1NaCl、1 mg·mL-1lysozyme、1% Triton X-100 以及蛋白酶抑制剂],用超声破碎仪(vex130,美国Sonics 公司)进行细胞破碎,12 000 r·min-1离心10 min,分别取上清和沉淀,加入5×Loading Buffer(上样缓冲液) 煮沸5 min,12 000 r·min-1离心2 min,取上清液用12% SDS-PAGE 电泳检测目标蛋白的表达情况,从而确定最佳表达菌株。同时分析不同诱导温度(16、20、25、30、37℃)、IPTG 浓度(0.4、0.6、0.8、1.0 mmol·L-1)对上述最佳表达菌株SbSGT1 蛋白表达的影响。
1.2.6 重组蛋白的Western blot 检测 采用湿法转印进行Western blot 试验,具体步骤如下:原核表达的高粱SbSGT1 蛋白样品经过SDS-PAGE 电泳、聚偏氟乙烯膜(polyvinylidene fluoride,PVDF)转膜后,用5%的脱脂奶粉封闭2 h,用Anti His 抗体室温孵育2 h,随后用1 × 吐温20 磷酸盐缓冲液(phosphate buffered solution tween-20,PBST)缓慢洗涤4 次,每次5 min;加入二抗室温孵育1 h,1×PBST 缓慢洗涤4 次,每次5 min,弃去二抗;在PVDF 膜上加入辣根过氧化物酶(horseradish peroxidase,HRP)化学发光底物液,在天能5200 化学发光检测仪(上海天能科技有限公司)上检测蛋白表达信号。
2 结果与分析
2.1 高粱抗病基因SbSGT1 的克隆
以高粱BTx623 幼苗总RNA 反转录的cDNA 为模板,以高粱基因组数据库(https:/ /phytozome) 的SbSGT1 基因序列为参考,用Primer Premier 5.0 设计的SbSGT1-F/SbSGT1-R 引物对进行PCR 扩增,扩增得到序列为1 095 bp 的目的基因,共编码364 个氨基酸。采用1%琼脂糖凝胶电泳对获得的PCR 产物进行检测,得到的条带大小与数据库中的一致(图1)。
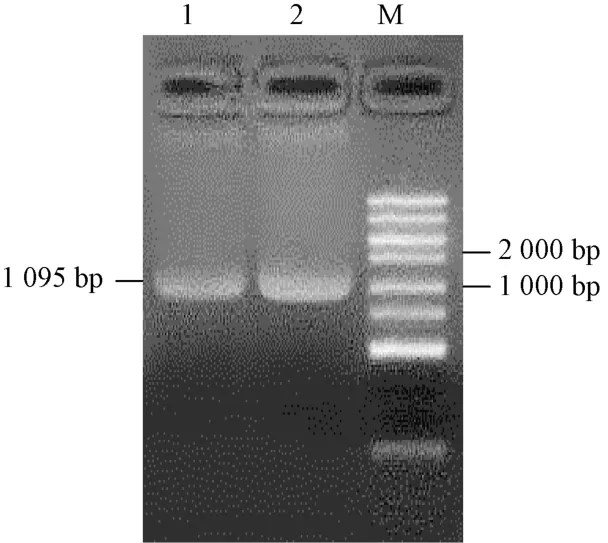
图1 SbSGT1 基因的PCR 扩增Fig.1 PCR amplification of SbSGT1 gene
2.2 生物信息学分析
2.2.1 SbSGT1 蛋白质序列同源性分析 在NCBI 比对下载SGT1 在其他物种的同源序列,与高粱SbSGT1 进行序列同源性分析。由图2可知,SbSGT1 与玉米(Zea mays)同源性为94.87%,与水稻(Oryza sativa)的同源性为85.75%,与大麦(Hordeum vulgare) 的同源性为83.24%,与小麦(Triticum aestivum) 的同源性为81.82%,说明SGT1 在这几种植物中都相对保守。

图2 SbSGT1 与其他物种的同源氨基酸序列比对Fig.2 Amino acids alignment between SbSGT1 and other species
2.2.2 SbSGT1 基因系统进化树分析 为进一步研究SbSGT1 与其他植物SGT1 的进化关系,使用DNAMAN软件中的Homology Tree 构建不同植物的SGT1 系统进化树,结果表明,SbSGT1 与玉米的亲缘关系最接近,为95%,与水稻的亲缘关系也较接近,为86%,与麦类的亲缘关系为84%,暗示与其具有相近或者相似的功能;而该基因与马铃薯、蓖麻、胡杨等其他植物的亲缘关系较远(图3)。
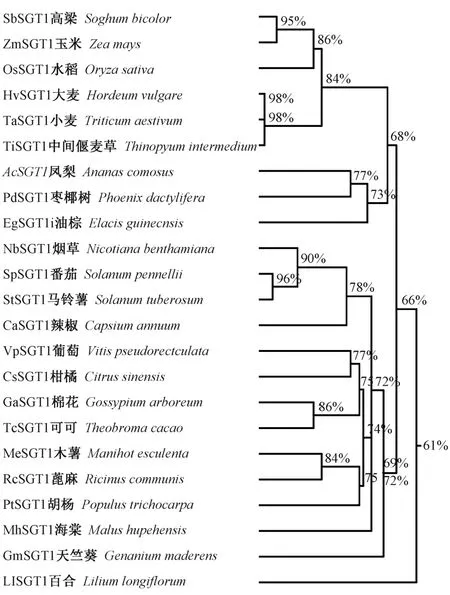
图3 SbSGT1 与其他物种的SGT1 系统进化树Fig.3 Phylogenetic tree of SbSGT1 and other species SGT1
2.2.3 SbSGT1 蛋白的基本理化性质分析 用Protparam 对SbSGT1 蛋白进行基本理化性质分析,由表1可知,SbSGT1 编码364 个氨基酸,分子量为40 441.52,蛋白质理论等电点为5.0,带负电荷的残基总数(Asp +Glu)为65,带正电荷的残基总数(Arg +Lys)为50,该蛋白中酸、碱性氨基酸组成比例和理论等电点显示两者均呈弱酸性。不稳定指数为41.19,说明该蛋白不稳定;脂溶指数为69.81,说明该蛋白有较好的脂溶性。用Protparam 分析得到该蛋白的亲水性的平均值(grand average of hydropathy,GRAVY)为-0.617,与Protscale 分析结果一致,该蛋白为亲水性蛋白(图4)。

图4 SbSGT1 蛋白的亲疏水性预测分析Fig.4 Prediction and analysis of hydrophobicity of SbSGT1 protein
2.2.4 SbSGT1 蛋白的亚细胞定位及二、三级结构分析 用Softberry-Protcomp 分析SbSGT1 蛋白的亚细胞定位,结果显示SbSGT1 蛋白可能定位于细胞质中。用MLRC 对SbSGT1 蛋白的二级结构进行预测分析,由图5可知,SbSGT1 蛋白的二级结构中α 螺旋占43.41%、延伸链占10.71%、无规则卷曲占45.88%。用SWISS-MODEL 预测SbSGT1 蛋白的三级结构,发现SbSGT1 与来自拟南芥(Arabidopsis thaliana)的5 型丝氨酸/苏氨酸蛋白磷酸酶的晶体结构模型覆盖率为38.14%,三级预测结果与二级预测结果一致(图6)。

表1 SbSGT1 蛋白的基本理化性质Table1 Basic physical and chemical parameters of SbSGT1 protein
2.2.5 SbSGT1 蛋白信号肽及跨膜区预测分析 为确定SbSGT1 蛋白是否存在信号肽,用SignalP 5.0 对其进行预测。由图7可知,SbSGT1 蛋白不存在信号肽剪切位点。用TMHMM Server 对SbSGT1 蛋白进行蛋白质跨膜区进行预测,预测结果显示SbSGT1 蛋白无跨膜区,为非膜蛋白(图8)。
2.3 pET-28a-SbSGT1 原核表达载体的构建
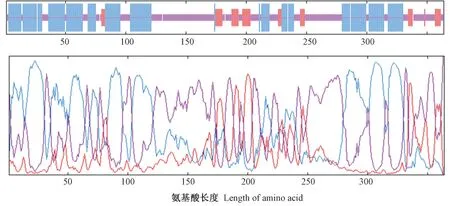
图5 SbSGT1 蛋白的二级结构预测Fig.5 The secondary structure prediction of SbSGT1 protein
将2.1 中PCR 克隆得到的SbSGT1 扩增产物与原核表达载体pET-28a 分别采用EcoRⅠ和XhoⅠ进行酶切,回收酶切产物,将酶切产物进行连接,连接产物转化大肠杆菌感受态细胞,并进行筛选、鉴定。由图9可知,pET-28a-SbSGT1 融合表达载体经EcoRⅠ/XhoⅠ双酶切后,得到一条约1 kb 的条带,表明SbSGT1 已成功构建到pET-28a 载体上。

图6 SbSGT1 蛋白的三级结构预测Fig.6 The tertiary structure prediction of SbSGT1 protein
2.4 SbSGT1 蛋白的诱导表达
2.4.1 SbSGT1 表达菌株的分析 将重组质粒pET-28a-SbSGT1 分别转化到BL21(DE3)、Rosetta(DE3)和JM109(DE3)表达菌株中,37℃培养,挑取单菌落进行小量诱导表达,用0.8 mmol·L-1IPTG,在25℃诱导10 h 后,经12%SDS-PAGE 检测,结果显示在42 kDa 处有一条明显条带(图10),蛋白大小与预期一致,说明重组蛋白SbSGT1 在大肠杆菌BL21(DE3)、Rosetta(DE3)和JM109(DE3)中均可以包涵体形式表达(泳道1、3 和5)。但对于SbSGT1 可溶性蛋白的获得,在JM109(DE3)和Rosetta(DE3)菌株中,只有少量的SbSGT1 可溶性蛋白(泳道2 和4),而在BL21(DE3)菌株中有大量表达(泳道6),因此,选用BL21(DE3)菌株用于后续表达分析试验。

图7 SbSGT1 蛋白信号肽预测Fig.7 Signal peptide prediction of SbSGT1 protein
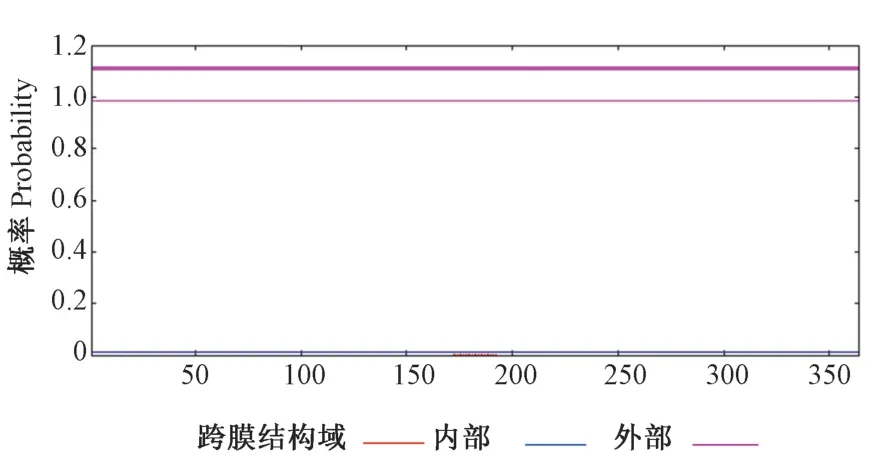
图8 SbSGT1 蛋白跨膜区预测Fig.8 Transmembrane region prediction of SbSGT1 protein
2.4.2 温度对SbSGT1 蛋白表达的影响 将重组质粒pET-28a-SbSGT1 转化到BL21(DE3)中,分别在16、20、25、30、37℃条件下对其进行诱导表达,确定最佳诱导温度。由图11可知,随着诱导温度的升高,SbSGT1 蛋白表达量呈先升高后降低的趋势,其中在25℃诱导温度下SbSGT1 蛋白表达量最高(泳道4)。因此,选用诱导温度25℃用于后续SbSGT1 蛋白表达分析试验。

图9 pET-28a-SbSGT1 重组质粒构建的电泳图谱Fig.9 The electrophoresis result of the recombinant expression plasmid of pET-28a-SbSGT1
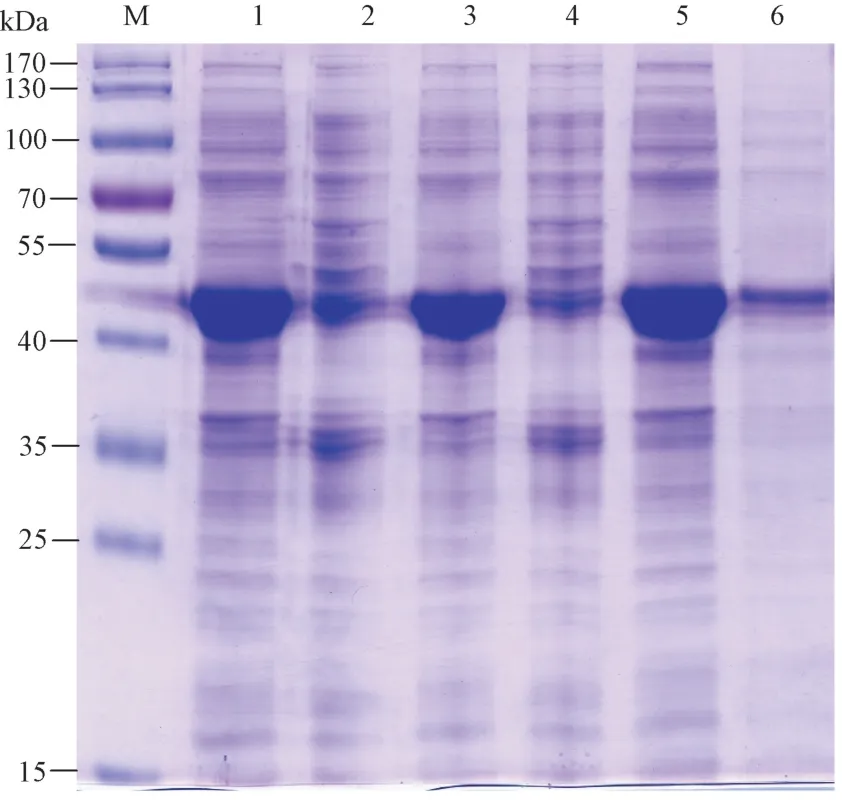
图10 SbSGT1 蛋白不同菌株表达分析Fig.10 Protein expression analysis of SbSGT1 in bacterial strains
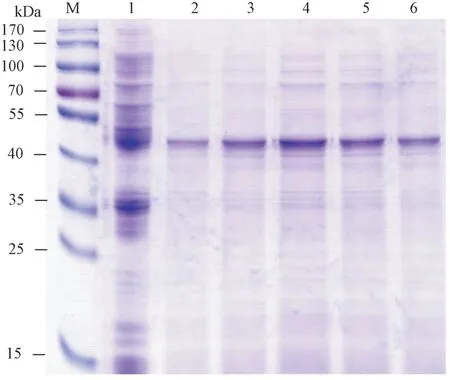
图11 不同温度对SbSGT1 蛋白诱导表达分析Fig.11 SbSGT1 protein expression analysis under different temperatures
2.4.3 不同IPTG 浓度对SbSGT1 蛋白表达的影响将重组质粒pET-28a-SbSGT1 转化到BL21(DE3)中,25℃条件下分别在0.4、0.6、0.8、1.0 mmol·L-1IPTG浓度下进行诱导表达,确定最佳诱导浓度。由图12可知,随着IPTG 浓度的增大,SbSGT1 蛋白的表达量逐步升高,当IPTG 浓度为0.8 mmol·L-1时,SbSGT1 蛋白表达量最高(泳道4),当浓度为1.0 mmol·L-1时,蛋白表达量无明显增加(泳道5)。
2.5 SbSGT1 蛋白的Western blot 检测
为进一步确定诱导表达的SbSGT1 蛋白,采用Western blot 对重组蛋白进行检测。由图13可知,当用Anti His 抗体对诱导的蛋白进行检测时,可观察到一条约42 kDa 的蛋白条带,且条带单一,说明成功诱导了His-SbSGT1 蛋白表达。
3 讨论
植物对病原菌的抗病性一直是植物病理学领域的热门课题之一。SGT1 基因的发现使植物抗病机制的研究有了进一步的突破,近期的多项研究都表明SGT1是植物抗病反应过程中的信号转导的调控基因和防卫反应信号的重要调控因子[20],其功能是调节靶蛋白被26S 蛋白酶体降解[31]。SGT1 首先在酵母中报道[32],随后在植物和动物中相继被报道,并且在功能上存在保守性,即SGT1 是泛素连接酶SCF(Skp1-Cullin-FVOX protein)的重要组成[33],该蛋白可以对底物蛋白进行泛素化修饰,进而调节底物蛋白的降解。
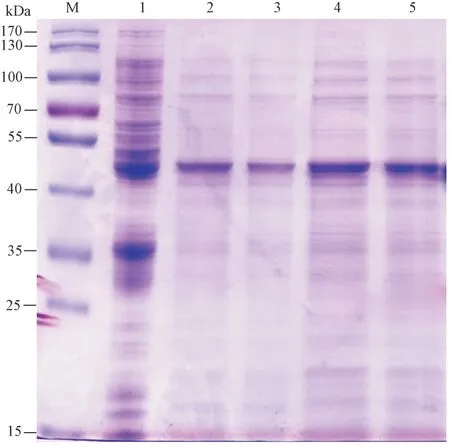
图12 不同IPTG 浓度对SbSGT1 蛋白表达的影响Fig.12 SbSGT1 protein expression analysis under different IPTG concentrations
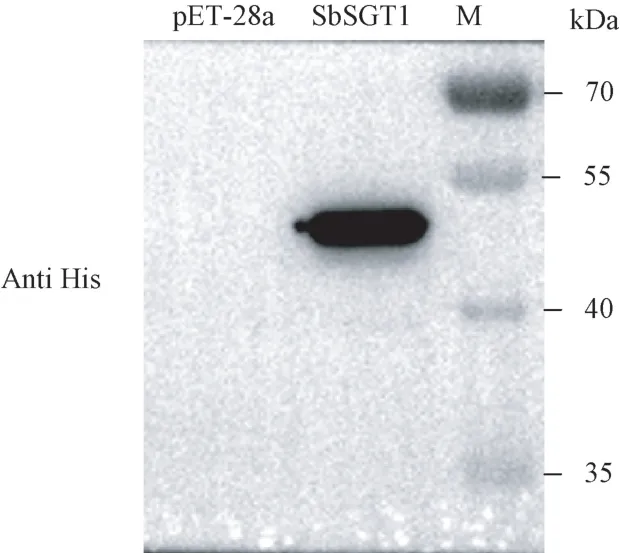
图13 SbSGT1 蛋白Western blot 检测Fig.13 Detection of SbSGT1 protein by Western blot
SGT1 基因作为植物中一类重要的抗性基因,其在植物处于非生物胁迫时表达上调,以增强植物的抗逆性。例如,拟南芥HSC70/SGT1 基因协同作用可减轻γ 射线以及高盐胁迫造成的损伤[34];甘蓝处于高盐胁迫下,BolSGT1 基因表达量大幅上调[35]。当植物面对病原菌侵染时,也需要SGT1 的参与,推测SGT1 可能位于抗病信号通路的上游,因而调控着植物对病原菌的“广谱抗性”[36]。在大麦中SGT1 与RAR1 蛋白相互作用,参与调节大麦对白粉病菌的抗性[37];在拟南芥中SGT1 与RAR1 蛋白、热激蛋白HSP90 形成复合体,调节R基因介导的抗病反应[38]。而高粱中,SbSGT1 能否与调控其抗病性尚待进一步研究。
白菜BcSGT1 基因编码蛋白的大小为39 kDa,系统发育分析显示,其与拟南芥AtSGT1b亲缘关系最近[39];花生AdSGT1 基因含有TRP、CS 和SGS 保守结构域,编码358 个氨基酸,进化分析表明,其与大豆GmSGT1 同源性达到82%,亲缘关系较近[40];簇毛麦Hv-SGT1 基因编码376 个氨基酸,包含2 个可变结构域VR1、VR2 和1 个SGS,进化分析表明,其与大麦SGT1 同属1 个分支,亲缘关系最近[41]。本研究显示,高粱SbSGT1 与玉米亲缘关系最近。由此发现,SGT1在不同植物中的蛋白大小、亲缘关系都有所不同,说明其在进化中存在多样性。
高粱作为重要的农作物和工业原料,对其抗病机制的研究直接关系到高粱的产量和品质的问题。研究SGT1 是否参与高粱抗病性的调控,以及研究SGT1 在高粱抗病机制中的互作关系,对高粱SGT1 的克隆与表达是非常必要的。原核表达是外源蛋白的常用研究方法之一,其表达菌株多为大肠杆菌及其改良菌株,具有表达背景低、操作简便、成本低、繁殖快以及蛋白表达量高等优点[42-44],且大肠杆菌表达系统是目前应用范围最广的重组蛋白表达系统之一[45]。研究表明,表达菌株、IPTG 浓度和诱导温度会影响靶标蛋白的表达[46]。水稻OsSGT1、大麦HvSGT1 和白菜BcSGT1 蛋白均可在BL21(DE3)菌株、1.0 mmol·L-1IPTG 以及37℃诱导温度下表达[21,39,47],这与本研究SbSGT1 在BL21(DE3)菌株中表达结果一致;但本研究显示SbSGT1 的最佳诱导温度(25℃)和最佳IPTG 浓度(0.8 mmol·L-1)与上述报道有偏差,可能是所使用原核表达载体不一致所致。本研究中获得的SbSGT1 蛋白相对分子质量约为42 kDa,这与理论值(40.45 kDa)基本一致,且Western blot 也检测到该条带,推测该蛋白为表达的高粱SbSGT1 融合蛋白。
本研究对高粱SbSGT1 基因进行克隆,并对其原核表达条件进行了优化,但SbSGT1 基因在真核的表达情况、蛋白互作以及结构解析等仍需进一步研究。
4 结论
本研究从高粱中成功克隆SbSGT1 基因,该基因全长1 095 bp,编码364 个氨基酸。生物信息学分析结果与其他物种已报道的SGT1 基因信息基本一致,该基因编码的蛋白质分子量为40.45 kDa,等电点为5.0,具有亲水性,发生信号肽剪切的可能性极小;亚细胞定位预测该蛋白主要定位在细胞质中,进化树分析发现其与玉米ZmSGT1 同源性较高。原核表达结果显示,SbSGT1 蛋白在BL21(DE3)菌株中可溶性表达,最佳诱导温度和 IPTG 浓度分别为 25℃和 0.8 mmol·L-1。本研究结果为SbSGT1 蛋白功能分析、结构解析以及抗病功能的研究提供了一定的依据。

