几种芸薹属作物APX家族基因的鉴定与序列分析
王钧涛 陈木溪 李立斌 伍健缤 雷建军 陈国菊 曹必好 陈长明
(1华南农业大学园艺学院,广东 广州 510642;2广东和利农种业股份有限公司,广东 汕头 515800;3广东和利农农业研究院有限公司,广东 汕头 515800)
活性氧(reactive oxygen species,ROS)由有氧代谢产生,可以在任何生物细胞的任何部位产生[1]。ROS包括超氧阴离子()、羟基自由基(·OH)等含氧自由基,也包括过氧化氢(H2O2)、单线态氧(1O2)等非自由基形式的含氧分子,其中可被过氧化物歧化酶(superoxide dismutase,SOD)催化生成H2O2。H2O2可进行两类反应,第一类通过抗坏血酸-谷胱甘肽循环(ascorbate-glutathione cycle,ASA-GSH)生成水,此类反应可清除ROS,该循环由抗坏血酸(ascorbate,ASA)和还原型谷胱甘肽(reduced glutathione,GSH)组成[2],该途径分布于植物叶绿体、线粒体和细胞质内,抗坏血酸过氧化物酶(aseorbate peroxidase,APX)是其中的关键酶[3];第二类反应是通过哈伯韦斯(Haber-weiss)反应和芬顿(Fenton)反应生成高度活泼的·OH,此成分是破坏性最强的活性氧,氧化电位(2.80 V)仅次于氟(2.70 V)[4]。此外,ROS 也是植物体内重要的应激信号之一,使用H2O2对植物体进行预处理,可显著提高植物对非生物胁迫的耐受性[5]。
Foyer 等[6]于1976年发现了以ASA 为电子供体的过氧化物酶。1981年Nakano 等[7]确定此酶为APX。APX 通过催化ASA 和H2O2反应,使其生成单脱氢抗坏血酸自由基(monodehydroascorbate,MDA)和水,以清除植物体内的H2O2[8-9]。研究发现,敲除OsAPX2 的突变体水稻(Oryza sativa)中APX 活性明显下降,植物体表现为对多种逆境胁迫敏感,且H2O2和MDA 含量较高[10];在缺少AtAPX6的拟南芥(Arabidopsis thaliana)种子中ROS 的水平更高,并显示出氧化损伤[11];过表达APX基因明显地提高了烟草(Nicotiana tabacumL.)和苜蓿(Medicago sativa)的抗逆性状[12]。Panchuk 等[13]和Mullineaux 等[14]研究表明,APX 在热胁迫、伤害胁迫中有重要作用。APX 还会和其他抗逆基因产生协同作用以提高植物抗逆性;Shafi 等[15]研究表明,与野生型植株或过表达单一基因植株相比,同时过表达超氧化物酶(superoxide dismutase,SOD)和APX基因的拟南芥植株在盐胁迫下积累更高的生物量和纤维素含量。此外,在干旱条件下,高粱[Sorghum bicolor(L.) Moench]的APX基因和谷胱甘肽过氧化物酶(glutatione peroxidase,GPX)基因的表达量表现出了协同调节现象[16]。H2O2是唯一具有跨膜高渗透性和较高稳定性的ROS[17],APX的存在对于植物ROS 信号调节具有至关重要的作用。在OsAPX4-RNAi 的水稻植株中,Rubisco 的羧化速率大幅增加,并间接导致光合作用蛋白和其他活性氧清除系统蛋白的相关基因大量表达[16];在正常生长条件下基因沉默并未影响植物的生长,但OsAPX4-RNAi 的植株出现了早衰的现象,同时对各类胁迫和衰老信号更为敏感[18],可见APX基因对维持植物的正常生理活动及增强植物的抗逆性状具有重要意义。目前,已经在水稻、烟草、小麦(Triticum aestivumL.)、番茄(Lycopersicon esculentumMill.) 和茄子(Solanum melongenaL.)等重要经济作物中克隆并鉴定了APX基因[19-23]。
芸薹属(Brassica)是十字花科中最重要的属,含40 余个种,其中包括许多重要的蔬菜、油料及饲料作物[24],芸薹属作物具有对高温、低渗、高盐环境和除草剂敏感的特点,使其栽培过程受到较大的限制,因此对芸薹属作物的抗逆基因进行分析具有重要的意义。在20世纪上叶通过细胞学研究,推测大白菜(B.rapa,n =10)、黑芥(B.nigra,n =8)和甘蓝(B.oleracea,n =9)这3 个染色体数目较少的物种为芸薹属作物的二倍体基本种,基本种之间两两杂交形成了芥菜(B.juncea,n =18)、欧洲油菜(B.napus,n =19)和埃塞俄比亚芥(B.carinata,n =17)这3 个染色体数目较多的异源四倍体种[25]。韩国学者Nagaharu[26]通过种间杂交证实了这个推测,并用三角形表示这六种作物之间的亲缘关系,即禹氏三角。目前对芸薹属作物中的APX家族基因的鉴定和分析鲜见报道,本试验以禹氏三角上的大白菜、甘蓝和欧洲油菜为目标物种,鉴定APX基因,分析其基因结构、染色体分布、蛋白质结构和APX基因的进化指数,并通过已发布的转录组数据对APX基因进行表达分析,以期为进一步研究芸薹属植物APX家族基因成员在逆境胁迫中的功能提供基础。
1 材料与方法
1.1 APX 家族基因的生物信息学鉴定
拟南芥、大白菜和甘蓝的基因组下载自数据库Ensembl Plants(http:/ /plants.ensembl.org/),欧洲油菜基因组下载自数据库Brassicadatabase (http:/ /brassicadb.org/)。以从NCBI 下载的8 个拟南芥APX基因序列为探针,通过makeblastdb 命令建立本地大白菜、甘蓝和欧洲油菜的编码序列(coding sequence,CDS) BLAST 数据库,并使用本地BLAST[27]进行比对,E-value 值设为1e-5。找到候选的大白菜、甘蓝和欧洲油菜的APX同源基因,去除重复、冗余以及假基因。
1.2 APX 染色体定位和基因序列分析
检索拟南芥、大白菜、甘蓝和欧洲油菜的基因组注释文件(gff)中APX基因的注释信息并制成表格;将APX基因的基因名,所在染色体名称,起始、终止位点,染色体长度信息输入至TBtools[28]进行染色体定位制图。使用工具SAMtools[29]提取拟南芥、大白菜、甘蓝和欧洲油菜APX的CDS 和蛋白序列。将序列输入到ExPASy ProtParam (http:/ /web.expasy.org/compute_pi/)进行APX 蛋白分子量、等电点预测。
1.3 APX 基因的进化树构建和分析
将拟南芥、大白菜、甘蓝和欧洲油菜共49 个APX氨基酸序列经MAFFT[30]多重比对以后输入到MEGA7.0 中,采用最大似然法(maximum likelihood method)构建APX 蛋白进化树,步长校验(bootstrap)设为1 000 次。
1.4 APX 蛋白结构预测
使用生物信息学分析工具hmmer[31]的子程序hmmscan 扫描APX 蛋白序列获得结构域(domain)信息,E-value 设为1e-5;通过工具MEME[32](http:/ /meme.org)预测APX 基因核酸序列和蛋白序列的保守结构域(Motif),预测数量设为最多10 个。通过生物信息学分析工具TBtools[28]对上述结果进行分析与绘图。将APX 的氨基酸序列输入至软件Ⅰ-TASSER[33]进行蛋白三级结构预测,使用model1.pdb 文件作为结果,并将结果拼接至环状进化树上,分析结果。
将各基因通过软件BLAST 相互比对,将比对结果以默认形式输出,上传至工具circollto(http:/ /tools.bat.infspire.org/circoletto/)进行circos 共线性的图片输出。分析输出结果,将相互连线的基因作为基因对输入至ParaAT[34],以模型平均(model averaging,MA)的方式进行选择压力(Ka/Ks)分析。
1.5 APX 基因在逆境胁迫下的表达分析
通过NCBI(https:/ /www.ncbi.nlm.nih.gov/)检索大白菜、甘蓝和欧洲油菜中与逆境胁迫相关的转录组数据。经过筛选选择大白菜在高温胁迫下的转录组数据(NCBI 登录号为PRJNA253868),试验以大白菜[Brassica rapavar.trilocularis,种子来自加拿大国家研究委员会(National Research Council of Canoda,NRC)植物生物技术研究所]的胚、胚乳、14 和32 d 的叶片、未开放的花蕾、受精和未受精的胚珠以及花粉为材料,进行42℃高温处理。在甘蓝中,选择NCBI 登录号为PRJNA453960 和PRJNA490257 的转录组数据;其中PRJNA453960 以根肿病抗性甘蓝xiangan336(CRXG336)和根肿病易感型甘蓝景峰1 号(CS-JF1)的根部为材料,分别在感染后7(根肿病原发感染)和28 d(根肿病形成阶段)进行采样;PRJNA490257 以白粉虱抗性甘蓝(荷兰温姆海森Bojo Zaden B.V.的Rivera,Brassica oleraceavar.capitate)和白粉虱敏感型甘蓝(荷兰瓦戈宁根遗传资源中心自留种)的叶片为材料,在播种后第49 天开始处理,连续使用白粉虱侵染4 d 并采样。选择NCBI 登录号为PRJNA389508 的欧洲油菜转录组数据,以欧洲油菜细胞质雄性不育系恢复系(09Y42,河南大学棉花生物学国家重点实验室开发)的叶片为材料,在4 片真叶期分别进行4℃低温胁迫、40℃高温胁迫、15%聚乙二醇(polyethylene glycol,PEG)渗透胁迫、30 μmol·L-1脱落酸(abscisic acid,ABA)和150 mmol·L-1NaCl 处理12 h 并采样。将检索到的转录组数据通过prefetch 下载,fastq-dump 解压为fastq.gz 文件,输入至分析工具Salmon[35]进行快速定量。取定量结果TVM 列,整合成表,提取APX 基因的表达数据并使用TBtools 绘制热图,进行表达分析。
2 结果与分析
2.1 APX 家族基因成员的鉴定与染色体定位
以8 个拟南芥APX基因为探针序列,通过makeblastdb 命令建立本地大白菜、甘蓝和欧洲油菜的CDS BLAST 数据库,经本地BLAST 比对,去除假基因(pesudo gene)和可变剪切后,分别在大白菜、甘蓝和欧洲油菜中得到9、10 和22 个APX基因的cDNA 序列全长。按照与拟南芥APX基因的比对结果进行命名,分为拉丁名简写(如拟南芥为At,大白菜为Br)、APX和对应基因名(如拟南芥为AtAPX1,其对应的大白菜同源基因如果有3 个,分别为BaAPX1a、BaAPX1b、BaAPX1c)三部分;欧洲油菜的基因按照其所处的染色体位置分别命名为-o(来源于甘蓝)和-r(来源于大白菜),例如来源于甘蓝则为BnAPX1a-o。来自同一拟南芥基因比对结果的基因序列称为同组序列。根据以上规则,将49 个APX基因分别命名为AtAPX1 ~BnAPXTha-r(表1)。
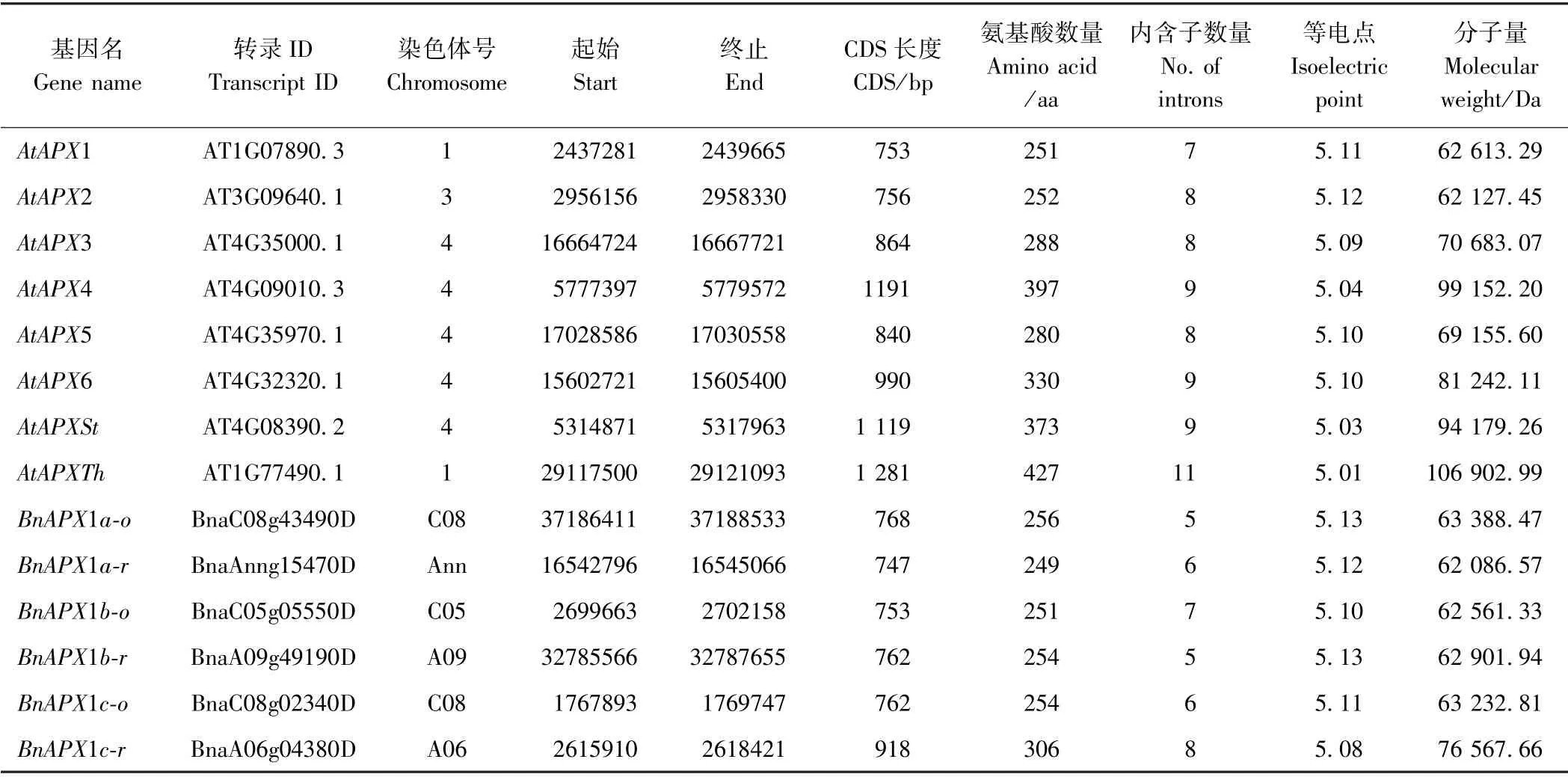
表1 3 种芸薹属作物与拟南芥的APX 家族基因的基本信息Table1 The sequence information of the APX gene family in three Brassica crops and Arabidopsis thaliana
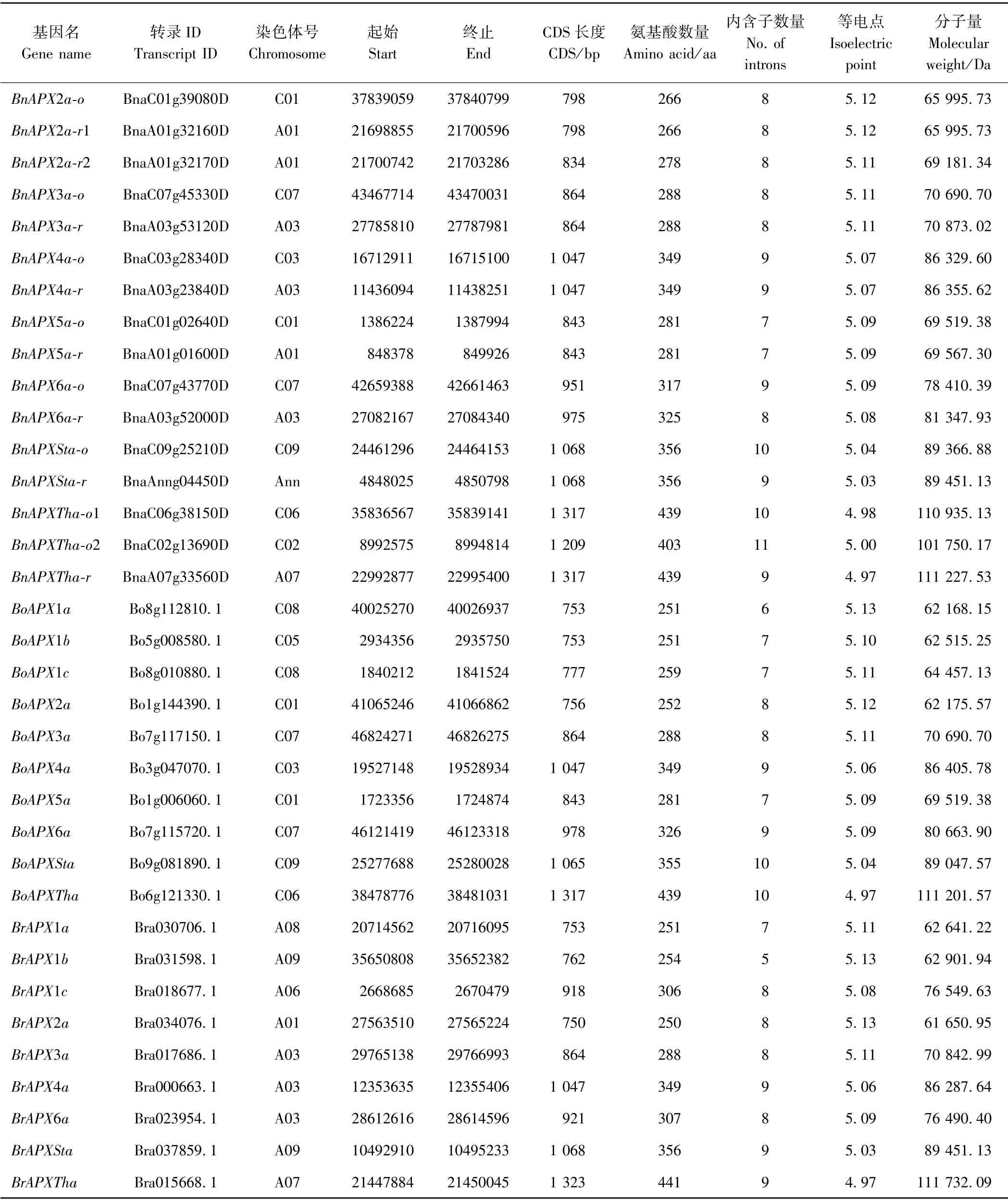
表1 (续)
将49 个APX基因所在的染色体信息制成染色体定位图(图1)。结果表明,8 个拟南芥APX基因分布在3 条染色体上,其在第4 条染色体上比较集中,有5个APX基因,另外3 个APX基因分布在第1、第3 条染色体上。甘蓝、大白菜和欧洲油菜中的APX基因在染色体上分布较为分散,其中大白菜的9 个APX基因分布在A01、A03、A06、A07、A08、A09 染色体上,甘蓝的10 个APX基因分布在C01、C03、C05、C06、C07、C08、C09 染色体上。欧洲油菜的22 个APX基因分布在A01、A03、A06、A07、A09、Ann、C01、C02、C03、C05、C06、C07、C08、C09 染色体上。从进化上分析,大白菜A01、A03、A06 和A07 染色体上的APX基因传递到了对应的欧洲油菜染色体上,而A08 染色体上的BrAPX1a和A01 染色体上的BrAPXSta未出现在欧洲油菜对应染色体上。甘蓝的APX基因都在欧洲油菜上得到了完整的保留,而欧洲油菜的A01 染色体上新出现了BnAPX5a-r和BnAPX2a-r1,欧洲油菜的C02 染色体上新产生了BnAPXTha-o2,该基因来源尚不明确。
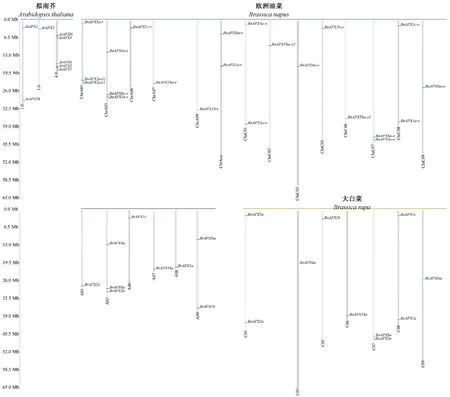
图1 3 个芸薹属作物与拟南芥的APX 基因在基因组染色体上的分布位置Fig.1 Distribution of APX genes in three Brassica crops and Arabidopsis thaliana on genomic chromosomes
2.2 APX 家族基因序列分析
由表1可知,3 种芸薹属作物APX基因所含平均碱基数从小到大依次为APX2(782 bp)、APX1(783 bp)、APX5(842 bp)、APX3(864 bp)、APX6(963 bp)、APX4(1 075 bp)、APXSt(1 077 bp)、APXTh(1 294 bp)。APX内含子从5 个到11 个不等,其中APXTh组的内含子数量偏多(9~11 个),而APX1 组的内含子数量最少(5 个左右);内含子数量和基因序列长度和拟南芥基本保持一致。编码APX蛋白的氨基酸长度集中在249 ~441 个氨基酸,其中最短的为BnAPX1a-r(249 aa),最长的为BrAPXTh-r(411 aa);氨基酸平均分子量为77.78 kDa,其中分子量最小的为大白菜BrAPX2a(61.65 kDa),最大的也来自大白菜BrAPXTha(111.73 kDa);等电点平均为5.079 ,其中最低的是来自甘蓝的BoAPXTha(4.97),最高的是来自欧洲油菜的BnAPX1a-o(5.13)。
2.3 APX 家族基因进化和蛋白结构分析
为分析APX 家族基因的进化特点,以拟南芥、大白菜、甘蓝和欧洲油菜共49 个APX基因的蛋白序列,经MAFFT 多重比对后在Mega7.0 环境下以最大似然法构建了系统进化树,并分析对应APX基因的CDS 保守结构域(CDS motif)、蛋白质保守结构域(protein motif)以及基因结构域(gene structure),见图2。由于同族序列在进化树上紧密的结合在一起,将进化树以BLAST 比对结果进行划分,APX1 组到APXTh组分别对应罗马数字Ⅰ~Ⅷ(APXSt组对应Ⅶ,APXTh组对应Ⅷ),由此将进化树分为8 个亚族。其中Ⅰ、Ⅱ、Ⅲ和Ⅴ亚族在CDS 保守域的构成和排列顺序上均完全一致,且域外序列较短;在蛋白保守域的构成和排列上,除了Ⅴ亚族缺少Motif 9 以外,它们的构成和排列顺序亦完全一致;在包含内含子的DNA 序列上,也拥有相近的外显子-内含子结构。Ⅶ和Ⅷ亚族拥有相似的CDS 保守域和蛋白保守域,Ⅷ亚族比Ⅶ亚族在CDS 保守域上多一个Motif 7,蛋白保守域在同一位置上多一个Motif 10,除此之外整体非常相似。Ⅳ亚族和Ⅵ亚族相对于其他亚族在CDS 保守域和蛋白保守域上相似性较低;Ⅳ亚族的CDS 保守域构成和排列较为相似,仅有BnAPX4a-r包含一个额外的Motif 9,表明Ⅳ亚族的CDS 序列拥有一定的保守程度。此外,Ⅳ亚族在蛋白保守域上拥有较高的相似性,表明Ⅳ亚族在蛋白序列上拥有较高的保守程度;Ⅵ亚族在CDS 保守域的构成和排列上差异较大,且Motif 7 和Motif 9 之间的距离差异较大,表明Ⅵ亚族CDS 序列保守程度较低,但Ⅵ亚族在蛋白保守域的构成和排列上差异较小,表明Ⅵ亚族的蛋白序列保守程度较高。
采用环形树状图并在树末端附上对应APX基因的蛋白三级结构预测图(图3)。Ⅰ、Ⅱ、Ⅲ和Ⅴ亚族在三级结构上较为相似,其中Ⅰ、Ⅱ亚族三级结构高度相似。由于BnAPX1c-r、BrAPX1c、Ⅲ亚族和Ⅴ亚族拥有少量peroxidase 结构域以外的冗余序列,它们相比其他序列结构稍微复杂一些。Ⅳ、Ⅵ、Ⅶ和Ⅷ亚族在空间结构上拥有更大的空间深度,由于在peroxidase 结构以外拥有大量冗余序列,这些蛋白也含有更多的不规则卷曲。此外,所有APX 蛋白均不含跨膜结构域。

图2 3 个芸薹属作物与拟南芥APX 基因的CDS 保守域、蛋白质保守域和基因结构Fig.2 CDS motif,protein motif and exon-intron structure of three Brassica crops and Arabidopsis thaliana APX gene
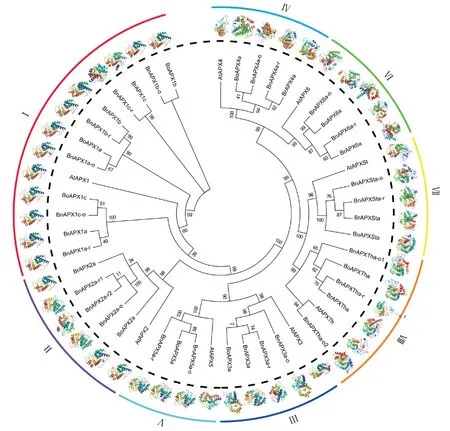
图3 3 个芸薹属作物与拟南芥APX 基因的进化树和三级结构预测Fig.3 Evolution tree and protein tertiary structure prediction of APX genes from Arabidopsis thaliana and three Brassica crops
由图3可知,几乎所有的APX基因都含有Motif 6,而Motif 6 不属于peroxidase 结构域,却普遍存在于APX 蛋白中,且高度保守,在三级结构上呈稳定的螺旋结构。本研究以BrAPX1 为例,将该蛋白拆分出peroxidase 结构域和Motif 6 保守结构域,peroxidase 结构域三级结构保守,普遍含有10 个螺旋结构,无跨膜域;而在APX 蛋白的末端普遍含有一个四周半的螺旋结构与Motif 6 所在区域对应(图4),且该区域序列经BLAST 比对仅能比对到自身的同源基因。综上,Motif 6 所在区域序列很有可能是区分APX基因和其他含有peroxidase 结构域的基因的特征序列,但相关结论仍需要大量试验进行证实。
2.4 共线性分析和Ka/Ks 进化指数分析
共线性分析表明,同组APX基因间均两两共线,非同组APX基因间均不共线,表明已准确找到了APX家族基因。将两两共线的基因作为一对输入至ParaAT 计算Ka/Ks 值,同时获得费雪氏校验值(FisherP-value),将得出的值输入至Excel 作图。由图5可知,122 对基因中有112 对APX基因的Ka/Ks 值小于1,表明APX 家族基因正受到纯化选择,同时P-value值近乎为0,表明这些结果拥有极高的置信度。
2.5 APX 家族基因在逆境胁迫下的表达分析
为了分析APX基因对非生物和生物胁迫的响应,从NCBI 数据库中选择了4 个表达谱分析数据包,经salmon 快速定量后,提取APX基因的定量结果,并使用TBtools 进行绘图。由图6-A 可知,BrAPX2a在大白菜胚和胚乳中对高温胁迫产生明显的上调表达响应,但在叶片、花絮、胚珠和花粉当中均无表达,说明BrAPX2a强烈响应高温胁迫,且存在组织表达特异性。3 个BrAPX1 基因在32 d 大白菜叶片的表达量明显高于14 d 的叶片,在花和胚珠中的表达与32 d 大白菜叶持平,在花粉中基本不表达。BrAPX3a在大白菜叶片中持续表达,但在花序、胚珠中表达量较低,在花粉中基本不表达;BrAPX4a和BrAPXTha在14 d 大白菜叶片中表达较高,在32 d 叶片中表达量下降,在花序、胚珠中表达量较低,在花粉中基本不表达;BrAPX6a在14 d 大白菜叶片中表达量较低,在32 d 叶片中表达量上升,在花序、胚珠中表达量较低,在花粉中基本不表达;BrAPXSta在14 d 大白菜叶片中表达量较低,在32 d 大白菜叶片、花序中表达量上升,在胚珠中表达量下降,在花粉中基本不表达。

图4 大白菜BrAPX1 的三级结构和与之对应蛋白保守结构域Fig.4 Protein tertiary structure and the corresponding protein motif of BrAPX1 from Brassica rapa
由图6-B 可知,经根肿病病原菌感染,甘蓝BoAPX1a、BoAPX1b、BoAPX1c、BoAPX3a、BoAPX4a和BoAPX6a对根肿病生物胁迫无明显响应。在生长28 d 敏感型的甘蓝根部中,BoAPX2a和BoAPXSta轻微上调表达,在敏感型生长7 d 甘蓝和抵抗性的甘蓝中均无明显响应。BoAPX5a和BoAPXTha在敏感型和抵抗型甘蓝的根部对根肿病有轻微的上调表达响应。由图6-C 可知,BoAPX1a和BoAPX1b在敏感型甘蓝的个体中,遭遇白粉虱危害以后出现表达下调,在抵抗型的甘蓝个体中,遭遇白粉虱危害后上调表达。BoAPX1c、BoAPX2a、BoAPX3a和BoAPX6a在敏感型和抵抗型甘蓝遭遇白粉虱危害的过程中均无明显响应,BoAPX4a和BoAPX5a在敏感型甘蓝中表达量较高,而在抵抗型甘蓝中整体较低,但对白粉虱危害无明显响应。BoAPXSta和BoAPXTha在遭遇白粉虱危害后出现下调表达。
由图6-D 可知,除BnAPX1b-r以外,欧洲油菜APX1 组的基因在高温、ABA 和盐胁迫下均出现明显的上调表达。BnAPX2a-r1 仅对高温胁迫表现出明显的上调表达。BnAPX1b-r、BnAPX2a-r2 和BnAPX2a-o对低温、高温、15%PEG 渗透胁迫、ABA 和盐胁迫均无明显响应。APX3 组、APX4 组、APX5 组和APX6 组对胁迫的响应较为一致,在遭遇低温、高温胁迫时,均出现下调表达,在15%PEG 和盐胁迫时出现上调表达,在ABA 胁迫时出现轻微的下调表达。APXSt 组和APXTh 组的响应表现较为一致,在低温胁迫时出现轻微的上调表达,在高温胁迫时出现明显的上调表达,在15%PEG、ABA 胁迫和盐胁迫时几乎不响应。
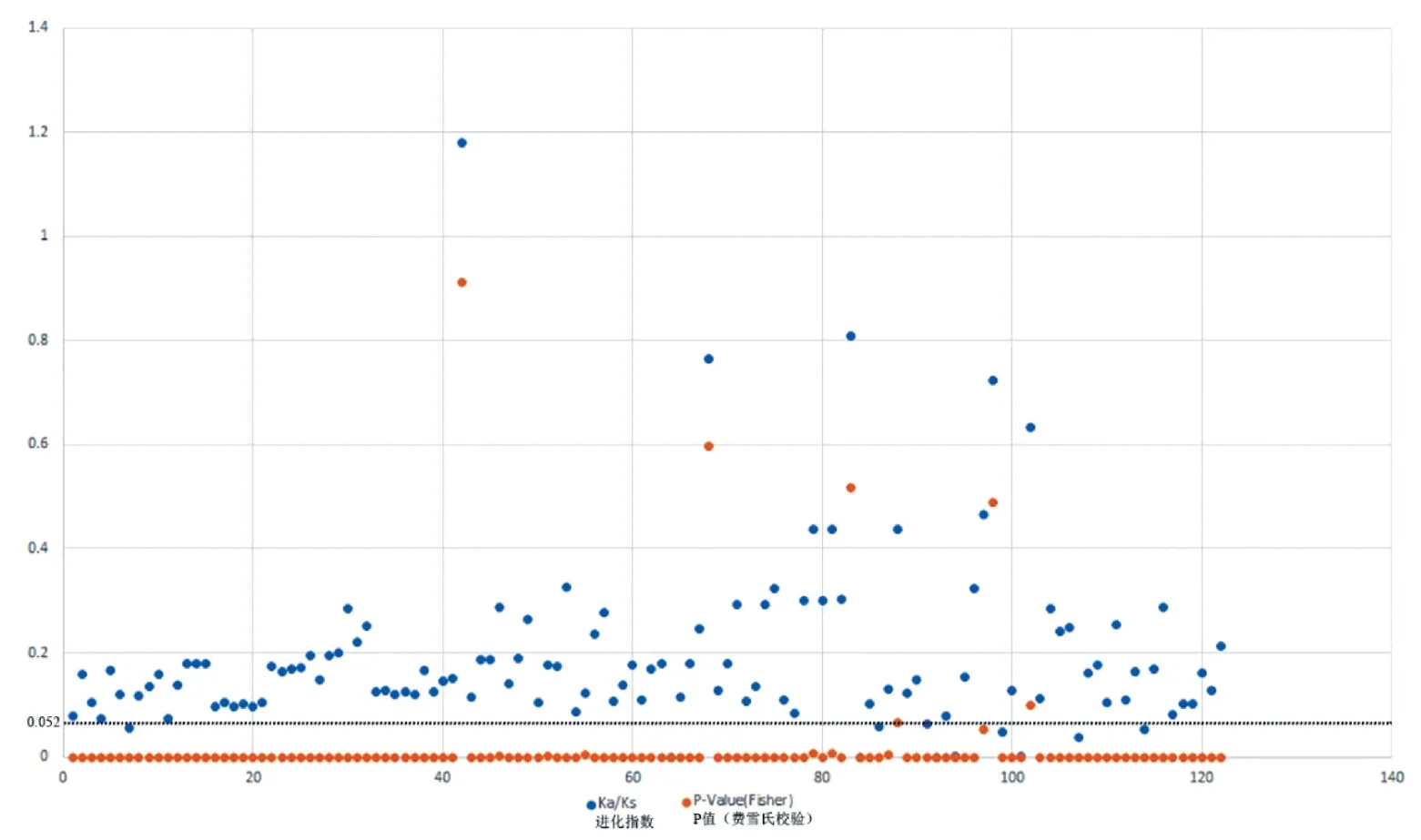
图5 3 个芸薹属作物与拟南芥APX 基因的Ka/Ks 进化指数分布图和对应的置信度(P-value)Fig.5 Ka/Ks evolutionary index distribution map with corresponding confidence of three species of Brassica crops and Arabidopsis thaliana APX genes (P-value)
3 讨论
本研究通过生物信息学方法,在大白菜和甘蓝的基因组中分别鉴定到10 和9 条APX基因,比拟南芥中的APX基因(8 条)分别多2 和1 条[36]。研究表明,大白菜和甘蓝的基因组是从拟南芥的基因组三倍化而来,因此部分拟南芥基因在大白菜或者甘蓝中有3 个同源基因[37],但在本试验中,甘蓝除有3 个APX1 同源基因外,其他APX基因均只有一个同源基因,且未发现APX3 同源基因,且大白菜中也有类似现象,除3 个APX1 同源基因外,其他7 个APX基因均只有一个同源基因。推测在大白菜和甘蓝的进化和选择过程中,可能只保留了有功能的3 个APX1 同源基因,其他作用不大的甘蓝和大白菜APX基因在三倍化后经过长期的进化和环境适应丢失了。研究表明,大白菜(B.rapa,n =10)和甘蓝(B.oleracea,n =9)杂交形成了欧洲油菜(B.napus,n =19)[1,25,38],因此理论上,欧洲油菜中基因的拷贝数是甘蓝与大白菜基因拷贝数之和。本研究中,欧洲油菜中鉴定到22 个APX基因,大于甘蓝与大白菜APX基因之和(19),多出的APX同源基因可能是欧洲油菜适应环境的结果。从进化上分析,大白菜和甘蓝中的大部分APX基因都已经传递到了欧洲油菜上,只有大白菜A08 染色体上的BrAPX1a和A09染色体上的BrAPXSta未出现在欧洲油菜染色体上的对应位置,并保留在欧洲油菜中的保留区域(Ann 染色体),且欧洲油菜的 C02 染色体上新产生了BnAPXTha-o2;A01 染色体上新出现了BnAPX5a-r和BnAPX2a-r1,结合circos 和进化树分析表明,这2 个基因极有可能是通过染色体异源联会并发生交叉互换保留在A01 染色体上的。
本研究结果表明,同源APX基因聚在同一枝,且具有相同的保守域,如来源于不同作物的APX1 聚在第Ⅰ亚族(图2、3),说明APX 在进化中保守程度较高,这与白桦[39]和陆地棉[40]中APX基因的相关研究结果相似。结构域分析表明,Ⅰ、Ⅱ、Ⅲ和Ⅴ亚族在CDS 保守域和蛋白保守域、结构等部分均拥有极为相似的构成,表明这些序列可能拥有共同的祖先;同理,Ⅶ和Ⅷ亚族也可能拥有共同的祖先;Ⅳ亚族和Ⅵ亚族相对于其他亚族在CDS 保守域、蛋白保守域和基因结构上均拥有较大的差异,表明这两个亚族拥有相对独立的进化史。

图6 不同胁迫处理下3 个芸薹属作物与拟南芥中APX 基因的热图Fig.6 Heatmap of APX gene in three Brassica crops and Arabidopsis thaliana under different stress treatments
大量研究表明,APX 基因家族中的APX1 和APX2在活性氧、高温、干旱等胁迫后表达上调[41-45],其中拟南芥AtAPX1 在活性氧和高温胁迫中均有响应[42-44],AtAPX2 在适宜温度下几乎不表达,只有受到高温胁迫才大量表达[46]。本试验结果表明,欧洲油菜中APX1和APX2 的同源基因对高温胁迫都有响应,其中APX2响应更为强烈,而其他APX基因对高温、干旱和生物胁迫的响应较小,推测可能在其他逆境胁迫中起作用。此外,本研究发现有些APX基因的表达具有一定的组织特异性,尤其是BaAPX2 在大白菜的胚和胚乳中对高温胁迫产生明显的上调表达响应,但在叶片、花絮、胚珠和花粉当中均无表达,说明BrAPX2a强烈响应高温胁迫,且存在组织表达特异性,推测可能是某些组织部位更容易受到外界环境胁迫,导致APX基因表达在各组织部位分布不均,这一现象在前人研究中鲜见报道。这些表达分析都是基于已有的转录组数据库,但其详细表达模式需要更多试验验证。
4 结论
本研究在大白菜、甘蓝和欧洲油菜中分别鉴定到了10、9 和22 个APX基因。APX 家族基因在进化树上可分为8 个亚族; APX 家族基因的peroxidase 结构域保守,拥有相对稳定的CDS 保守结构域、蛋白保守结构域和三级结构;在peroxidase 结构域的后端,所有APX 蛋白均含有一个螺旋结构,且该结构被MEME 识别为一个独立的Motif 6。APX家族基因整体正在经历纯化选择。不同物种间响应胁迫的APX基因有可能不同;大部分APX1 和APX2 基因在受到胁迫时上调表达,但在植株遭遇过量胁迫时,可能出现下调表达。此外,部分APX基因的表达还具有组织特异性。大白菜、甘蓝和欧洲油菜APX 家族生物信息学分析为研究芸薹属作物的逆境适应及生长发育分子机制奠定了基础。

附表13 种芸薹属作物和拟南芥APX 家族基因的蛋白结构域的基本信息Attached Table1 The basic information of the three kinds of Brassica crops and Arabidopsis APX protein structure domain

附表1(续)

附表2 3种芸薹属作物和拟南芥APX 家族基因的进化指数和对应置信度Attached Table2 The evolutionary index and P-value of the three kinds of Brassica crops and Arabidopsis APX gene family

附表2(续)

附表2(续)

附表2(续)

