南极大磷虾肠道曲霉菌Aspergillus sydowii NJF7的分离与代谢产物的研究
常俊男,李灵智,樊成奇,韩清华,黄洪亮,马丽艳,陆亚男,李月月,田晓清,3
(1.中国水产科学研究院东海水产研究所,上海 200090;2.农业农村部远洋与极地渔业创新重点实验室,上海200090;3.农业农村部东海渔业资源开发利用重点实验室,上海 200090;4.上海海洋大学,上海 201306)
南极大磷虾(Euphausiasuperba)因其区域特色、资源保有量优势以及广泛应用价值为世界主要发达国家所青睐,国际上已形成磷虾捕捞技术支撑、高附加值产品驱动为一体的产业链[1-3]。我国更将南极大磷虾商业化开发纳入国家海洋发展战略,积极培育这一海洋生物精深利用新兴产业。南极大磷虾自身富含多种活性物质,包括DHA/EPA等不饱和脂肪酸、磷脂、多种活性低温酶等[4-8]。而肠道作为磷虾等动物体内重要的消化吸收器官,其中栖息着数量庞大、结构复杂的肠道微生物组(intestinalmicrobiota),与宿主的营养代谢、遗传、发育及进化、免疫防御等重要生命过程休戚相关[9-11]。有学者研究发现南极大磷虾肠道菌群包含大量未知微生物新种属,随后通过菌株代谢产物及其生物活性筛选,从南极大磷虾可培养菌株代谢产物中鉴定化合物48个,具有抗海洋病毒、抗海洋病原菌及抗污损等多种生态学活性[12-16]。因此,我国亟需继续大力加强南极大磷虾基础生物学研究,积极拓展其资源综合利用新途径。本研究小组成员在参与第29次极地科学考察时,分离出南极大磷虾共附生微生物133株,其中7%为未知种[17],并且全部为细菌。丁壮等[18]总结了极地真菌的代谢产物,发现其代谢产物多样性较好,且具有抗菌、增强抗癌药物活性、核苷转移抑制剂等活性。
因此,本文在前人研究的基础上对第34次“雪龙号”南极考察采集到的南极大磷虾共附生菌进行真菌菌株分离鉴定,并对其次级代谢产物进行初步研究,以期为极地真菌以及南极大磷虾综合利用提供参考。
1 材料与方法
1.1 材料
南极大磷虾由2017年第34次“雪龙号”南极考察船采用框架拖网采获。
培养基:孟加拉红固体培养基[19];PDA固体培养基;YPD固体培养基;YPD液体培养基。用于分离真菌菌株时每种培养基添加抗生素:青霉素、链霉素、氯霉素各30μg·mL-1。
色谱材料:柱层析硅胶(200 300目)及预制GF254 TLC硅胶板:青岛海洋化学公司;MCI gel(CHP 20P,75 150μm);C18反相硅胶(150 200目):Merck公司;凝胶Sephadex LH 20:Pharmacia Biotech,Sweden。
试剂:乙腈、甲醇(色谱级,Merck公司);其他试剂,如乙酸乙酯、甲醇、丙酮、正丁醇、石油醚、三氯甲烷等(AR,上海国药集团);标准品尿嘧啶(5 g·瓶-1)(上海国药集团)。
1.2 实验仪器
微生物恒温培养箱(上海一恒科学有限公司,DHP9162A);大型恒温摇床培养箱(上海天星实验仪器制造有限公司,TS 211C);超声波清洗器(上海汉克科学仪器有限公司,SK250LH);光学显微镜(上海光学仪器一厂,XSP 44X.9);半制备HPLC仪器(Shimadazu,SPD M20A PDA);半制备HPLC仪器(Waters,2545);液质联用仪(HR ESI MS,Agilent,1290 HPLC 6224 TOF MS,分辨率≥20 000);旋转蒸发仪(上海亚荣生化仪器厂,RE3000A);反相半制备色谱柱:YMC Pack ODS AQ column(250×10 mm,S 5μm,12 nm,分离流速2.5 mL·min-1);正相半制备色谱柱:YMC Pack SIL 06 column(250×10 mm,S 5μm,6 nm,分离流速4.0 mL·min-1);核磁共振波谱仪(Bruker AM 400 spectrometer)。
1.3 菌株的分离鉴定
将南极大磷虾样品在超净工作台内用无菌海水冲洗表面,用研钵研碎,将处理好的样品加入装有10 mL无菌海水的50 mL无菌管中,样品震荡混匀后梯度稀释10-1、10-2、10-3,不同梯度分别取300μL菌液涂布于孟加拉红、PDA和YPD 3种固体培养基上,每个梯度样品做3个平行。涂布好的平板倒置于15℃培养箱中培养;培养约3~4周后长出菌落,依据菌落特征进行分离,挑取菌落接种至相应培养基上划线分离纯化培养,直至得到纯菌落。分离得一株真菌NJF7,菌株保存于YPD或孟加拉红斜面固体培养基,置于4℃冰箱进行保种;另用30%的甘油保种于-80℃的冰箱进行长期保存。然后转移到液体培养基送至上海美吉生物医药科技有限公司进行一代测序。
同时将灭菌的载玻片45°倾斜插入涂布真菌菌种的固体培养皿中,28℃培养箱中培养3~5 d,用光学显微镜观察菌丝形态特征,如菌落形状、大小、色泽、质地、有没有产生孢子等特点,并作记录。再参考张新军[20]和孙晶晶等[21]的研究对真菌进行初步的分类、鉴定。
1.4 菌株的次级代谢产物分离纯化
1.4.1 发酵液的获取
NJF7菌株接种在2只50 mL试管中(内有5 mL的YPD液体培养基),摇床恒温27℃培养活化5~7 d。将活化的NJF7菌株接种至2只1 000 mL三角瓶(内含500 mL YPD液体培养基)中,置于20℃160 r·min-1恒温摇床培养箱中,发酵培养5 d后得到种子发酵液。将发酵的种子液按一定比例接到装有YPD液体培养基的2 L三角瓶中,在20℃160 r·min-1恒温摇床培养箱中发酵培养,共得到培养发酵液约35.5 L。
1.4.2 次级代谢产物的提取分离
NJF7菌株发酵液35.5 L用布氏漏斗及定性中速(直径18 cm)的滤纸真空抽滤分为菌丝体和胞外滤液两部分。菌丝体置于-80℃冰箱中冷冻,48 h后取出放在室温解冻,解冻后依次加入3 L的丙酮和甲醇,用超声清洗器超声提取,各提取2次,得到菌丝体部分浸膏。胞外滤液约35.5 L,每1.6 L菌液分别用200 mL的乙酸乙酯和正丁醇萃取各2次,旋转浓缩得乙酸乙酯部分浸膏157.3 g,正丁醇部分浸膏19.0 g。乙酸乙酯部分与菌丝体提取浓缩的浸膏合并,质量为163.2 g,用650 mL的纯水溶解充分,再用325 mL的石油醚、乙酸乙酯、正丁醇3种试剂各萃取3次。萃取液真空低温旋蒸,除去有机溶剂,得到石油醚部分浸膏10.5 g;乙酸乙酯部分浸膏0.32 g;正丁醇部分浸膏与第一次正丁醇部分合并共31.3 g。
乙酸乙酯部分经Sephadex LH 20凝胶柱分离,通过TLC硅胶板点样分析得到NJF7I~VII 7部分。NJF7I部分经Waters正向柱制备,流动相为乙酸乙酯 石油醚。NJF7III部分过硅胶分为IIIa和IIIb,然后再用HPLC制备,各部分HPLC梯度洗脱程序以及化合物见表1。
用MCI柱分离正丁醇部分:用1 000mL水洗脱MCI柱4个柱体积,后用400mL甲醇∶水(V∶V=10∶90)淋洗,除去盐、糖、蛋白等杂质;依次用甲醇∶水(20∶80→50∶50→80∶20→100∶0)洗脱,每梯度洗脱液的用量为1 000 mL。洗脱下来的液体用旋转蒸发仪依次浓缩得到20%甲醇、50%甲醇、80%甲醇和100%甲醇4个部分。50%和80%甲醇部分经过硅胶分离后再通过HPLC制备,流动相为乙腈 水(水含0.1%三氟乙酸),各部分梯度洗脱程序以及化合物见表2。
2 结果与分析
2.1 菌种鉴定结果
曲霉属菌种NJF7在孟加拉红培养基培养,其培养特征(A)和在光学显微镜目镜10倍、物镜40倍条件下形态(B)见图1。
真菌NJF7菌落特点:菌落的颜色为黄绿色;质地丝绒状,形成放射状沟纹;没有渗出液;分生出来的孢子头形成疏松放射状;顶囊近球形;分生的孢子形状为球形、近球形。根据姚栗等[22]的研究结果,对照实验菌种的培养特征和显微形态,其与黄曲霉菌颜色形态一致。
菌株序列与生物信息学数据库GenBank(https://www.ncbi.nlm.nih.gov)进行序列的相似性比较分析,寻找最高相似性在98%左右的菌株,选取比对结果中与其相似性较高的模式株,然后对菌株构建系统发育树(图2)。
基因序列同源性比对分析发现,菌株NJF7与Aspergillus属模式种A.sydowii(KX958084.1)相似性最高,为99%,与A.sydowii(JN851025.1)在同一枝节。根据真菌的形态学特点,鉴定NJF7为曲霉Aspergillussydowii。
2.2 次级代谢产物鉴定结果
从菌株NJF7的代谢产物中分离出化合物,分别经HR ESI MS、1H NMR波谱学方法,鉴定了其中13个化合物。结构见图3。
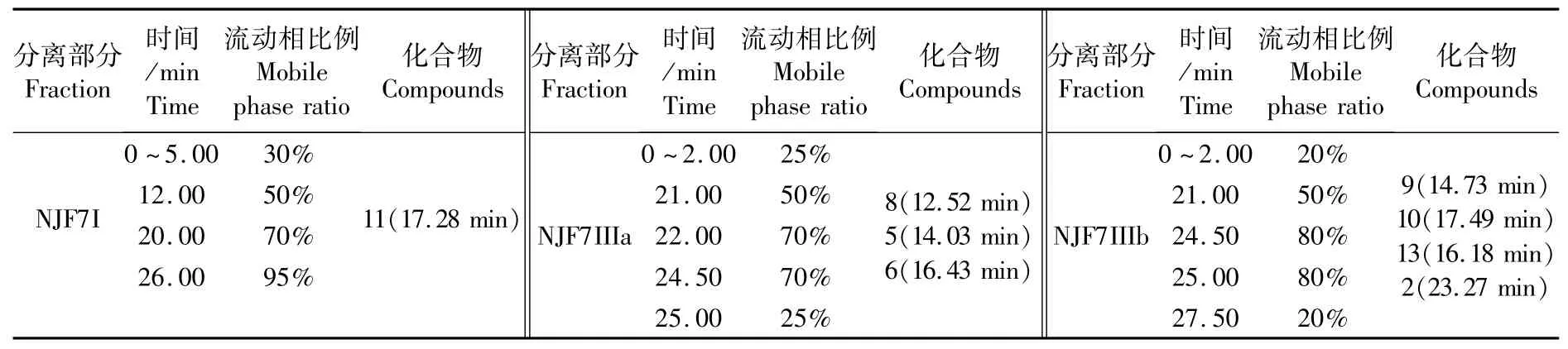
表1 乙酸乙酯各部分梯度洗脱程序表及化合物Tab.1 Gradient elution procedures and compounds of EA

表2 正丁醇部分梯度洗脱程序表及化合物Tab.2 Gradient elution procedures and compounds of n butyl alcohol
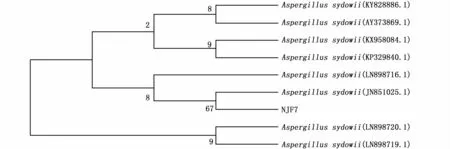
图2 基于菌株NJF7及其相应模式菌株的18S rDNA构建的系统发育树Fig.2 Neighbour joining phylogenetic tree based on 18S rDNA gene sequence for the position of strain NJF7
化合物1:浅黄色粉末,HR ESI MS谱得出准分子离子峰m/z261.117 7([M+H]+,计算值为261.116 1),提示其分子式为C14H16N2O3。1H NMR(pyr,600 MHz)数据如下:δH1.53(m,2H),1.81(m,1H),2.13(m,1H),3.29(dd,J=14.7,6.3 Hz,1H),3.36(m,1H),3.58(m,3H),4.09(t,J=8.0,8.5 Hz,1H),4.52(t,J=5.2,5.5 Hz,1H),7.08(d,J=8.4 Hz,2H),7.39(d,J=8.1 Hz,2H),8.58(s,1H)。该化合物数据与文献[23]报道一致,因此化合物1结构鉴定为环(脯氨酸 酪氨酸)。
化合物2:浅黄色粉末,HR ESI MS谱得出准分子离子峰m/z350.149 9([M+H]+,计算值为350.146 0),提示其分子式为C20H19N3O3。1H NMR(CD3OD,600 MHz)数据如下:δH2.61(dd,J=13.4,6.3 Hz,1H),2.83(dd,J=14.5,5.7 Hz,1H),3.03(dd,J=14.7,4.1 Hz,1H),3.51(dd,J=11.4,6.6 Hz,1H),3.58(m,1H),3.65(m,3H),3.90(m,1H),4.18(m,1H),6.60(m,2H),7.04(s,1H),7.07(m,1H),7.13(m,1H),7.17(m,3H),7.35(d,J=7.9 Hz,1H),7.60(d,J=8.0 Hz,1H)。该化合物数据与文献[24]报道一致,因此化合物2结构鉴定为环(色氨酸 酪氨酸)。

图3 从NJF7中分离得到的化合物结构式Fig.3 Structure formulas of com pounds isolated from NJF7
化合物3:黄色油状物,HR ESI MS谱得出准分子离子峰m/z245.127 9([M+H]+,计算值为245.121 2),提示其分子式为C14H16N2O2。1H NMR(CD3OD,600 MHz)数据如下:δH1.25(m,1H),1.82(m,2H),2.11(m,1H),3.18(m,2H),3.38(m,1H),3.55(m,1H),4.08(m,1H),4.46(m,1H),7.46(m,5H)。该化合物数据与文献[25]报道一致,因此化合物3结构鉴定为环(脯氨酸 苯丙氨酸)。
化合物4:黄色胶状物,HR ESI MS谱得出准分子离子峰m/z211.141 9([M+H]+,计算值为211.140 2),提示其分子式为C11H18N2O2。1H NMR(CD3OD,400 MHz)数据如下:δH0.97(m,6H),1.56(m,1H),1.67(m,1H),1.77(m,1H),1.92(m,2H),2.02(m,1H),2.33(m,2H),3.48(m,1H),3.56(m,1H),3.83(dd,J=9.7,6.0 Hz,1H),4.26(m,1H)。该化合物数据与文献[26]报道一致,因此化合物4结构鉴定为环(缬氨酸 脯氨酸)。
化合物5:黄褐色无定型粉末,HR ESI MS谱得出准分子离子峰m/z286.155 2([M+H]+,计算值为286.151 1),提示其分子式为C16H19N3O2。1H NMR(D2O,600 MHz)数据如下:δH0.13(d,J=7.3 Hz,2H),0.69(d,J=7.3 Hz,2H),1.33(m,1H),3.34(dd,J=15.1,5.3 Hz,1H),3.43(s,2H),3.54(dd,J=15.0,5.4 Hz,1H),3.77(m,3H),4.56(td,J=4.6,1.7 Hz,1H),7.24(m,1H),7.29(m,2H),7.55(d,J=9.3 Hz,1H),7.74(d,J=6.7 Hz,1H)。该化合物数据与文献[27]报道一致,因此化合物5结构鉴定为环(缬氨酸 色氨酸)。
化合物6:浅黄色粉末,HR ESI MS谱得出准分子离子峰m/z300.184 1([M+H]+,计算值为300.166 7),提示其分子式为C17H21N3O2。1H NMR(pyr,600 MHz)数据如下:δH0.83(t,J=7.3,7.5 Hz,3H),1.10(d,J=6.8 Hz,3H),1.18(m,1H),1.56(m,1H),2.15(m,1H),3.72(dd,J=14.5,8.1 Hz,1H),3.95(dd,J=14.5,4.6 Hz,1H),4.19(s,1H),4.77(m,1H),7.28(d,J=1.1 Hz,1H),7.33(m,1H),7.53(s,1H),7.60(m,1H),8.11(d,J=8.1 Hz,1H),9.10(d,J=26.0 Hz,2H),11.98(s,1H)。该化合物数据与文献[27-28]报道一致,因此化合物6结构鉴定为环(异亮氨酸 色氨酸)。
化合物7:浅黄色粉末,HR ESI MS谱得出准分子离子峰m/z315.169 3([M+H]+,计算值 为315.141 2),提 示 其 分 子 式 为C16H18N4O3。1H NMR(CD3OD,600 MHz)数据如下:δH0.98(m,1H),1.50(m,1H),1.70(m,1H),1.99(m,1H),3.29(m,1H),3.48(m,1H),4.02(m,1H),4.43(m,1H),7.03(m,1H),7.11(m,2H),7.35(dt,J=8.2,0.8 Hz,1H),7.59(dt,J=8.0,0.9 Hz,1H)。该化合物数据比文献[29]报道的环(天门冬酰胺 色氨酸)的数据多一个亚甲基信号,因此化合物7结构鉴定为环(谷氨酰胺 色氨酸)。
化合物8:白色粉末,1H NMR(D2O,600 MHz)数据如下:δH3.43(s,2H),6.48(d,J=17.2 Hz,1H),7.02(m,2H),7.64(m,3H).该化合物数据与文献[30]报道一致,因此化合物8结构鉴定为对羟基肉桂酸甲酯。
化合物9:浅黄色针状结晶,与标准品作对照鉴定化合物为尿嘧啶。
化合物10:黄色无定形粉末,HR ESI MS谱得出准分子离子峰m/z138.089 9([M+H]+,计算值为138.087 4),提示其分子式为C8H11NO。1H NMR(CD3OD,600 MHz)数据如下:δH2.53(t,J=7.7,7.6 Hz,1H),2.80(t,J=7.6,7.7 Hz,1H),6.69(m,1H),7.02(m,1H)。该化合物数据与文献[31]报道一致,因此化合物10结构鉴定为对羟基苯乙胺。
化合物11:黄色油状物,HR ESI MS谱得出准分子离子峰m/z122.096 6,([M+H]+,计算值为122.096 4),提示其分子式为C8H11N。1H NMR(CDCl3,600 MHz)数据如下:δH2.71(m,1H),2.98(t,J=7.7,8.0 Hz,1H),7.23(m,1H),7.31(m,1H)。该化合物数据与文献[32]报道一致,因此化合物11结构鉴定为苯乙胺。
化合物12:白色粉末,1H NMR(CD3OD,400 MHz)数据如下:δH2.56(t,J=7.7,7.5 Hz,1H),2.80(t,J=7.7,7.7 Hz,1H),3.62(s,1H),6.67(d,J=8.1 Hz,1H),7.00(d,J=8.6 Hz,1H)。该化合物数据与文献[33]报道一致,因此化合物12结构鉴定为N 甲基酪胺。
化合物13:无色针状晶体,1H NMR(pyr,600 MHz)数据如下:δH2.82(t,J=7.9,7.5 Hz,1H),3.08(t,J=7.7,7.7 Hz,1H),3.57(s,3H),7.10(d,J=9.4 Hz,1H),7.26(d,J=5.7 Hz,1H)。该化合物数据与文献[34]报道一致,因此化合物13结构鉴定为大麦芽碱。
3 讨论
曲霉NJF7是本课题组在南极大磷虾肠道微生物中分离到的第一株真菌,从其发酵液提取物中鉴定了13个代谢产物结构,化合物结构类型包含二酮哌嗪(1~7)、芳香酸(8)、生物碱类(9~13)。化合物7环(谷氨酰胺 色氨酸)(天然成分)首次从曲霉属真菌中分离。环肽作为天然产物的一类,通常单独存在或嵌入在更大、更复杂的结构中,在真菌、细菌、海洋海绵和植物中的次级代谢产物中都有获得[35]。环肽类化合物由于具有抗肿瘤、抗菌、抗真菌等生物活性而备受研究者关注[29]。例如化合物2对L 929、K 562和HeLa细胞系具有较弱的抗增殖和细胞毒作用[23]。目前已发现的上百个环肽类化合物绝大部分来自于海洋生物,其中海洋微生物所产生的一些特殊环肽显示出很好的抗肿瘤活性。本研究获得的芳香酸和生物碱类化合物也表现出良好的活性,例如化合物12可以刺激胃泌素的释放,在低剂量(25μg·kg-1)时就可获得最大的释放活性[33]。后期对化合物7的活性将继续探讨。
但是,通过对NJF7次级代谢产物的研究,发现目前鉴定的次级代谢产物种类少、结构单一、新颖性不足,结构比较复杂的化合物未能被获得,因此未进一步开展化合物的活性筛选。这可能由于本实验只使用了YPD一种发酵培养基且培养条件比较简单的缘故。后期将从培养基种类以及培养条件进行优化,以期得到较为新颖、具有较好生物活性的化合物乃至具有新药开发前景的天然产物。RUI等[27]在海绵中结合宏基因组学的方法分离到11个环肽成分,在以后的研究中可以考虑首先通过宏基因组学对样品中具有生物活性的小分子进行预估,以节省分离时间,提高分离效率。

