化疗诱导的衰老细胞胞外囊泡的分离及相关特性研究①
周 琦 丁丽丽 李 芬 刘爱国 周学锋 杨 燕
(华中科技大学同济医学院附属同济医院,武汉 430000)
细胞衰老是指细胞受到外界压力时细胞周期进入长久停滞的状态。细胞衰老可分为复制性衰老与治疗诱导性衰老(therapy-induced senescence,TIS)[1]。复制性衰老是对DNA损伤、癌基因激活、端粒缩短等的应急反应,是阻止肿瘤发生的一种自我保护机制。TIS是指放疗、化疗或药物靶向治疗引起的肿瘤细胞衰老,其可由治疗导致的DNA损伤或抑制细胞分裂必需的激酶(如极光激酶aurora kinase,AURKA)引起[2]。TIS因其能使肿瘤细胞进入生长静止期且其药物毒性远低于细胞凋亡而倍受关注。早期研究在肺癌、乳腺癌中观察到化疗诱导的细胞衰老与治疗应答正相关[3,4]。衰老的肿瘤细胞停止分裂,肿瘤进展得到控制。近期研究表明化疗诱导的细胞衰老是一把“双刃剑”:一方面衰老细胞周期阻滞可有效控制肿瘤生长;另一方面衰老细胞并没有死亡,其可自分泌或旁分泌生长因子、细胞因子及蛋白酶等,这种现象称为衰老相关的分泌表型(senescence-associated secretory phenotype,SASP)。SASP 可使衰老的成纤维细胞转成促炎细胞,产生炎症因子和基质金属蛋白酶,促进周边非衰老肿瘤细胞生长、复发[5,6]。衰老细胞可分泌胞外囊泡(EVs),其分泌的EVs能够调节受体细胞表型,如加速衰老、炎症、干细胞失能与癌症进展,功能类似于SASP,因此认为衰老相关EVs(senescence-associated EVs,SAEs)是一类新的SASP因子[7]。为了解SAEs对肿瘤细胞及免疫细胞的影响,本文利用AURKA抑制剂MLN8237处理神经母细胞瘤细胞系IMR32建立细胞衰老模型,收集培养上清中衰老细胞分泌的EVs(SAEs),分别观察SAEs对IMR32细胞与单核细胞THP-1的影响,初步判断SAEs是否影响肿瘤微环境相关细胞,为进一步探讨SAEs对肿瘤微环境的影响及其机制提供参考。
1 材料与方法
1.1材料 化疗药物阿霉素、顺铂及AURKA抑制剂 MLN8237购自MCE公司;RIPA细胞裂解液购自武汉生命公司;蛋白酶抑制剂购自Roche公司;BCA蛋白定量试剂盒购自Pierce公司;衰老相关β-gal染色试剂盒购自GENEMED科技公司;AURKA、 pAURKA、GAPDH、 TSG101、 GRP78、 β-actin、C-MYC、N-MYC及BRD4抗体购自Arigo公司;Rb及p-Rb抗体购自Arigo公司;PI与RNaseA购自谷歌公司;定量RT-PCR试剂盒PrimeScriptTMRT Master Mix (Perfect Real Time)与TB Green®Fast qPCR Mix试剂盒购自TaKaRa公司;外泌体分离试剂盒Exoquick购自广州锐博生物公司。神经母细胞瘤细胞系IMR32、SK-N-SH、SK-N-BE2及单核细胞系THP-1购自ATCC;DMEM、MEM、RPMI1640培养基、胎牛血清购自Gibco;化学发光显色试剂、2-硫基乙醇、DMSO、肉豆蔻酸佛波酯(phorbol myristate acetate,PMA)购自Sigma公司;TRIzol购自Invitrogen。
1.2方法
1.2.1细胞培养 IMR32与SK-N-SH 用含10%胎牛血清、100 μg/ml青链霉素的DMEM培养于37℃、5% CO2培养箱;SK-N-BE2培养于含10%胎牛血清的MEM/F12;THP-1用含10%胎牛血清、0.05 mmol/L 2-巯基乙醇的RPMI1640培养基培养。待细胞生长至对数期用于实验。
1.2.2细胞周期检测 细胞(IMR32、SK-N-SH、SK-N-BE2)以3×105个/孔接种于6孔板,第2天分别加入0.5 μmol/L阿霉毒(Doxorubicin)、0.5 μmol/L顺铂(Cisplatin)及0.5 μmol/L MLN8237处理72 h,以不加药的培养基(Medium)或DMSO为对照组。胰酶消化后,加入冷无水乙醇,-20℃固定1 h。将固定好的细胞离心弃无水乙醇,冷PBS洗2次。加入RNaseA溶液,37℃水浴30 min。加入PI染色液,充分混匀后4℃避光孵育30 min,流式细胞仪检测。
1.2.3衰老相关β-半乳糖苷酶(SA-β-gal)活性检测 IMR32细胞以3×105个/孔接种于6孔板,第2天加入0.5 μmol/L MLN8237处理72 h,设置未经药物处理的正常对照组。按照SA-β-gal染色试剂盒说明书染色细胞,37℃孵育16 h,镜下观察蓝染细胞并拍照。
1.2.4EVs收集与鉴定 将含10%胎牛血清的DMEM培养基以170 000 g、4℃超速离心2 h后弃去血清中EVs,收集上清,0.22 μm过滤后备用。IMR32细胞用上述含EVs-free血清的DMEM培养至对数生长期,0.5 μmol/L MLN8237处理72 h后收集上清,分别用超速离心技术或PEG技术分离EVs。超速离心技术:2 000 g离心10 min,10 000 g 4℃离心30 min弃去细胞碎片,4℃ 170 000 g离心2 h,所得沉淀用PBS重悬,保存备用。利用PEG技术根据Exoquick试剂盒说明书分离EVs。Western blot检测两种方法得到的EVs后选取超速离心得到的EVs送至广州表观生物技术公司分析囊泡粒径与浓度。
1.2.5Western blot分析EVs对肿瘤细胞影响 收集处理好的细胞或EVs样本,用含蛋白酶抑制剂的RIPA裂解液冰上裂解,提取总蛋白,蛋白经BCA法定量。总蛋白变性后每孔上样20 μg行SDS-PAGE电泳分离。凝胶经转移缓冲液平衡后,将蛋白转印到NC膜,5%脱脂牛奶常温封闭1 h,加入一抗4℃过夜。所用一抗使用浓度分别为:AURKA(1∶2 000),pAURKA(1∶1 000),GAPDH(1∶5 000),TSG101(1∶1 000),GRP78(1∶1 000),β-actin(1∶1 000),C-MYC(1∶1 000),N-MYC(1∶1 000),BRD4(1∶1 000)。TBST漂洗后加二抗(1∶10 000),37℃孵育1 h。NC膜浸泡于等量ECL发光试剂A、B混合液数秒,于化学发光成像系统扫描成像。
1.2.6显微成像及RT-qPCR分析EVs对巨噬细胞的影响 THP-1细胞接种至6孔板培养至对数生长期,分别加入SAEs(SAEs组)、肿瘤细胞来源EVs(EVs组),以不加EVs为阴性对照(Non-treated组),PMA处理组(PMA组)为阳性对照。培养96 h后收集细胞,显微观察并成像记录细胞形态;TRIzol法提取mRNA。逆转录得到cDNA;各基因定量PCR采用TB Green®Fast qPCR Mix试剂盒完成。引物序列见表1。PCR程序如下:95℃变性2 min;95℃ 10 s,60℃ 10 s;72℃ 10 s,共40个循环;72℃延伸1 min。以GAPDH作为内参,各目的基因mRNA水平用2-ΔΔCt表示。

2 结果
2.1细胞衰老模型建立 3种药物中,MLN8237诱导细胞周期阻滞最明显;阻滞于G2/M期的IMR32细胞比例最高,达87.4%。阿霉素作用神经母细胞瘤导致细胞周期阻滞程度最轻,顺铂组细胞阻滞程度中等(图1A)。0.5 μmol/L MLN8237可抑制AURKA磷酸化,导致细胞周期阻滞与细胞衰老(图1B)。通常衰老细胞形态变化表现为体积和细胞核增大、核膜内折、细胞器变形等,同时β-gal活性上调,底物X-gal在β-半乳糖苷酶催化下生成蓝色产物。图1C显示0.5 μmol/L MLN8237处理IMR32细胞72 h后,与正常组比较,加药组细胞呈现大而扁平的衰老状态,镜下所见几乎所有细胞均变大且蓝染。因此,选择MLN8237作用IMR32细胞建立细胞衰老模型用于后续实验。

表2 EVs颗粒大小与浓度

图1 细胞衰老模型的建立Fig.1 Establishment of cell senescence model

图2 SAEs的分离与鉴定Fig.2 Isolation and identification of SAEs

图3 SAEs抑制IMR32细胞BRD4通路Fig.3 SAEs inhibits BRD4 pathway in IMR32 cells
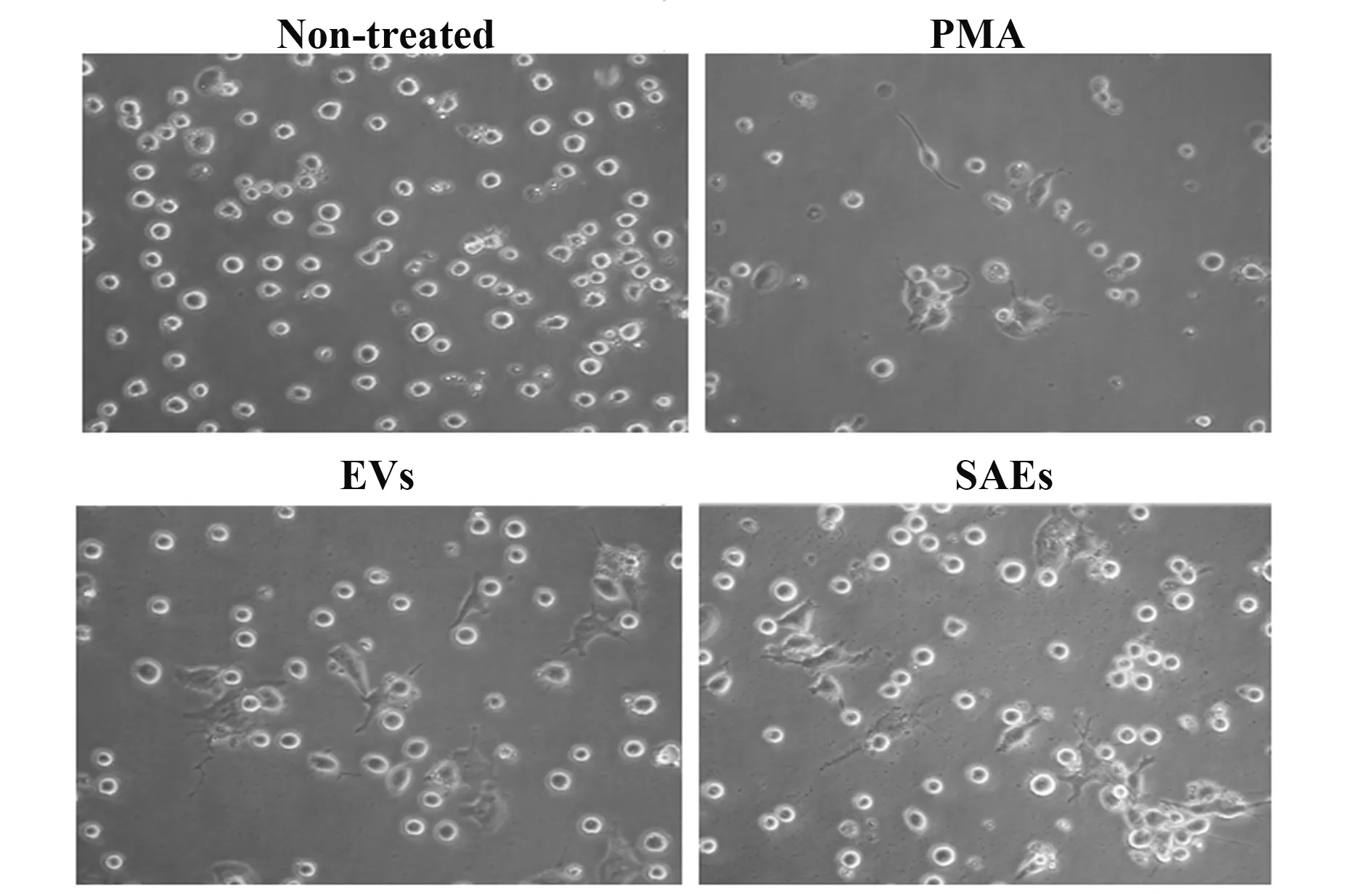
图4 SAEs诱导THP-1细胞极化Fig.4 SAEs induced THP-1 cell polarization
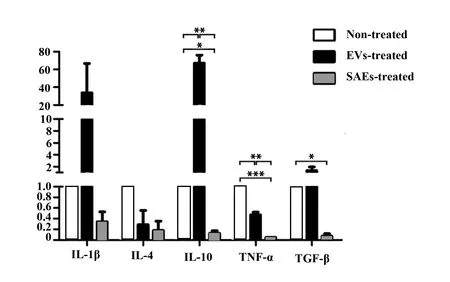
图5 SAEs抑制THP-1细胞相关细胞因子表达Fig.5 SAEs inhibited cytokines expression of THP-1 cellNote:*.P<0.05;**.P<0.01;***.P<0.001.
2.2超速离心收集衰老细胞上清EVs Western blot结果显示,两种方法分离样本的膜蛋白TSG101在IMR32细胞及EVs样品中均有表达,定位于胞浆的蛋白GRP78及β-actin只在细胞样品中检出,EVs样品中没有发现阳性条带。超速离心收集的EVs样品中TSG101含量明显高于PEG法分离的EVs(图2A)。衰老细胞与对照细胞分泌的EVs平均粒径差异无统计学意义,但SAEs浓度明显降低,可能与衰老细胞停止分裂,细胞数目显著低于对照细胞有关(图2B、表2)。由表2可知SAEs颗粒大小处于30~150 nm的颗粒百分比明显高于对照组,即SAEs外泌体含量高于对照组。
2.3SAEs抑制IMR32细胞BRD4通路 与对照EVs相比,SAEs显著抑制BRD4与C-MYC表达,对β-catenin、AURKA、N-MYC、Rb及p-Rb表达影响不显著。对照EVs明显上调C-MYC,对Rb与p-Rb的水平有明显抑制作用(图3)。
2.4SAEs影响THP-1细胞分化状态 不同细胞来源的EVs与单核巨噬细胞共同孵育96 h后THP-1细胞形态如图4,未处理的阴性对照组细胞处于正常悬浮状态;PMA组细胞发生极化,贴壁伸出伪足;两种EVs处理组细胞状态与PMA处理组相似。RT-qPCR结果表明,两种来源EVs均能抑制巨噬细胞表达TNF-α,且SAEs的抑制效果显著高于肿瘤细胞来源EVs;与未处理对照组相比,SAEs显著抑制巨噬细胞表达IL-10与TGF-β,而肿瘤细胞来源EVs大幅上调了这两种蛋白特别是IL-10表达;EVs与SAEs对巨噬细胞内IL-1β与IL-4的表达影响均无统计学差异(图5)。
3 讨论
低浓度化疗药物诱导肿瘤细胞衰老是化疗控制肿瘤的机制,细胞衰老同时伴随细胞周期阻滞。本文利用3种神经母细胞瘤细胞系,分析了不同化疗药物诱导细胞周期阻滞情况。结果表明不同药物诱导细胞阻滞效果不同,同种药物作用不同细胞诱导细胞周期阻滞的效果也不同。例如临床常用药物阿霉素诱导3种神经母细胞瘤细胞周期阻滞效果均不明显;另一种化疗药物顺铂对SK-N-SH细胞系几乎无影响,但能诱导约50%的IMR32细胞周期阻滞于G2/M期。三种药物中,AURKA抑制剂MLN8237效果最明显,有87.4% IMR32细胞阻滞于G2/M期。β-半乳糖苷酶染色显示,几乎所有镜下细胞均蓝染,细胞大而扁平,呈现典型衰老状态。因此,课题组利用MLN8237作用IMR32细胞建立细胞衰老模型研究衰老相关胞外囊泡。
EVs是细胞主动释放的纳米级膜囊泡,是肿瘤微环境的重要成分,在细胞通讯中发挥重要作用。基于其生物发生、大小和物理性质,可进一步分类为外泌体和微泡。其中直径30~150 nm的颗粒为外泌体。外泌体中含有miRNA、mRNA、DNA片段和蛋白质,从供体细胞穿梭到受体细胞,是细胞间信息传送的重要媒介[8,9]。各种细胞均可以分泌EVs,尽管经化疗药物诱导的SAEs低于未处理细胞,但外泌体所占百分比高于未处理细胞,说明细胞在药物刺激下,细胞向外传递信息的“包裹”增加。SAEs中具体包含哪些信息目前尚未明确,本研究结果显示SAEs明显抑制了肿瘤细胞内BRD4/C-MYC通路。BRD4全称为溴结构域蛋白4(bromodomain-containing protein 4),为BET家族成员。有研究显示,BRD4表达失调与血癌、乳腺癌及结肠癌等多种癌症有关[10]。BRD4蛋白能够与RNA聚合酶Ⅱ(Pol Ⅱ)正向转录延长因子(positive transcription elongation factor b,P-TEFb)结合共同参与MYC、BCL2和BCL6等癌基因的转录[11]。有研究表明,BRD4蛋白占据了超级增强子的基因位置,能让癌细胞保持相对不成熟的类干细胞状态,在一定程度上驱动癌症[12]。本文SAEs抑制了BRD4水平,发挥其抑癌效果,相对于肿瘤来源EVs其抑制C-MYC效果更明显。而肿瘤来源EVs,更多地显示了促癌作用,不仅上调了C-MYC表达,对Rb与磷酸化Rb也有明显抑制作用。
观察SAEs对免疫细胞调节作用发现肿瘤细胞来源EVs和SAEs均可诱导THP-1细胞分化为巨噬细胞,分化出的巨噬细胞会因诱导因素的不同而表现出不同表型和功能,即巨噬细胞的极化,表现为M1型和M2型巨噬细胞。M1型巨噬细胞通过分泌促炎细胞因子和趋化因子,并专职提呈抗原,参与正向免疫应答,发挥免疫监视功能;M2型巨噬细胞仅有较弱抗原提呈能力,其通过分泌抑制性细胞因子IL-10和/或TGF-β等下调免疫应答,在免疫调节中发挥重要作用[13]。本文利用肿瘤细胞来源EVs或SAEs作用THP-1细胞,引起胞内相关分子变化。在肿瘤微环境中免疫细胞处于抑制状态,这种抑制可能由肿瘤细胞分泌的EVs介导[14]。本研究结果显示SAEs能够显著降低免疫细胞表达IL-10与TGF-β,减轻免疫抑制状态。提示化疗诱导衰老细胞分泌的胞外囊泡传递的信息有利于肿瘤预后。
综上,AURKA抑制剂MLN8237可以诱导神经母细胞瘤细胞IMR32衰老,SAEs一方面通过抑制BRD4/C-MYC通路影响肿瘤细胞生长,另一方面通过影响巨噬细胞极化减轻免疫抑制,为临床使用低剂量化疗药物诱导肿瘤细胞衰老从而限制肿瘤增殖提供理论依据。由于本文实验观察的时间点较早,且所检测的信号通路蛋白不够全面,SAEs对肿瘤预后不利的一面及其对微环境中基质细胞影响还有待进一步研究。SAEs对肿瘤微环境影响的深入研究可为临床化疗效果评估提供参考。