利用慢病毒介导hTERT基因建立永生化髓核细胞系
李大鹏 徐从艳 金沧海 刘勇

[摘要] 目的 以慢病毒介導人端粒酶逆转录酶(hTERT)基因转染体外培养的人髓核细胞,建立永生化髓核细胞系,为后期转基因与动物实验提供种子细胞。方法 利用机械与酶消化的方法获得正常的人椎间盘髓核细胞,将构建好的重组慢病毒-hTERT(pLVX-hTERT)转染第2代体外单层培养的髓核细胞。用重组慢病毒-增强型绿色荧光蛋白作为标记物,在荧光电镜下观察细胞转染效率,按感染复数(MOI)40、60、80、100设组,选择出病毒转染的最佳MOI;设立pLVX-hTERT转染组、空病毒转染对照组及空白细胞对照组。在倒置显微镜下观察髓核细胞的形态,用反转录聚合酶链反应、细胞免疫荧光技术检测转染后hTERT基因在髓核细胞内的表达情况,用反转录聚合酶链反应检测髓核细胞Ⅱ型胶原及蛋白多糖的表达情况。结果 慢病毒转染细胞后第6天,MOI为100时转染效率最高,可达82.9%。pLVX-hTERT转染组在转染后第7、15、30、60、90天均可检测到hTERT基因的表达,而两对照组则未见表达。pLVX-hTERT转染组保持了髓核细胞的形态,两对照组的细胞则出现返祖现象。pLVX-hTERT转染组细胞的蛋白多糖及Ⅱ型胶原基因表达水平较其他两组均明显增高(F=173.5、111.1,P<0.05),而两对照组之间则无明显差异(P>0.05)。结论 pLVX-hTERT成功转染人椎间盘髓核细胞,转染pLVX-hTERT后的髓核细胞持续表达hTERT,获得永生化的能力,且分泌Ⅱ型胶原及蛋白多糖的量增加。
[关键词] 末端转移酶端粒;慢病毒属;转染;髓核;胶原Ⅱ型;蛋白聚糖类
[中图分类号] R394;R681.5 [文献标志码] A [文章编号] 2096-5532(2020)05-0531-05
doi:10.11712/jms.2096-5532.2020.56.122 [开放科学(资源服务)标识码(OSID)]
[ABSTRACT] Objective To construct an immortalized nucleus pulposus cell line using the human nucleus pulposus cells cultured in vitro and transfected with the lentivirus-mediated human telomerase reverse transcriptase (hTERT) gene, and to provide seed cells for transgenic and animal experiments in future. Methods The mechanical and enzymatic digestion method was used to obtain normal human nucleus pulposus cells of the intervertebral disc, and the second-generation monolayer nucleus pulposus cells cultured in vitro were transfected with recombinant lentivirus-hTERT (pLVX-hTERT). With the recombinant lentivirus-enhanced green fluorescent protein as a marker, a fluorescent electron microscope was used to observe transfection efficiency. The cells were divided into groups based on a multiplicity of infection (MOI) of 40, 60, 80, and 100 to screen out the optimal MOI. The pLVX-hTERT transfection group, the empty virus transfection group, and the blank control group were established. An inverted microscope was used to observe the morphology of nucleus pulposus cells; RT-PCR and cell immunofluorescence were used to measure the expression of the hTERT gene in nucleus pulposus cells after transfection, and RT-PCR was used to measure the expression of type Ⅱ collagen and proteoglycan in nucleus pulposus cells. Results On day 6 after lentiviral transfection, the transfection efficiency reached the highest level of 82.9% at the MOI of 100. The expression of the hTERT gene was observed in the pLVX-hTERT transfection group on days 7,15,30,60, and 90 after transfection, while such expression was not observed in the two control groups. The morphology of the nucleus pulposus cells was maintained in the pLVX-hTERT transfection group, while atavism was observed in the two control groups. The pLVX-hTERT transfection group had significantly higher mRNA expression of proteoglycan and type Ⅱ collagen than the other two groups (F=173.5,111.1;P<0.05), while there were no significant diffe-rences between the two control groups (P>0.05). Conclusion Human nucleus pulposus cells of the intervertebral disc are successfully transfected with pLVX-hTERT, and after pLVX-hTERT transfection, nucleus pulposus cells have persistent expression of hTERT and thus acquire the ability for immortalization, with increases in the secretion of type Ⅱ collagen and proteoglycan.
[KEY WORDS] lentivirus; nucleus pulposus; transfection; immortalized; collagen type Ⅱ; proteoglycans
随着社会人口老龄化,腰椎间盘突出症和慢性腰痛的发病率逐年增高,而椎间盘内的髓核细胞逐渐衰老、凋亡是椎间盘退变的主要病因之一[1]。髓核细胞的活性降低,致使椎间盘内水分、胶原、蛋白多糖等丢失,MR检查表现为T2值下降,可从影像学上证实椎间盘的退变[2]。随着国内外学者对椎间盘细胞外基质合成与分解关系研究的深入,应用生物学方法治疗椎间盘退变疾病成为近年来基础研究领域的热点[3]。髓核细胞是分泌髓核内基质的主要细胞,但在体内含量较少且活性较低,在体外培养容易发生去分化,丧失正常髓核细胞的表型与功能[4],这限制了其在生物学治疗脊椎退行性变方面的应用。为解决髓核细胞体外培养去分化的问题,有研究者利用人端粒酶逆转录酶(hTERT)基因的生物学作用诱导端粒长度,进而克服髓核细胞的衰老和凋亡[5]。hTERT转染建立的细胞系是正常细胞,具有正常的核型和细胞功能[6]。本实验以慢病毒介导hTERT基因转染正常髓核细胞,建立永生化髓核细胞系,以期为后续髓核细胞移植治疗腰椎退行性变疾病的动物实验提供种子细胞。
1 材料与方法
1.1 主要材料
重组慢病毒-hTERT(pLVX-hTERT,病毒滴度为1×1011/L)和重组慢病毒-增强型绿色荧光蛋白(pLVX-EGFP,病毒滴度为1×1010/L),由深圳百恩维生物科技有限公司包装。DMEM培养液(Hyclone),胎牛血清(FBS,Gibco),Trizol液(Invitrogen),胰蛋白酶、Ⅱ型胶原酶、PBS(碧云天),兔抗hTERT多克隆抗体(博奥森),荧光素标记抗兔IgG(中杉金桥)。聚合酶链反应(PCR)分析仪、反转录聚合酶链反应(RT-PCR)试剂盒(Takaka)、PCR引物甘油醛-3-磷酸脱氢酶(GAPDH)、2 g/L Triton X100和40 g/L多聚甲醛由青岛大学附属医院中心实验室提供。hTERT、Ⅱ型胶原及蛋白多糖引物由上海生物公司合成。
1.2 正常人椎间盘髓核细胞的提取与培养
本实验的椎间盘髓核标本来源于1例17岁男性的正常椎间盘髓核组织(病人为车祸伤,同意标本采集并签署知情同意书)。将标本自手术室取出后,迅速放入超净工作台内培养皿中,用PBS 清洗3 次,仔细辨认分离出髓核组织,用眼科剪将髓核组织修剪成1 mm3大小的组织块,用2.5 g/L的胰蛋白酶消化20 min,低速离心去上清,加入Ⅱ型胶原酶(使其工作浓度为2.0 g/L),置于37 ℃的水浴锅中消化4~6 h,将消化液用100 μm 的细胞筛过滤,收集细胞。以每瓶4×105个的细胞密度将细胞培养于25 cm2的培养瓶中,以含体积分数0.10 FBS的DMEM为培养液,置于含体积分数0.05 CO2、37 ℃细胞培养箱中培养,6 d后第1次换液,贴壁生长后2~3 d 换液1次,待细胞生长至80%~90%融合时传代接种到6孔板中,每孔1×105个细胞。
1.3 实验分组及处理
用pLVX-EGFP作为标记物,在荧光电镜下观察细胞转染效率,按感染复数(MOI)40、60、80、100在96孔板中设组,选择出病毒转染的最佳MOI。实验分为pLVX-hTERT转染组(C组)、空病毒转染对照组(B组)以及空白细胞对照组(A组)。待第2代的髓核细胞达到70%~80%融合时,pLVX-hTERT转染组和空病毒转染对照组分别以pLVX-hTERT和空病毒载体进行转染(空白细胞对照组不转染),转染前用PBS 清洗细胞2次,按筛选出的最佳MOI 加入病毒转染液3 mL,置于含体积分数0.05 CO2、37 ℃细胞培养箱中培养24 h,弃去病毒转染液,使用PBS冲洗2次,加入含体积分数0.10 FBS的DMEM培养液,置于含体积分数0.05 CO2、37 ℃细胞培养箱中培养,于转染后72 h及传代后在荧光显微镜下观察病毒转染情况及细胞状态。
1.4 各组hTERT及Ⅱ型胶原和蛋白多糖基因表达的RT-PCR检测
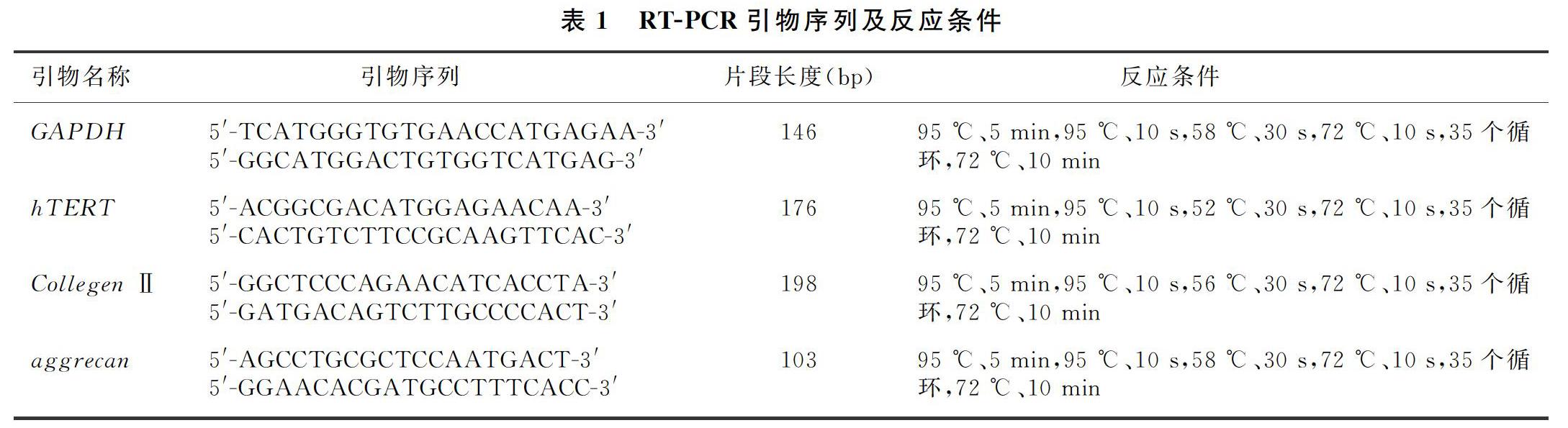
为检测pLVX-hTERT转染组转染后hTERT转录水平及hTERT对Ⅱ型胶原和蛋白多糖表达水平的影响,分别于转染后第7、15、30、60、90天时检测hTERT的基因表达水平,分别于转染后第7、15、30、60天时检测Ⅱ型胶原和蛋白多糖的基因表达水平。由于髓核细胞在体外培养随着传代次数的增加,细胞出现反分化现象,失去髓核细胞特性,故两对照组仅于第7天时测量蛋白多糖及Ⅱ型胶原表达水平。取各组细胞各自混匀后,用Trizol法提取各组RNA,将RNA反转录成cDNA,以cDNA为模板在PCR仪上进行PCR反应,PCR产物以20 g/L的琼脂糖凝胶电泳鉴定。RT-PCR引物序列及反应条件见表1。hTERT、Ⅱ型胶原和蛋白多糖的表达水平以目的基因与内参基因GAPDH灰度值的比值表示。
1.5 各组hTERT 蛋白表达的细胞免疫荧光检测
分别于转染后第7、15、30、60、90天時,取各组髓核细胞进行细胞爬片,24 h后用40 g/L多聚甲醛室温固定30 min;用PBS洗3次,每次3~5 min;加2 g/L Triton X100室温孵育5 min;用PBS洗3次,每次3~5 min;以体积分数0.10正常山羊血清封闭其他抗原30 min;滴加一抗(1∶100)4 ℃孵育过夜;PBS洗3次,每次3~5 min;滴加荧光标记二抗(1∶200)室温湿盒避光孵育1 h;PBS洗3次,每次3~5 min;加DAPI室温湿盒避光孵育5 min;PBS洗1次、去离子水洗2次,每次3~5 min;抗荧光淬灭剂封片。在荧光显微镜下观察、拍片。
2 结 果
2.1 最佳转染效率的筛选及表达时效的观察
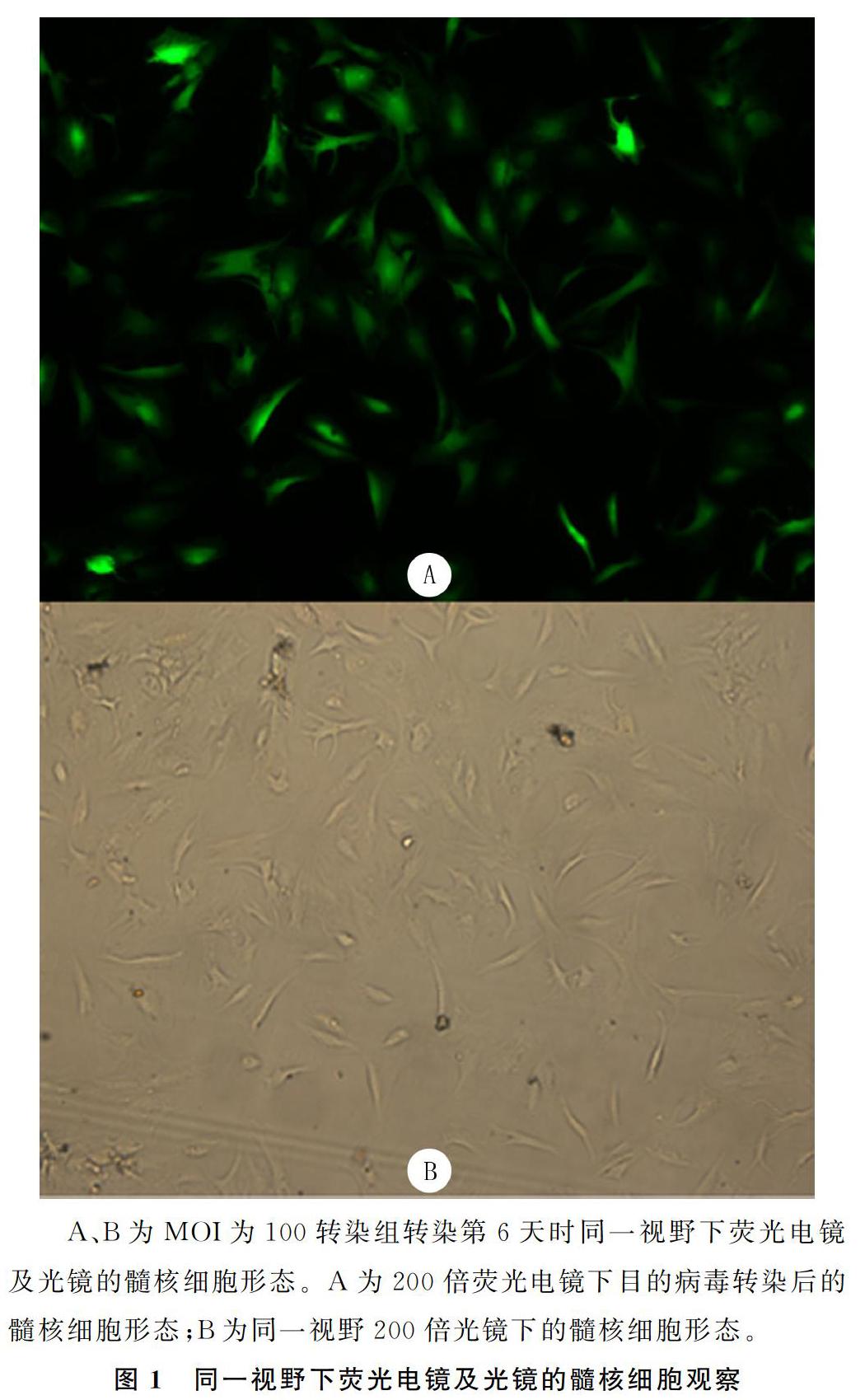
通过荧光电镜观察转染荧光强度及光镜下观察细胞形态与数目显示,MOI为100时转染组的转染效率最高,转染第6天时,转染效率可达到82.9%(图1);绿色荧光表达阳性细胞比例随细胞传代次数的增加,有逐渐减少趋势,但趋势不明显,至培养第90天时,绿色荧光蛋白表达阳性细胞比例约为69.5%。两对照组髓核细胞传到第5代时,生长速度变得缓慢,光镜下观察细胞突起延长,呈梭形,胞质逐渐减少,折光性较差;传至第6代时,细胞演变为长梭形,生长滞缓,并出现老化现象。而pLVX-hTERT转染组细胞传至第15代时,光镜下观察髓核细胞仍呈多角形、短梭形,细胞形态饱满、胞浆丰富,形态正常,细胞代谢旺盛,增殖能力较强,与未转染病毒的前3代髓核细胞形态无明显差异。截止到撰稿时建立的永生化髓核细胞系已传代25代,髓核细胞的形态与活性状态良好。
2.2 各组hTERT基因表达水平
RT-PCR检测结果显示,两对照组的目的基因不表达,而pLVX-hTERT转染组在转染后的第7、15、30、60、90天均可检测到hTERT基因表达,在转染第15天后hTERT基因处于较稳定的高表达状态。pLVX-hTERT转染组转染后第15、30、60、90天的hTERT基因表达水平显著高于转染后第7天(F=65.7,P<0.05),而第15、30、60、90天时的表达水平差异无显著意义(P>0.05)。见图2。细胞免疫荧光检测结果与RT-PCR检测结果一致,即对照组髓核细胞无hTERT的表达,pLVX-hTERT转染组髓核细胞的细胞质和细胞核中均可以检测到hTERT的表达。
2.3 hTERT基因对髓核细胞合成细胞外基质影响
RT-PCR检测的结果显示,pLVX-hTERT转染组细胞的蛋白多糖及Ⅱ型胶原基因表达水平较两对照组均明显增高(F=173.5、111.1,P<0.05),而两对照组之间差异则无显著意义(P>0.05)。转染第15天后,随着hTERT基因的稳定高表达,pLVX-hTERT转染组髓核细胞中蛋白多糖及Ⅱ型胶原基因表达水平也达到较稳定的高表达状态,各转染组之间差异无显著性(P>0.05)。见表2。
3 讨 论
目前,利用组织工程的方法进行髓核细胞移植治疗椎间盘退行性变疾病已成为脊柱领域研究的新方向,但是髓核细胞的活性较低,并且随着传代次数的增加,细胞出现反分化现象,细胞的生物活性降低,這些限制了髓核细胞移植的相关研究进行。建立具有高活性且没有去分化现象的髓核细胞系,是解决髓核细胞种子不足的有效途径。目前已证实多种病毒或基因可以有效促进细胞永生化,例如乳头瘤病毒E6和E7、猿猴病毒的大T抗原40(SV40)、反转录病毒E1A、人T细胞白血病病毒、EB病毒、疱疹病毒和hTERT等[7-9]。另有研究发现,癌基因c-myc等也可使细胞具有永生化的能力,但其成瘤性较强[10]。上述基因中,SV40和hTERT在建立人永生化髓核细胞系方面优势更为明显。SV40基因可使哺乳动物及人源多种组织细胞逃逸衰老和增殖危机,因此具有使培养细胞永生化的能力[11]。SAKAI等[12]将取自1例19岁男性爆裂性腰椎骨折病人的髓核进行体外培养,以SV40转染髓核细胞,结果显示被转染的细胞生物活性较高,细胞凋亡比例明显降低,并且较长时间处于分裂增殖状态,传代至40代后仍能保持髓核细胞的生物学特性。
端粒是真核细胞染色体末端的能够抑制染色体末端融合或被降解、维持染色体稳定的特殊结构,与细胞的增殖有关。在正常情况下,细胞每分裂1次,端粒DNA会缩短50~200 bp,当端粒缩短到一定程度后即引起细胞衰老、死亡[13]。人端粒酶主要由端粒酶相关蛋白、端粒酶RNA及具有反转录酶活性的hTERT构成,其中hTERT表达水平决定了端粒酶的活性[14]。hTERT可以自身RNA为模板合成端粒DNA并加到染色体末端,弥补细胞分裂时丢失的序列。有研究表明,将hTERT基因转染到正常细胞中,可以增强端粒酶的活性,延长端粒长度,细胞可以越过危机期而发生永生化[15]。学者们已经在多种细胞中进行了验证,证实hTERT基因能够延长细胞的生命并且能维持细胞的功能[16]。KIYONO等[17]研究表明,hTERT在pRb或p16灭活的情况下能提高致人细胞永生化的效率。本实验通过慢病毒载体将hTERT基因成功导入体外培养的正常人椎间盘髓核细胞,并证实hTERT基因能在髓核细胞内正确表达,细胞外基质的表达量也相应增加,转染后传代10代的髓核细胞形态保持正常髓核细胞的特征,没有出现去分化现象,到目前为止细胞传代25代,生长状态良好。CHUNG等[18]以脂质体为载体将hTERT成功转染入牛椎间盘髓核细胞,证实hTERT基因具有延长髓核细胞寿命及增强其功能的作用,但不能持久稳定表达目的基因。而本研究以慢病毒为载体转染髓核细胞,有效地弥补了hTERT基因不能长期在髓核细胞中稳定表达的缺陷。LIANG等[19]的研究结果也显示,hTERT基因的高表达可以提高髓核细胞复制增生能力,降低髓核细胞凋亡率。
目前研究表明,不同时期的髓核细胞的蛋白聚糖及Ⅱ型胶原蛋白表达量随细胞体外传代次数的增加而明显减少,在基因分子表达水平上呈现去分化生长趋势[20]。本实验将hTERT基因成功导入第2代正常髓核细胞后,经RT-PCR证实,转染目的基因的髓核细胞的蛋白聚糖及Ⅱ型胶原表达水平较未转染目的基因的对照组显著增高,且能较长时间维持这一水平。吴剑宏等[21]研究表明,hTERT基因对正常髓核细胞基质的表达有正调控的作用,与本实验结果基本相符。本实验光镜下观察结果显示,传代10代后的细胞形态饱满、胞浆丰富,细胞呈多角形、短梭形,细胞形态与前3代的正常髓核细胞无明显差异,表明永生化髓核细胞系成功建立。
為解决移植于椎间盘的细胞来源稀少等问题,IWASHINA等[22]在体外培养的健康人髓核细胞中,利用腺病毒载体介导SV40而获得永生化人髓核细胞系,并将具有永生化能力的细胞成功移植到退变的兔椎间盘模型中,证明人髓核细胞的移植能够延缓兔椎间盘的退变,为临床生物治疗腰椎退行性变疾病提供了新思路。
综上所述,本实验在前期工作的基础上成功建立了具有永生化能力的髓核细胞系,解决了髓核细胞来源不足的问题,为后续转基因与动物实验提供了优质的种子细胞。
[参考文献]
[1] ALINI M, LI W, MARKOVIC P, et al. The potential and limitations of a cell-seeded collagen/hyaluronan scaffold to engineer an intervertebral disc-like matrix[J]. Spine, 2003,28(5):446-454.
[2] NAGY S A, JUHASZ I, KOMAROMY H, et al. A statistical model for intervertebral disc degeneration: determination of the optimal T2 cut-off values[J]. Clinical Neuroradiology, 2014,24(4):355-363.
[3] CHEUNG K M, KARPPINEN J, CHAN D, et al. Prevalence and pattern of lumbar magnetic resonance imaging changes in a population study of one thousand forty-three individuals[J]. Spine, 2009,34(9):934-940.
[4] 陈岩,胡有谷,刘勇. 椎间盘细胞培养过程中的反分化研究[J]. 中国脊柱脊髓杂志, 2000,10(3):59-60,64.
[5] 任甫,侯续伟,徐国昌,等. 端粒酶转染大鼠胰岛素分泌细胞建立的永生化细胞系[J]. 中国组织工程研究与临床康复, 2009,13(33):6500-6504.
[6] MOFFATT-JAUREGUI C E, ROBINSON B, DE MOYA A V, et al. Establishment and characterization of a telomerase immortalized human gingival epithelial cell line[J]. Journal of Periodontal Research, 2013,48(6):713-721.
[7] JEON J P, KIM J W, PARK B, et al. Identification of tumor necrosis factor signaling-related proteins during Epstein-Barr virus-induced B cell transformation[J]. Acta Virologica, 2008,52(3):151-159.
[8] LIU J P, CASSAR L, PINTO A, et al. Mechanisms of cell immortalization mediated by EB viral activation of telomerase in nasopharyngeal carcinoma[J]. Cell Research, 2006,16(10):809-817.
[9] KUDLOW B A, STANFEL M N, BURTNER C R, et al. Suppression of proliferative defects associated with processing-defective lamin A mutants by hTERT or inactivation of p53[J]. Molecular Biology of the Cell, 2008,19(12):5238-5248.
[10] DE FILIPPIS L, FERRARI D, ROTA NODARI L, et al. Immortalization of human neural stem cells with the c-myc mutant T58A[J]. PLoS One, 2008,3(10):e3310.
[11] KIRCHHOFF C, ARAKI Y, HUHTANIEMI I, et al. Immortalization by large T-antigen of the adult epididymal duct epithelium[J]. Molecular and Cellular Endocrinology, 2004,216(1/2):83-94.
[12] SAKAI D, MOCHIDA J, YAMAMOTO Y, et al. Immortalization of human nucleus pulposus cells by a recombinant SV40 adenovirus vector[J]. SPINE, 2004,29(14):1515-1523.
[13] ARTANDI S E. Telomeres, telomerase, and human disease[J]. N Engl J Med, 2006,355(12):1195-1197.
[14] ABDALLAH B M, HAEK-SORENSEN M, BUMS J S, et al. Maintenance of differentiation potential of human bone marrow mesenehymal stem cells immortalized by human telomerase reverse transcriptase gene despite [coreeted] extensive proliferation[J]. Biochemical and Biophysical Research Communications, 2005,326(3):527-538.
[15] KANG M K, PARK N H. Extension of cell life span using exogenous telomerase[J]. Methods in Molecular Biology (Clifton, N.J.), 2007,371:151-165.
[16] HARLEY C B. Telomerase therapeutics for degenerative di-seases[J]. Current Molecular Medicine, 2005,5(2):205-211.
[17] KIYONO T, FOSTER S A, KOOP J I, et al. Both Rb/p16INK4a inactivation and telomerase activity are required to immortalize human epithelial cells[J]. Nature, 1998,396(676):84-88.
[18] CHUNG S A, WEI A Q, CONNOR D E, et al. Nucleus pulposus cellular longevity by telomerase gene therapy[J]. Spine, 2007,32(11):1188-1196.
[19] LIANG Weiguo, YE Dongping, DAI Libing, et al. Overexpression of hTERT extends replicative capacity of human nucleus pulposus cells, and protects against serum starvation-induced apoptosis and cell cycle arrest[J]. Journal of Cellular Biochemistry, 2012,113(6):2112-2121.
[20] 叶冬平,梁伟国,戴丽冰,等. 人正常椎间盘髓核细胞体外不同培养代次的生物学性状分析: 适应于组织工程椎间盘种子细胞的选择[J]. 中国组织工程研究与临床康复, 2010,14(24):4376-4379.
[21] 吴剑宏,阮狄克,王德利,等. 重组腺相关病毒介导人端粒酶逆转录酶基因转染对人髓核细胞功能的影響[J]. 中国脊柱脊髓杂志, 2012,22(9):843-849.
[22] IWASHINA T, MOCHIDA J, SAKAI D, et al. Feasibility of using a human nucleus pulposus cell line as a cell source in cell transplantation therapy for intervertebral disc degeneration[J]. Spine, 2006,31(11):1177-1186.
(本文编辑 马伟平)

