三七总皂苷对过氧化氢所致内皮细胞损伤的保护作用
谢 鹏,刘金海,耿胜男,张萌萌,张会丽
(郑州工业应用技术学院 药学与化学工程学院,河南 郑州 450000)
动脉粥样硬化(AS)是一种血管内毒素堆积导致的非炎症性病变,具体病因目前仍未阐明[1-4]。研究表明,影响动脉粥样硬化的重要因素是氧化应激所产生的活性氧(ROS)[5-6]。内皮细胞数量稳定和血管功能正常的动态平衡是通过内皮细胞损伤与增殖来实现的[7-8]。因此,有效地控制内皮细胞受损、保护内皮细胞的氧化应激性对AS具有积极的作用[9-11]。PNS是从三七中提取分离得到,研究发现,其含有皂苷活性物质、微量元素、丰富的维生素等[12]。PNS能减少机体氧的消耗量,增强机体对氧的耐受力,还可以使脑血管扩张,血流量增加,具有抗血栓和抗凝血的功能,具有改善动脉粥样硬化程度等广泛的药理作用[13-17]。H2O2是一种主要的活性氧,能诱导内皮细胞的保护能力。本实验研究不同浓度的PNS对HUVECs损伤的影响。
1 材料
1.1 实验细胞
人脐静脉血管内皮细胞(中国科学院细胞库)。
1.2 实验仪器与试剂
二氧化碳培养箱(Thermos);低温离心机(Eppendorf);电子天平(Sartorius);高压蒸汽灭菌锅(施都凯仪器设备有限公司);酶标仪(美国伯腾仪器有限公司);电泳仪(上海天能有限公司);细胞粉碎机(Eppendorf);显微镜(上海测维光电技术有限公司);PCR仪(杭州郎基科学仪器有限公司);凝胶成像系统(上海天能科技有限公司)。
三羟甲基氨基甲烷、甘氨酸、十二烷基硫酸钠、丙烯酰胺(sigma试剂有限公司);吐温-20(国药集团化学试剂有限公司);BSA蛋白浓度试剂盒(碧云天生物技术公司);FDA染色剂(阿拉丁试剂有限公司);预染marker(上海雅酶生物科技有限公司);细胞裂解液(碧云天生物技术公司);氯仿、乙醇、异丙醇(成都市科龙化工试剂厂);三七总皂苷、MTT(Sigma-Aldrich);MDA、SOD、LDH、GSH、GAPDH抗体(Cell Signaling公司)。
2 方法
2.1 细胞复苏和传代
37 ℃解冻细胞,转移至离心管,加10%完全培养基,1 000 rpm离心5 min,倒掉上清液。将细胞悬液继续培养,实时更换培养液。
将原代细胞培养24 h后,观察细胞密度是否达到80%~90%,再进行传代。取出HUVECs,将2 mL无菌PBS缓冲液轻轻冲洗细胞培养瓶壁2次。适量胰酶消化,加入10%完全培养液2 mL。缓慢吹打瓶壁,使细胞完全脱离。转移至离心管中1 000 rpm离心5 min。根据细胞数量和生长状况,将细胞转移到新培养瓶中,标记好细胞传代时间和次数等信息。观察细胞密度和状态,继续培养,选择形状相对稳定的第3~5代的胞用于实验研究。对细胞进行计数。将细胞悬液以每孔1×104的密度接种至96孔板,以每孔6×104的密度接种培养皿,继续培养至完全贴壁。
2.2 分组及给药
将完全贴壁的细胞取出,并对其进行分组。空白组细胞不施加任何干预因素;过氧化氢组细胞加入过氧化氢,终浓度为500 μmol/L;PNS-H组细胞加入PNS,终浓度为60 μmol/L,30 min后再加入H2O2作用;PNS-L组细胞加入PNS,终浓度为30 μmol/L,30 min后再加入H2O2作用。继续培养24 h。
2.3 蛋白免疫印迹检测蛋白
按照实验需求对细胞进行实验处理,在收集的细胞中加入适量预冷的含有PMSF及磷酸酶抑制剂的裂解液(1 mL的裂解液加入100 μL的PMSF),4 ℃裂解30 min,12 000 r/min低温离心10 min,转移上清液。备用。
2.3.1 考马斯亮蓝法测蛋白浓度 本实验中所使用的蛋白标准品(BSA)的浓度为0.5 mg/mL,依据表1进行添加,上样,记录。加100 μL考马斯亮蓝染色液,静置观察。用酶标仪在562 nm的波长下测定。
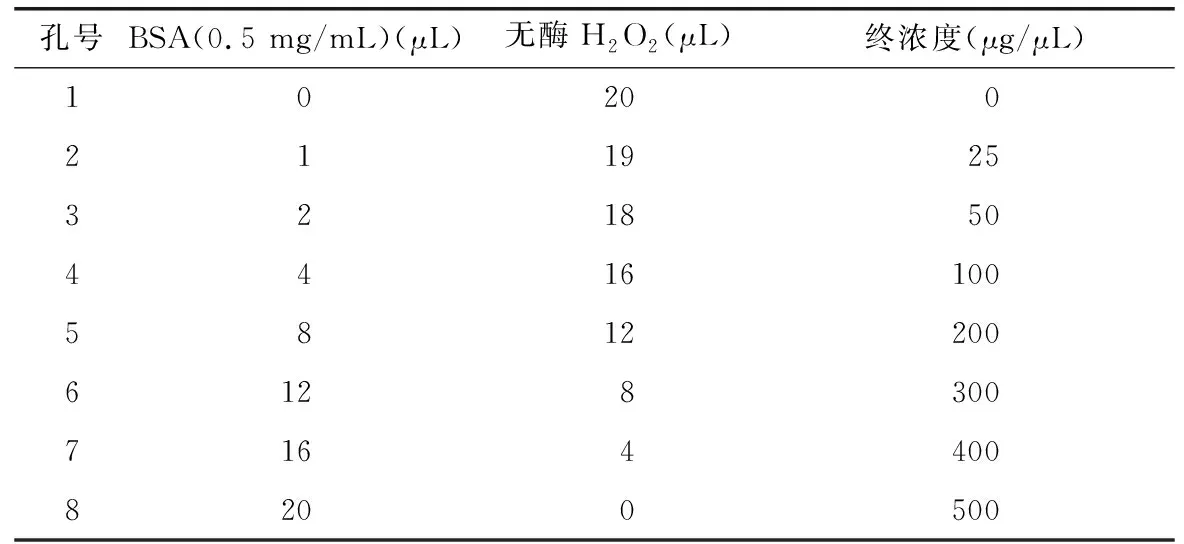
表 1 蛋白浓度梯度
2.3.2 电泳样本的制备 在制好的蛋白样品中加200 μL 5X上样缓冲液(5X倍,1∶4=缓冲液∶样本)。用沸水加热15 min使其充分变相。
2.3.3 Western blot检测蛋白的表达 本实验分离胶为12%的分离胶和5%的压缩胶配制而成。根据考马斯亮蓝法所测定的蛋白样品浓度计算所需上样量,然后加入1/4蛋白体积的5X上样缓冲液,混匀后在沸水中煮15 min,制得蛋白样品。在1.5 mm玻璃板中加入7~8 mL的分离胶,加入2~3 mL异丙醇封压,排出气泡,凝结后,弃异丙醇,加压缩胶,加梳子,制得胶。将电泳套件置于电泳槽中,加入新鲜电泳液浸泡。垂直拔下梳子,用上样针吸取所需的蛋白样品加到凝胶加样孔内,加双色预染蛋白Maker。电压设为低电压80 V,待Marker基本分离后加大电压,直至电泳结束。设定转膜电压为110 V,时间75 min。切取PVDF膜,活化,倒入转膜液,加冰转膜。将蛋白膜放在5%脱脂牛奶封闭液中,37 ℃封闭1 h。加入按照1∶25 000稀释(1X TBS-T稀释)的一抗,4 ℃孵育过夜。1X TBST漂洗 PVDF膜4~5次,每次10 min。加入按照1∶25 000稀释好的二抗,37 ℃孵育1 h。洗膜,将PVDF膜放在显影仪上,撒上发光液,运行软件,选择化学发光,设置曝光时间,进行5 s、10 s拍照。
2.4 PCR检测相关基因
2.4.1 总RNA的抽提 按照实验要求对样本进行处理,将裂解的细胞匀浆,加入0.2 mL氯仿,涡旋,室温放置15 min。对不同细胞进行编号。2~8 ℃,10 000 r离心15 min,用移液器将上层水相转移至新Ep管中,加入500 μL的异丙醇,涡旋混匀,室温放置10 min,2~8 ℃,10 000 r离心10 min,倒掉上清。加入75%的乙醇,涡旋10 s,2~8 ℃,7 500 r离心5 min,弃上清。放置在吸水纸上,进行RNA沉淀干燥处理,加入50 μL水,混匀。
2.4.2 RNA逆转录 第一链进行cDNA的合成,去基因组DNA反应,按照说明进行溶液配置,42 ℃孵育5 min,4 ℃保存。将下表液体涡旋混匀后,进行逆转录,50 ℃孵育30 min,75 ℃孵育5 min,终止反应。得到含有cDNA的混合液体,每个样本需进行4个目的基因的PCR实验,重复3次测试,把逆转录的4个含cDNA的样本均稀释3倍。然后再进行PCR实验,剩余cDNA冻存。
对人脐静脉内皮细胞SOD、CAT、MDA、LDH、GSH这5个基因的ID进行查询与设计,再进行基因序列的合成。
引物合成后离心处理,稀释,使所有引物的终浓度达到所需终浓度。PCR测试采用MonAmpTMChemoHS Qpcr Mix(None Rox)试剂,并按照该试剂说明书进行。进行30次循环,检测完毕后,导出PCR数据。

表2 引物名称及序列
2.5 MTT法检测细胞活力
量取6 mLPBS溶液,称取0.03 g的MTT粉末,溶解,混匀,0.22 μm微孔滤膜过滤,4 ℃避光保存。取出HUVECs的96孔板,每孔加入20 μL的MTT溶液,继续培养4 h,吸取孔内的上清液,加入0.2 mL的DMSO,孵育3~5 min,用酶标仪在493 nm处测定吸光度,计算HUVECs存活率。细胞活力(%)=(实验组-空白组)/(对照组-空白组)×100%。
2.6 FDA染色
取0.01 g的FDA粉末溶于1 mL的丙酮中,配成终浓度为10 mg/mL的母液,放于4 ℃冰箱,使用时按1∶1 000进行稀释,取出HUVECs的6孔板,弃去培养液,加入稀释过的FDA溶液0.1 mL,孵育20 min,弃去液体,用PBS冲洗2次,放置于488 nm的荧光显微镜下进行拍照。
3 结果
3.1 MTT检测
由表3的实验数据显示,H2O2组和各PNS组与空白组进行对比,当PNS浓度为60 μmol/L,内皮细胞活性显著增高(P<0.01),表明此浓度对细胞损伤有保护作用。当PNS为30 μmol/L,细胞活力没有明显增高,药物作用不明显,但随着剂量的增加,细胞存活率有所上升。

表3 不同浓度的PNS对H2O2损伤HUVECs活力的影响
3.2 FDA染色
由图1可以看出,与H2O2组相比,当PNS浓度在60 μmol/L时,细胞的密度最大,存活率最高。当PNS浓度为30 μmol/L时,荧光效果不太明显,细胞存活率不高,因此当PNS浓度为60 μmol/L时对细胞有很好的保护作用。
3.3 PCR检测
由表4可以得出,不同浓度的PNS都会对SOD、MDA、LDH、GSH产生影响,空白组与H2O2组进行对比,SOD、MDA的水平升高(P<0.01),LDH、GS的水平降低(P<0.01)。不同浓度的PNS组与H2O2组对比,PNS浓度在60 μmol/L时,SOD、MDA的显著上升(P<0.01),LDH、GSH下降(P<0.01)。因此PNS浓度为60 μmol/L时对HUVECs的保护作用最为明显。
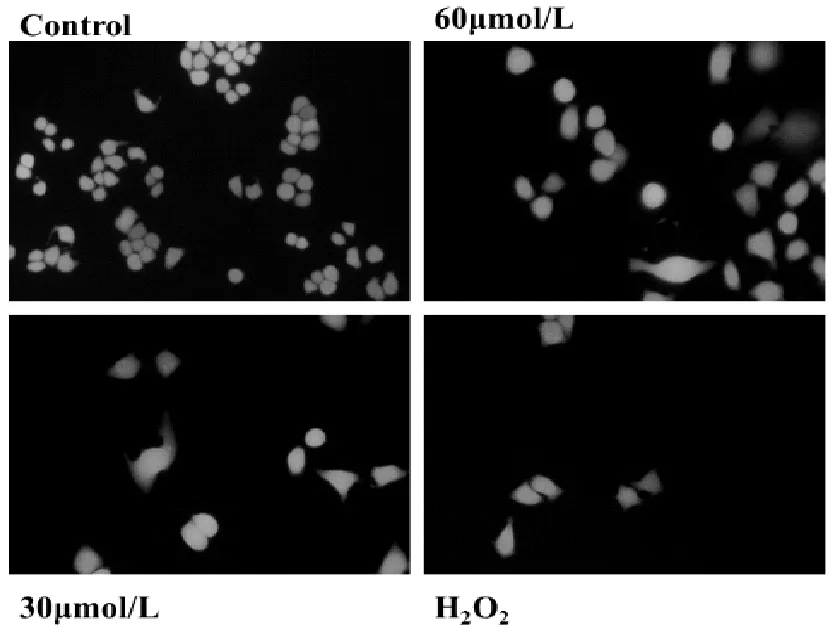
图1 FDA染色图
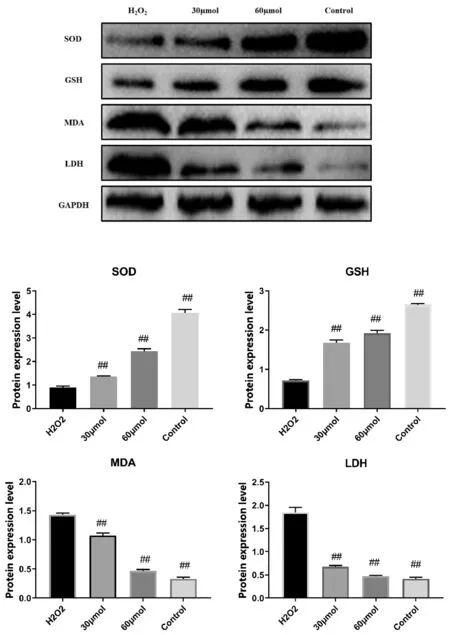
图2 不同组别SOD、GSH、MDA、LDH蛋白表达水平
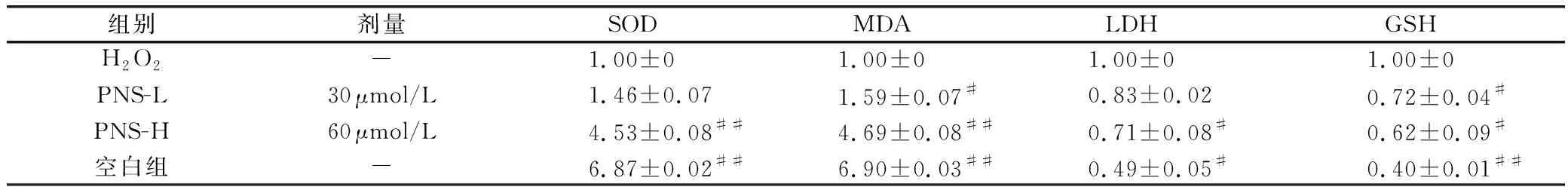
表4 不同组别SOD、GSH、MDA、LDH mRNA表达
由图2可以看出,与H2O2组相比,SOD、MDA增加(P<0.01),空白组减少(P<0.01)。与H2O2组相比,LDH、GSH在H2O2组中显著减少(P<0.01),而在空白组中表达量最多(P<0.05)。当PNS浓度为60 μmol/L时,对受损内皮细胞的修复能力最高。
4 结论
本实验利用H2O2能透过细胞膜和核膜进入细胞内引起膜脂质过氧化反应[18],导致内皮细胞严重损伤,从而引起疾病的发生,对人体造成不可预知的危害,建立细胞损伤模型。通过Western blot和PCR检测发现PNS可抑制LDH、GSH的表达,并提高SOD、MDA的含量,说明PNS对受损内皮细胞的凋亡基因表达水平起到调控作用,且PNS高剂量组效果明显,呈剂量依赖性。PNS在一定浓度可有效地保护血管内皮细胞免受H2O2的损害,对预防和治疗动脉粥样硬化有重要意义。

