紫甘蓝提取物提高人非小细胞肺癌细胞系放射敏感性的研究
曾慈梅 王 蕾 齐见旭
(中南大学湘雅医学院附属海口医院呼吸内科,海口 570208)
随着环境污染的日益严重,尤其近些年受雾霾的影响,肺癌已成为发病率(160万/年)和死亡率(140万/年)较高的常见恶性肿瘤[1]。其中非小细胞肺癌(non small cell lung cancer,NSCLC)占比高达85%,而肺腺癌又是NSCLC的主要类型之一[1]。多数腺癌起源于较小的支气管,为周围型肺癌,手术切除是早期病例的主要治疗方法,治愈率较高[2]。然而大部分肺癌患者诊断时已经处于中晚期,错过了最佳手术时机,此时多采用放化疗联合的治疗方案,并且随着放射疗法的不断进步和完善,患者的存活期得以显著延长[3]。但肺腺癌的放射敏感性较低,长时程电离辐射暴露癌细胞容易出现放疗抵抗,故研究新型放疗增敏剂以改善放疗效果是长期以来的研究重点[4]。
紫甘蓝是一种著名的十字花科蔬菜,国内外对不同种类甘蓝的研究表明,PCE含有较高的硫代葡萄糖苷(硫苷)和花青素,有较强的抗氧化作用[5,6]。一些研究表明,紫甘蓝提取物(purple cabnbage extraet,PCE)所含的硫苷是一种具有抗癌特性的成分,对乳腺癌、前列腺癌、结肠癌、胃癌、肝癌等多种癌症均具有明显的抑制作用[7,8]。然而关于PCE放射增敏的相关研究却鲜见报道,故本研究以人肺腺癌细胞A549(人非小细胞肺癌)为研究对象,系统研究了PCE对A549细胞放射敏感性的影响并初步探索了其作用机制。
1 材料与方法
1.1材料 肺腺癌细胞A549购自中科院上海生命科学研究所;新鲜无变质紫甘蓝购自生鲜超市;DMEM高糖培养基购自Gibco公司;胎牛血清购自Hyclone公司;Annexin V-FITC/PI细胞凋亡检测试剂盒购自BD公司;RT-PCR试剂盒购自Thermo公司;蛋白裂解液购自美国Kaygen公司;BCA试剂盒购自碧云天生物技术研究所;二抗购自美国CST公司;qRT-PCR实验试剂盒购自TaqMan公司;细胞培养箱购自美国Thermo公司;6 MV X线直线加速器购自德国西门子公司;流式细胞仪购自美国Beckman Coulter公司;酶标仪购自美国 Gibco公司。
1.2方法
1.2.1PCE的制备 取 500 g 紫甘蓝洗净晾干后,用榨汁机榨取汁液,2 000 r/min 离心20 min,取上清,于25℃恒温箱内静置过夜后,用滤纸及0.22 μm微孔滤膜反复过滤,所得澄清液体即为紫甘蓝原液。将其冷冻干燥24 h后得到冻干粉末,再溶解于蒸馏水中,制备成PCE。
1.2.2细胞培养 以含有10%胎牛血清的DMEM高糖培养基培养人肺腺癌A549细胞,培养条件为37℃、5% CO2、饱和湿度下常规培养,密切观察细胞生长情况,3~4 d传代一次,取生长状态良好的对数生长期细胞进行后续实验。
1.2.3CCK-8检测细胞活力 将A549细胞(4 000个/孔)接种在96孔板中,培养过夜。吸去培养基后,移液器将100 μl含有不同浓度PCE的DMEM高糖培养基(0、10、50、100、250、500 μmol/L)加入各对应组板孔中,48 h后加入10 μl CCK-8溶液,继续孵育2 h,用酶标仪测定450 nm波长处的吸光度(OD值),按照以下公式计算细胞活力,拟合曲线计算IC50值:细胞活力(%)=(A加药-A空白)/(A0加药-A空白)×100%。其中,A加药为实验孔吸光度(含有细胞、培养基、CCK-8溶液和PCE溶液的吸光度);A空白为空白孔吸光度(含有培养基和CCK-8溶液的吸光度);A0加药为对照孔吸光度(含有细胞、培养基和CCK-8溶液的孔的吸光度)。
细胞辐射毒性分析实验亦采用CCK-8实验,将对数生长期的A549细胞分为对照组(CON,A组),10 μmol/L PCE组(PCE-10 μmol/L,B组)、50 μmol/L PCE组(PCE-50 μmol/L,C组)、照射组(IR,D组)、照射加10 μmol/L PCE组(IR+PCE-10 μmol/L,E组)、照射加50 μmol/L PCE组(IR+PCE-50 μmo/L,F组)。
1.2.4细胞凋亡实验 将对数生长期的A549细胞在6孔板中(每孔1×105个/ml)接种,分组情况同1.2.3。在培养箱中培养 48 h后,以6 Gy的剂量进行照射。照射后24 h收集全部细胞于离心管内,1 000 r/min 离心5 min,PBS洗涤后离心2次。随后,在500 μl Binding Buffer中悬浮细胞,5 μl Annexin V-FITC和5 μl PI染色溶液加入混匀后在避光条件下室温反应15 min,流式细胞仪检测,分析各组细胞凋亡率。
1.2.5miRNA qRT-PCR实验 根据TaqMan miRNA ABC Purification试剂盒的说明,从不同浓度PCE培养的A549细胞中特异性提取miRNA。分光光度计检测核酸浓度,以吸光度比(A260/A280)评估RNA纯度,评估合格的RNA保存在-80℃备用。以miRNA为模板,用TaqMan MicroRNA反转录试剂盒进行RT-PCR合成cDNA。以合成的cDNA为模板,用TaqMan®MicroRNA Assays试剂盒进行qPCR定量测量各组miRNA-326的含量。以RNU-6为miRNA-326的内源对照,用Allele ID 6.0 软件设计引物如表1所示。

表1 RT-PCR引物序列
1.2.6Western blot实验 收集细胞在蛋白裂解液中裂解30 min,超声处理后4℃ 12 000 r/min离心15 min。通过BCA试剂盒定量测量蛋白浓度,使用10%十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳分离等量的蛋白质,之后在4℃下进行300 mA恒流转膜(PVDF膜)。随后将膜放入5%脱脂牛奶中室温封闭1 h,在4℃下用Bcl-2、Caspase-3、Caspase-9以及β-actin一抗孵育过夜,然后在温室下加入二抗保持1 h,最后ECL显影曝光检测。

2 结果
2.1PCE对人肺腺癌细胞A549的抑制作用 不同浓度PCE对A549细胞的抑制率见表2,结果表明人肺腺癌细胞A549生长增殖在加入PCE作用后受到抑制,并且药物的浓度越高,其增殖抑制率越高。通过曲线拟合函数计算可得其作用48 h后的IC50值为121.3 μmol/L(图1), 故本实验选择10 μmol/L和50 μmol/L作为后续放射增敏研究的药物剂量。分组照射后结果显示,PCE对A549细胞有放射增敏效果,且随药物浓度的增大,放射效果增强(P<0.05),如图2所示。

图1 细胞活力-药物浓度曲线Fig.1 Cell viability-concentration curveNote:IC50 was calculated to be 121.3 μmol/L by curve fitting the log values of cell viability and PCE concentration.

图2 照射24 h后PCE对A549的细胞抑制Fig.2 Cellular inhibition of A549 with PCE after 24 h IRNote:*.P<0.05,**.P<0.01.
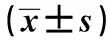
表2 不同浓度的PCE作用 48 h 对A549细胞抑制率
2.2PCE对照射后A549细胞凋亡的影响 通过Annexin-V/PI双染法结合流式细胞术检测A549细胞在经不同处理之后的凋亡水平变化。未照射组细胞凋亡水平相近,差异无统计学意义(图3A~C,P>0.05)。照射后,单纯照射组细胞凋亡率为7.63%±0.27%(图3D),加入10 μmol/L PCE照射后细胞凋亡率为9.62%±0.42%(图3E),加入50 μmol/L PCE照射后细胞凋亡率为17.50%± 0.37%(图3F)。加入PCE组照射后细胞凋亡率明显高于单纯照射组(均P<0.000 1),见图3G。
2.3PCE对照射后A549细胞miRNA326表达的影响 通过qRT-PCR实验检测在不同浓度PCE作用下照射前后miRNA326的表达。相对于A组,B组、C组可上调miRNA326的表达(P<0.01);同时D组对比A组的 mRNA326 表达明显下降(P<0.05),而E、F组对比D组miRNA326的表达均有明显上调(P<0.01)。结果表明,PCE可以上调照射后A549细胞miRNA326的表达,并且药物浓度越高,上调越明显。见图4。

图4 PCE提高了电离辐射诱导的A549的细胞凋亡Fig.4 Apoptosis was increased with PCE by IR in A549 cellsNote:Compared with Con group,*.P<0.05,**.P<0.01;compared with IR group,△.P<0.05,△△.P<0.01.
2.4PCE调节A549细胞中Bcl-2、Caspase-3及Caspase-9的表达水平 照射后给药组Bcl-2的表达下降,而Caspase-3、Caspase-9的表达明显加强,提示PCE激活了其线粒体凋亡通路,进一步说明了PCE能够增强照射后A549细胞的凋亡水平,见图5。

图5 PCE调节A549细胞中Bcl-2、Caspase-3和Caspase-9的蛋白表达Fig.5 Protein expression of Bcl-2,Caspase-3 and Caspase-9 was regulated with PCE in A549 cells
3 讨论
本研究首先通过CCK-8实验摸索了不同浓度PCE对A549细胞的作用规律,为后续研究提供了充分依据;再通过CCK-8实验研究了PCE加药对照射后细胞活力的影响,基本明确PCE对A549细胞放射敏感性良好的增敏效果;为初步探索其作用机制,本研究以流式细胞术结合Annexin V-PI双染凋亡检测技术评价PCE对A549细胞在照射后的凋亡率,发现其明显增强了A549的细胞凋亡水平,而后续Western blot实验结果显示凋亡通路蛋白分子Bcl-2、Caspase-3以及Caspase-8的表达活化,再次印证了上述结果;同时,qRT-PCR结果显示PCE显著上调了A549在照射前后miRNA-326的转录水平,提示PCE对A549细胞的放射增敏作用是通过上调肿瘤抑制因子miRNA-326进而激活凋亡通路而发挥的。
迄今为止,miRNAs对基因表达的调控已得到了广泛关注,其参与生命过程中一系列的重要进程,包括早期发育、细胞增殖、细胞凋亡、脂肪代谢和细胞分化等,同时大量研究也发现miRNAs和癌症之间有潜在的关系[9-14]。而本研究中涉及的关键分子miRNA326的下调与多种癌症的发生发展息息相关,如结直肠癌、乳腺癌、神经胶质瘤、胶质母细胞瘤等[15-18]。本研究发现照射可导致A549细胞中miRNA326的下调,而PCE可抑制该作用,通过激活线粒体凋亡途径从而抑制A549细胞的增殖并提高其凋亡率从而上调miRNA326水平,这与孙曹成等[19]的研究相一致。
凋亡是细胞照射的主要生理反应之一,多种放射增敏剂是通过提高照射后细胞凋亡水平继而达到放射增敏的功效[20]。本研究中,PCE通过提高miRNA326的水平,下调Bcl2,活化Caspase9继而激活Caspase3,从而提高了A549的放射敏感性,具有极高的药用价值。同时相关研究表明,PCE含有丰富的硫苷和花青素,有明显的抗氧化作用,对多种癌症具有预防效果,并且毒副作用低[21-25]。综上,PCE有望成为新一代高效低毒的肿瘤辐射增敏剂。
然而由于药物放射增敏作用机制十分复杂,PCE是否能通过其他分子通路起作用仍需深入研究。

