TGF-β1-Smad信号通路与胆管癌细胞发生上皮-间质转化相关性研究
赵宇青,何其勇,国麟祺
佳木斯大学附属第一医院,黑龙江 佳木斯 154002
TGF-β能调节细胞生长和分化,TGF-β超家族包括多种TGF-β同种压型,尽管结构相似,但这些配体基于其细胞、组织特异性表达,它们与抑制性分子的相互作用以及它们与之复合的受体形成独特组合而引起不同的生物反应[1]。TGF-β1可诱导上皮-间质转化已被广大学者所接受[2-3]。TGF-β1是重要的促使上皮细胞向成纤维细胞分化的因子[4],是上皮间质转化中的关键因子,同时Smad2/3信号通路是TGF-β1作用的经典通路之一。另有研究认为,胆管癌细胞发生EMT是其发生远处转移前的必经之路[5-7]。故本研究就TGF-β1-Smad信号通路与胆管癌细胞发生上皮-间质转化之间相关性做如下研究。
1 材料与方法
1.1 材料与试剂
胆管癌细胞QBC939(中国科学院上海细胞库)、TGF-β1诱 导 剂(Selleckchem)、RPMI1640(Transgenbiotech)、优质胎牛血清(HyClone),其余实验材料均来自佳木斯大学实验室。
1.2 细胞培养
在RPMI1640+10%FBS培养基中培养细胞,于37℃、5%CO2、95%空气的饱和湿度环境的培养箱中培养,细胞可贴壁生长,每天多次于倒置显微镜下观察细胞的生长情况,并适时更换培养液。
1.3 TGF-β1诱导胆管癌细胞发生EMT
将胆管癌细胞QBC939消化离心后制成细胞悬液,向6孔板中接种,加入含10%胎牛血清的RPMI-1640培养液培养。使细胞生长均匀,直至贴壁。待显微镜下观察细胞已长至6孔板底壁的80%左右,向瓶中加入约2 m l RPMI-1640培养液,饥饿细胞12 h过夜后加入TGF-β1母液。将实验组分为三组,分别设置浓度为1.0、5.0和10.0 ng/mL TGF-β1母液进行培养,对照组仅用含胎牛血清的培养基进行培养。分别于12、24和48 h后观察细胞形态变化并拍照。选取变化最明显的一组,用Western Blot法检测E-cadherin及N-cadherin表达情况。
1.4 划痕愈合实验测定迁移能力
取对数期生长细胞,经胰酶消化后用完全培养基重悬成细胞悬液,使细胞浓度为5×105个/m l,将细胞接种到6孔板,待细胞铺满板底后,用200μl枪头垂直标记线划痕,加入PBS冲洗3遍,去除划下的细胞,按对照组(只加含胎牛血清培养基)、TGF-β1(1 ng/m l组、5 ng/m l组10 ng/m l组)分为四组,分别处理后继续在培养箱中培养。Image J软件测量0 h和24 h划痕宽度的变化,用闭合率代表各组的细胞迁移能力,闭合率(%)=(0 h划痕宽度-24 h划痕宽度)/0 h划痕宽度×100%。
1.5 MTT检测增殖能力
细胞培养到细胞生长对数期时进行对比试验,取200 μl胆管癌细胞株QBC939悬浮液接种到96孔板。接种的要求:2 000个/孔、每组设5个复孔,并设调零孔,将细胞放置于TGF-β1(1、5、10 ng/m l)进行处理,12 h后,取出一块板块中的每孔加入5 mg/m l MTT 20μl,而后按照正常的细胞培养方式进行培养。培养4 h后,遗弃孔内上清液,加入150μl DMSO,振荡8 min使结晶物充分溶解。按照上述实验办法,分别做经历TGF-β1处理24 h、48 h、72 h的试验。而后用酶标仪上检测,检测办法为:630nm波长为参考值,在490 nm波长处测定吸光度A值,重复三次。增值率=[(实验组A值-调零孔A值/对照组A值-调零孔A值)-1]×100%。
1.6 Western blot检测TGF-β1-Smad信号通路下游相关蛋白表达
培养瓶中的细胞用胰酶消化,计数后按每孔0.1×106铺于12孔板,第2天细胞培养至70%~80%融合。实验设置对照组(只加含胎牛血清进行培养基),TGF-β1组加入终浓度为5 ng/m l的TGF-β1诱导48 h,待胆管癌细胞发生EMT后,各组细胞用冰预冷的RIPA细胞裂解液分别裂解,离心收集上清。调整各个提取样本的总蛋白浓度为2μg/m l,取20μl总蛋白,经12%SDS-PAGE凝胶电泳后转膜,室温封闭1 h,加入一抗4℃孵育过夜。采用辣根过氧化物酶标记的二抗室温孵育1 h,用TBST洗膜(3次),用化学发光法(ECL)显色,由凝胶成像仪摄取凝胶图像,用ImageJ软件分析。
1.7 统计学方法
计量数据以例数百分比(%)表示,两个独立样本组间均数比较用χ2检验。P<0.05表示差异有统计学意义。
2 结果
2.1 TGF-β1诱导胆管癌细胞发生EMT
分别利用不同浓度(1.0、5.0和10.0 ng/m l)TGF-β1诱导细胞,在不同时间点(12、24、48 h)利用相差光学显微镜评估TGF-β1诱导的细胞形态学变化。结果显示,QBC939细胞培养在空白对照组呈现经典的鹅卵石上皮形态和生长模式,5 ng/m l TGF-β1在24 h可以使QBC939细胞发生形态改变,48 h之后更加显著。经过10 ng/m l TGF-β1处理后,细胞形态逐渐变为长梭形,极性丧失,细胞变得离散,呈现更多的纤维母细胞形态并减少了细胞间的连接(图1)。选取TGF-β1 10ng/m l组中的胆管癌细胞进行Western blot试验,结果显示,与对照组相比,实验组中细胞黏附分子E-cadherin蛋白水平下降(P<0.05),而N-cadherin表达显著上调(P<0.05)(图2-1和图2-2),证明在此过程中TGF-β1诱导QBC939细胞发生了EMT。与对照组相比,差异具有统计学意义(P<0.05)。

图1 镜下观察各浓度TGF-β1培养胆管癌细胞各时间点细胞形态

图2-1 Western blot试验检测各组QBC939细胞E-cadherin及N-cadherin的表达情况
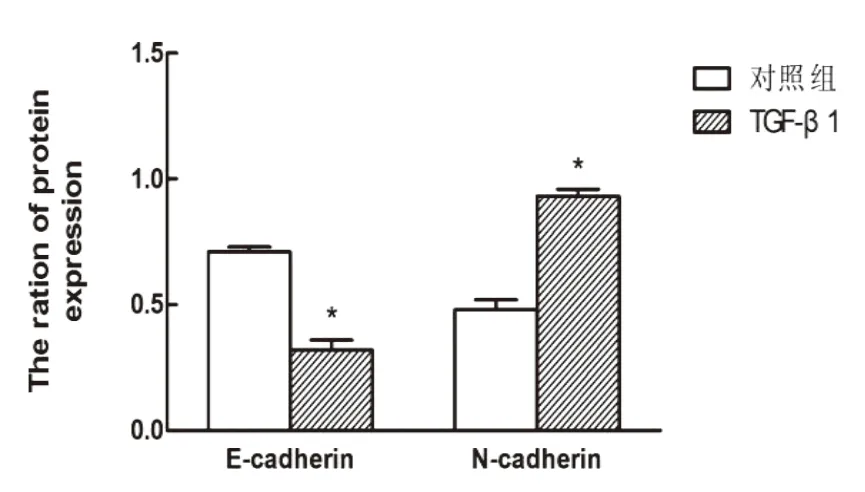
图2-2 对照组与TGF-β1组E-cadherin及N-cadherin蛋白相对表达量
2.2 TGF-β1可促进胆管癌细胞迁移
1ng/m l组胆管癌细胞闭合率为(43.37±0.14)%;5 ng/m l组胆管癌细胞闭合率为(63.26±0.37)%;10 ng/m l组胆管癌细胞闭合率为(72.94±0.56)%,均高于对照组闭合率(34.64±0.75)%(图3),差异具有统计学意义(P<0.05)。

图3 各浓度TGF-β1培养胆管癌细胞后各组胆管癌细胞迁移情况
2.3 TGF-β1可促进胆管癌细胞增殖
与对照组比较,1、5、10ng/m l组在不同时间点所测出的增值率均大于对照组(表1),差异具有统计学意义(P<0.05)。

表1 对照组与TGF-β1不同浓度组胆管癌细胞增值率 %
2.4 胆管癌细胞发生EMT后TGF-β1-Smad信号通路下游蛋白表达增加
Western blot结果显示,与对照组相比,发生上皮-间质转化的REB中,TGF-β1-Smad信号通路下游相关蛋白P21WAF、VEGF、TSP-1、uPA、smad、Bmi-1表达均较对照组增加(图4和图5),差异具有统计学意义(P<0.05)。
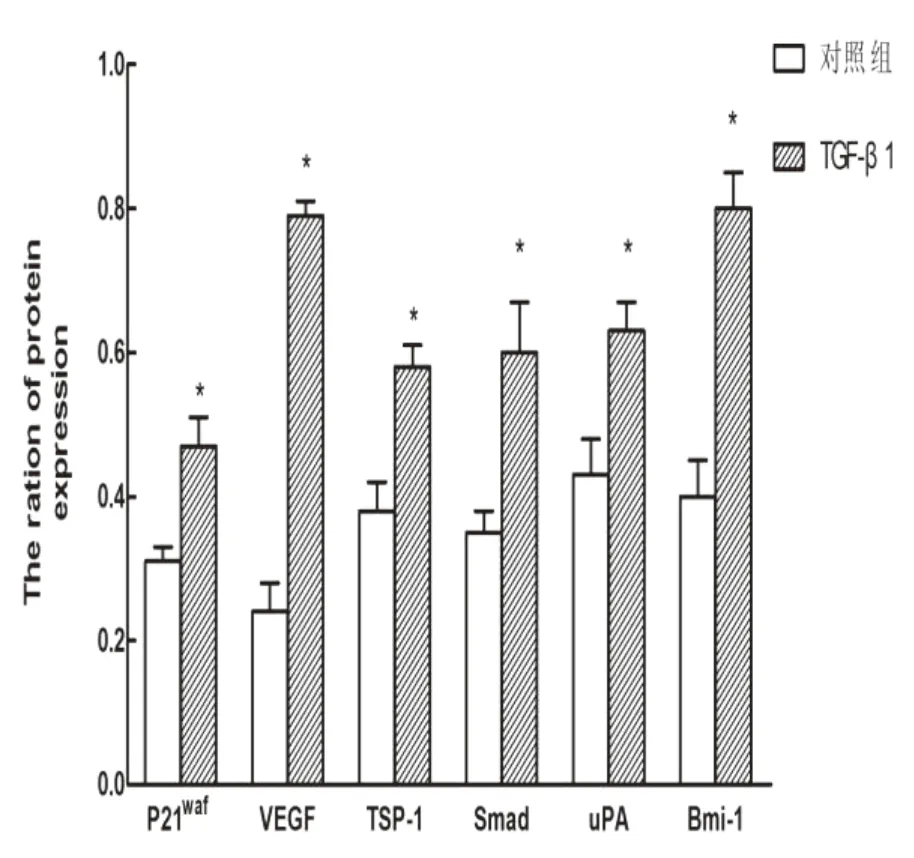
图4 胆管癌细胞发生EMT前后TGFβ1-Smad信号通路下游蛋白表达量
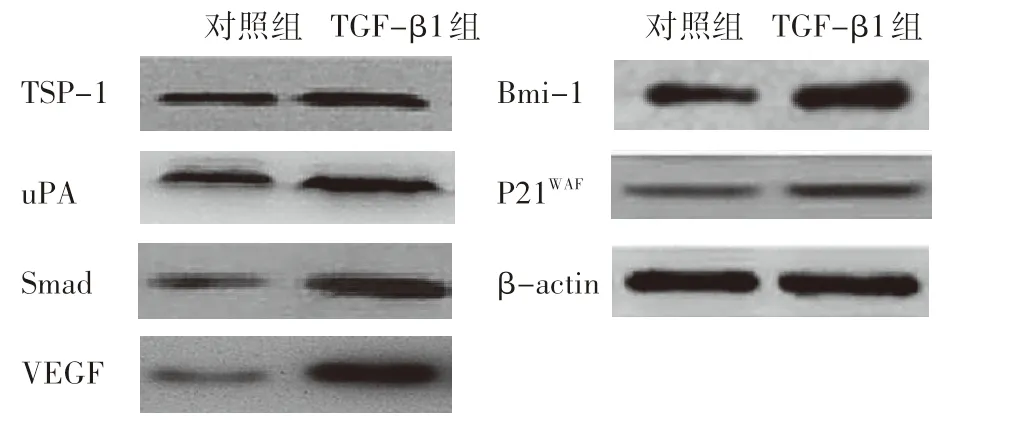
图5 Western blot试验检测胆管癌细胞发生EMT前后TGFβ 1-Smad信号通路下游蛋白表达情况
3 讨论
胆管癌是起源于胆管上皮的恶性肿瘤,在解剖学上分为肝内、肝外和肝门部胆管癌。胆管癌早期诊断较消化系统其他部位恶性肿瘤困难,且进展较其他恶性肿瘤迅速且该部位解剖关系复杂。有统计数据显示胆道系统恶性肿瘤恶性程度及其发病率与胰腺癌相仿。除外科手术治疗外,该病对化疗药物及放疗治疗均不敏感[8]。其可沿胆管上下组织间隙、淋巴管引流和周围神经鞘侵润[9]。临床上缺乏特异性的肿瘤标志物,绝大多数患者明确诊断时已失去手术根治的机会[10]。目前并无确实有效的方法对胆管癌未手术患者进行抗肿瘤治疗[11]。研究表明胆管癌细胞发生远处转移与胆管癌细胞发生EMT密切相关。EMT是指在生理及病理情况下发生细胞上皮间质转变,同时伴随细胞形态与相关基因表达的改变。在胚胎形成以及组织器官发育中起着至关重要的作用,同时也参与器官纤维化和肿瘤的形成[12]。EMT以上皮细胞极性的丧失及间质特性的获得为重要特征,同时使细胞在细胞功能及代谢等多个方面均发生改变。正常细胞间通过细胞的极性及E-cadherin的表达,形成细胞间的紧密和粘附连接,当EMT发生时,细胞极性消失并获得间质特性,便可为肿瘤细胞通过基底膜创造机会。整个上皮-间质转化过程中,上皮细胞的标志物表达下调,如E-cadherin、p-连环素(p-Catenin)、a-连环素(a-Catenin)、c-连环素(c-Catenin)等;相反,间质表型标记物表达上调,如波形蛋白、纤维连接蛋白、N-钙黏蛋白(N-cadherin)等,而N-cadherin表达上调和E-cadherin表达下调有助于肿瘤细胞脱离原发灶[13-14],进而发生远处转移。鉴于过度活化的TGF-β及其受体所介导的细胞信号通路在肝癌、胰腺癌、骨髓增生异常综合征(myelodysplastic syndromes,MDS)等恶性肿瘤及组织纤维化疾病的发生、发展中发挥关键作用。关于靶向抑制TGF-β的分子靶向治疗成为科学研究的热点所在。本研究发现,TGF-β1可以诱导胆管癌细胞发生上皮间质转化,使N-cadherin表达上调和E-cadherin表达下调,进而表现出间质特性。还可以增强胆管癌细胞的迁移及增值能力,且具有时间和浓度依赖性。这为胆管癌细胞发生远处提供了有利条件。而相对于一般胆管癌细胞而言,发生了EMT的胆管癌细胞中TGF-β1-Smad信号通路下游蛋白表达也相应增加,说明胆管癌细胞发生EMT的过程与该信号通路的异常激活密切相关。
综上所述,TGF-β1在胆管癌细胞发生EMT的过程中起到至关重要的作用,同时TGF-β1-Smad信号通路与胆管癌细胞发生上皮-间质转化之间具有相关性。抑制TGF-β1可能为研究胆管癌发生发展提供新的、潜在的依据。

