子宫内膜浆液性癌通过免疫组化和原位杂交检测HER2/neu蛋白过表达与基因扩增的对照及可行性研究*
张建筑,袁士成,彭晓峰,赵文丽,易智君,刘镜文,杨 红,秦文华,侯卫华
1.惠州市第一人民医院病理科,广东 惠州 516000;2.惠州市中心人民医院病理科,广东 惠州 516000;3.惠州市第一妇幼保健院病理科,广东 惠州 516000;4.平煤神马医疗集团总医院病理科,河南 平顶山 467000;5.解放军第989医院病理科,河南 平顶山 467000
子宫内膜癌是女性生殖系统中较常见的肿瘤,ESC约占所有子宫内膜癌的8.7%~10.2%。ESC恶性程度高,对常规化疗药物易出现耐药,治疗效果差,复发率高。约50%病例确诊时已伴有子宫外病变,此部分病例中,约30%~50%未发现明确的子宫肌层浸润[1]。在精准医疗时代,为降低ESC患者的复发及死亡率,有必要对可能存在的靶向治疗的靶点HER2/neu进行研究。在乳腺癌和胃癌中,人表皮生长因子受体2(HER2/Neu,C-ERBB2)HER2蛋白过表达和(或)扩增病例,其评价标准和应用靶向药物曲妥珠单抗治疗的规范化流程和治疗效果已得到确认[2-4]。针对HER2表达的异质性研究,反映这些肿瘤的独特的生物特征和预测对HER2靶向治疗的临床效果[5-8]也取得了一些成果。虽然HER2/neu的子宫内膜癌的研究已经近20年,但并没有形成完整的评价标准和指南,以致在子宫内膜癌中抗HER2药物的应用没有准确的HER2/neu扩增状态的依据,研究得到的结果受到质疑[9-16]。如有研究HER2过表达或HER2扩增均与无进展生存期或总生存期无关[17];还有部分研究提示,曲妥珠单抗作为单一药物并未显示出对具有HER2过表达或HER2扩增的子宫内膜癌的活性。在所有此类研究中,HER2过表达和(或)基因扩增的病例所占各自研究病例的14%~80%,从这些结论中可以肯定的推断,至少有部分研究在对HER2过表达和(或)基因扩增的评价标准和解读是存在错误的[9-15]。所以,对HER2/neu基因状态的准确评估非常重要,将严格筛选的HER2/neu蛋白过表达和/或基因扩增病例入组抗HER2药物治疗,所得到的疗效结果才是准确可靠的[18]。近年来,有研究显示,二代抗HER2/neu药物如达可替尼、阿法替尼等对化疗耐药的HER2/neu基因扩增的ESC显著有效[19-20];络氨酸酶抑制剂与抗HER2药物的联合应用以及卡铂-紫杉醇联合曲妥珠单抗在治疗ESC的研究也取得了很大的进展[21-24]。因此,有必要对新型抗HER2/neu药物在对化疗耐药的HER2/neu基因扩增ESC患者中临床应用进行研究。基于以上情况,我们采用ASCO/CAP2013版乳腺癌HER2检测指南评分标准,对ESC病例HER2过表达和(或)基因扩增情况进行了研究。
1 资料与方法
1.1 一般资料
选取2010年1月—2018年5月间71例惠州市第一人民医院及四家友好医院(惠州市中心人民医院、惠州市妇幼保健院、平煤神马医疗集团总医院、解放军第989医院)初发ESC手术切除标本蜡块,所有患者术前均未做放、化疗,病人年龄50~82岁。免疫组化:一抗为上海基因公司兔抗人HER2,SP3单克隆抗体;其它所需配套试剂来自Leica(德国)公司;全自动免疫组化仪为Leica BOND-Ⅲ,来自Leica(德国)公司。FISH检测所用HER2-DNA探针试剂盒为Histra HER2 FISH Kit试剂盒,购自日本常光公司。免疫组化及FISH操作步骤均严格参照仪器使用流程和试剂使用说明。
1.2 方法
(1)所选用标本蜡块均为严格按照FISH及IHC固定要求(离体时间小于30 min,充分剖开,组织体积10倍左右4%中性甲醛固定6-48 h)。(2)常规石蜡切片,HE染色、IHC切片厚度均为4μm。(3)IHC染色采用乳腺癌评分HER2(3+)和HER2(0)做为阳性、阴性对照,染色评价后,按照ASCO/CAP 2013版乳腺癌HER2检测指南评分标准对结果进行判读,按评分分为4组(3+组、2+组、1+组、0组),选取每个蜡块IHC表达最强部分直径0.4 cm组织,组内优先原则,每4块组织同乳腺癌阳性、阴性(FISH实验证实)对照制作一个组织芯片,组内不足4块则由其他组补入,最终制作组织芯片18个,供FISH实验使用。(4)组织芯片FISH切片厚度为4μm。
1.3 结果判定
参照ASCO/CAP2013版乳腺癌HER2检测指南[25]的判定标准:(1)免疫组化化学。HER2蛋白表达阳性HER2(3+):≥10%肿瘤细胞呈现强而完整的膜阳性;HER2蛋白表达不确定HER2(2+):≤10%肿瘤细胞出现强而完整的膜阳性和/或>10%细胞出现不完整的弱至中等强度的细胞膜染色;HER2蛋白表达阴性HER2(1+)、HER2(0):>10%的浸润性癌细胞呈现不完整的、微弱的细胞膜染色判度为HER2(1+);肿瘤完全阴性或≤10%细胞出现不完整、微弱的细胞膜染色判读为HER2(0)。【注:在本次研究中,将IHC中强的U型着色(基底膜和侧膜着色)判定等同于完整的膜阳性;将染色强度(5个级别:无信号、微弱表达、弱表达、中等轻度表达、强表达)差异至少占肿瘤5%的比例定义为免疫组化染色异质性】。(2)FISH HER2/neu基因扩增:HER2/CEP17≥2.0和/或HER2拷贝数/细胞数≥6,若HER2/neu信号连成簇,则不用计算比值,直接判定为HER2/neu基因扩增;HER2/neu基因未扩增:HER2/CEP17<2.0且HER2拷贝数/细胞数<4;HER2/neu基因扩增不确定:HER2/CEP17<2.0且6>HER拷贝数/细胞数≥4。FISH/HER2蛋白符合率:HER2/neu扩增数+HER2/neu基因未扩增数/HER2(3+)+HER2(1+)+HER2(0);HER2/neu基因扩增率:HER2/neu基因扩增数/病例总数。(注:本次HER2/neu的免疫组化结果和FISH结果均由两名有资质医师单独阅片,最后两人得出的结果进行参照、对比,不一致病例进行讨论、重新评估,最终得出结果)。
1.4 统计学方法
数据采用SPSS 22.0软件进行统计分析,计数资料以例数和百分比(%)表示,组间比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 HER2IHC评分分布及HER2/neu FISH结果的对照
所有71例病例均进行免疫组化HER2蛋白和FISH基因扩增检测。根据ASCO/CAP 2013版乳腺癌HER2检测指南进行评分,其中HER2(3+)18例;HER2(2+)17例;HER2(1+)26例;HER2(0)10例;其中有24例病例出现IHC表达的异质性。应用FISH实验检测:HER2(3+)病例中有16例HER2/neu基因扩增, 1例未扩增,1例HER2/neu基因扩增不确定;HER2(2+)病例中,4例HER2/neu基因扩增,11例HER2/neu基因未扩增,2例HER2/neu基因扩增不确定;HER2(1+)病例中,1例HER2/neu基因扩增,25例HER2/neu基因未扩增;HER2(0)病例中,HER2/neu基因扩增病例数为0。除去HER2(2+)不确定病例,FISH/HER2免疫组化符合率为94.4%(51/54),HER2基因扩增率为29.5%(21/71),见表1,图1。通过FISH检测我们还发现,有45.1%(32/71)的病例显示17号染色体多体(HER2/CEP17>2.5)。
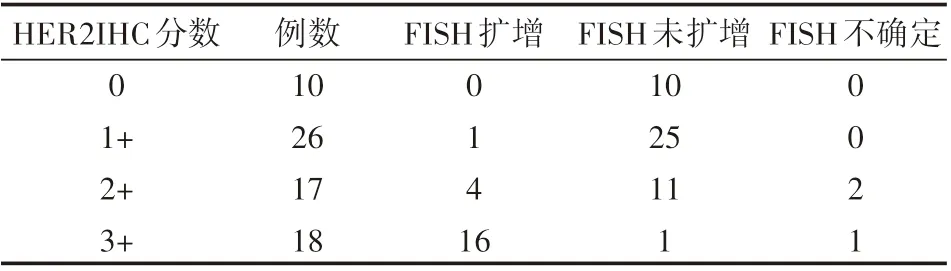
表1 HER2IHC评分分布及HER2/neu FISH结果的对照 例
2.2 HER2IHC异质性与基因扩增对照
在IHC评分中,有24例病例出现了ICH表达的异质性,其中有11例(52.4%,11/21)HER2/neu基因扩增病,HER2/neu未扩增及不确定病例中IHC表达异质性所占比例为(26%,13/50),二者间比较,差异无统计学意义(P=0.065),见表2,图1。

表2 HER2IHC异质性与基因扩增对照 例(%)

图1 子宫内膜浆液性癌的HER2免疫组化表达和HER2/neu基因扩增
3 讨论
本次研究得出了三个结论:(1)ESC中应用ASCO/CAP 2013版乳腺癌HER2检测指南进行判读,FISH基因扩增检测和IHC免疫组化过表达情况有高度的一致性94.4%(51/54);(2)在ESC中,有29.5%的病例出现HER2/neu基因扩增;(3)在ESC中,HER2蛋白的IHC表达存在较高的异质性33.8%(24/71)。
正确评估靶向药物靶点的状态对入组靶向药物治疗起决定性作用。乳腺癌和胃癌的HER2检测指南已经完备并随着研究进展不断更新,ASCO/CAP在2018年对乳腺癌HER2检测指南进行了更新[26],根据该标准的更新,中国乳腺癌专家组制定了《乳腺癌HER2检测指南(2019版)》[27]。目前国内外尚无针对ESC的HER2检测指南及抗HER2靶向药物的应用规范。浆液性子宫内膜癌是子宫内膜癌最具生物学攻击性的变体,具有较高的复发率和对常规化疗的相对耐药性,这对肿瘤科医生提出了重大的治疗挑战[28-30]。在以往子宫内膜浆液性癌HER2研究中,缺乏规范的HER2检测标准来显示HER2/neu的基因状态,导致研究中HER2过表达率在14%~80%[8-12,31-36],这种不规范性主要体现在,部分研究没有将Ⅰ型、Ⅱ型子宫内膜样癌分开研究,甚至有人将恶性苗勒氏混合瘤也纳入研究组中[8-16]。虽然部分研究是依照ASCO/CAP 2013乳腺癌HER2检测指南或FDA(食品药品管理局)标准对IHC结果进行判读,但有的将HER2蛋白评分(2+)和(3+)的病例完全纳入HER2/neu基因扩增病例,对HER2状态的评估的不规范,导致最后应用抗HER2靶向药物的疗效产生不同的结果。近年来一些研究显示,应用新型抗HER2/neu基因的靶向药物或联合应用络氨酸激酶抑制剂等其它药物,会使HER2/neu基因扩增的ESC病人受益[21-24]。
本研究是基于ASCO/CAP 2013乳腺癌HER2检测指南对ESC的HER2/nue的IHC蛋白表达和FISH基因扩增进行的,研究显示,ASCO/CAP 2013乳腺癌HER2检测指南应用于评价ESC的HER2/neu基因扩增情况时,除去IHC判读HER2(2+)病例,IHC和FISH符合率为94.4%(51/54),有较高的符合率,说明ASCO/CAP 2013乳腺癌HER2检测指南在检测ESC的HER2/neu基因状态是适用的。
HER2/neu的IHC表达和基因扩增特征在不同组织来源和组织学类型会有差异。在乳腺癌中,同一肿瘤中HER2/neu的IHC表达和(或)基因扩增的一致性比较高,出现表达和(或)扩增的异质性比较少见[37-38];但是在胃癌中,许多病例HER2/neu的IHC表达和(或)基因扩增状态在同一肿瘤内的不同区域会显示出明显的异质性[39]。针对IHC蛋白表达的异质性,在胃癌的活检标本中对于HER2/nue表达评价有专门的指导意见,在活检标本中,只要存在成簇的至少5个肿瘤细胞出现强的细胞膜着色,即可判定为HER2(3+)[8]。在我们的研究中,ESC的HER2/nue蛋白表达与胃癌相似,较多病例表现出了明显的异质性,仅在HER2/neu基因扩增的病例中,就有52.4%(11/21)。我们得到的数据,可以对子宫内膜诊刮标本中HER2/neu的HER2/neu的免疫组化表达评价提供类似胃癌的建议。由于ESC中的IHC蛋白表达存在比例较高的异质性,所以我们建议:对于ESC的HER2/neu的蛋白过表达和(或)基因扩增状态的评估应采取大切片或多切片。
在胃癌病例中,会出现HER2/neu蛋白IHC表达只在基底膜和侧膜着色,而顶膜不着色,出现“U”形染色。在子宫内膜浆液性癌中,也出现类似胃癌中的“U”形染色模式,尤其是在分化较好的、具有明确的腺管样结构的肿瘤或肿瘤区域。我们的研究发现,根据ASCO/CAP 2013乳腺癌HER2检测指南,把“U”型染色等同于完整膜染色,HER2(3+)的病例经FISH检测HER/neu均扩增。证明根据“U”形染色阳性强度和比例来对HER2/neu的IHC进行评分是可行的。
综上所述,在ESC中,评价HER2/neu的IHC过表达和/或基因扩增情况,应用ASCO/CAP 2013乳腺癌HER2检测指南进行判读,IHC和FISH结果取得了较高的一致性,说明ASCO/CAP 2013乳腺癌HER2检测指南是可以应用于ESC的HER2/neu的过表达和(或)基因扩增评估的;HER2/neu蛋白的IHC表达,存在在同一ESC肿瘤中较大比例的异质性,因此建议肿瘤应大切片、多取材;“U”型染色在ESC中,在ASCO/CAP 2013乳腺癌HER2检测指南评价标准下,可等同完整的膜染色。随着对HER2/neu的研究,针对HER2/neu基因扩增的ESC病例的治疗管理模式需要转变[40]。本次研究仅进行了HER2/neu免疫组化染色和FISH结果的对比及ASCO/CAP 2013乳腺癌HER2检测指南在ESC中使用的可行性的研究,HER2/neu蛋白过表达和(或)基因扩增病例应用抗HER2药物后治疗效果的评价还有待于进一步研究。

