早期应用连续性血液滤过与血液灌流治疗脓毒症的临床分析
林晓君,徐维彪,陈东升
1.广州中医药大学金沙洲医院,广州 510000;2.佛山市南方医科大学南海医院,广东 佛山 528000
脓毒症是指因感染引起的宿主反应失调导致的危及生命的器官功能障碍。机体发生感染,持续较长时间导致器官功能失调,SOFA评分较基线上升≥2分,可初步判定为脓毒症[1]。疾病发生后需及时治疗,否则会引起休克、器官功能障碍等反应,威胁患者生命[2]。据统计,在全球
范围内每年至少有600万脓毒症患者死亡,存活患者均存在不同程度的认知功能障碍,可见脓毒症对人类健康危害极大[3]。在临床治疗中,主要以清除血液中炎性因子为主方向,旨在降低机体感染,避免全身感染发生,进而降低病死率。持续性血液滤过(CVVH)是目前临床上治疗脓毒症的常用方法,在清除机体中炎性介质有良好效果,但经大量临床实践证明,CVVH治疗具有延迟性,治疗期间不能很好的维持器官正常运转[4-5]。鉴于此本研究在上述治疗基础上提出血液灌流(HP)疗法,既能保证治疗的即时性,又能提升治疗效果。本次以130例脓毒症患者为对象分组研究,报告如下。
1 资料与方法
1.1 临床资料
收治脓毒症患者,选取130例分组研究,按照治疗方法不同分组,对照组、观察组各65例,患者选取时间:2017年12月—2019年11月。观察组年龄最大79岁,最小20岁,平均年龄(62.37±4.15)岁,男性、女性各35例、30例,患者体质量51~83 kg,平均体质量(62.10±4.25)kg,肺部、胆道及胰腺炎各21例、25例、19例;对照组年龄最大78岁,最小21岁,平均年龄(3.15±5.20)岁,男性、女性各33例、32例,患者体质量52~85 kg,平均体质量(60.42±5.12)kg,肺部、胆道及胰腺炎各19例、24例、22例;患者临床资料无缺失,性别、体质量等资料均有均衡性(P>0.05),可对比。
纳入标准:患者及家属均知悉本次研究,签署知情同意书;经诊断,所有患者均确诊为脓毒症[6];首次住ICU。
排除标准:拒绝参与研究者;合并活动性出血者;合并恶性肿瘤、免疫缺陷者;精神状态失常无法配合治疗者。
1.2 方法
两组均进行常规治疗,包括抗感染、液体复苏、纠正酸碱平衡及营养支持等疗法。
对照组在此基础上进行CVVH治疗:本次采用德国费森尤斯公司生产的multifiltrate急性透析和体外血液治疗机进行治疗。配置置换液(成都青山利康药业有限公司;国药准字H20080452),进行前置换、后置换输入,前后置换比为2∶1。严格控制血流量,本次设置血流速度为180~200 m l/min,将超滤比率持续维持72 h,比率为25%。滤器选用费森尤斯医药用品(上海)有限公司生产的空心纤维血液透析滤过器AV600S,间隔12 h即更换1次。
观察组在上述基础上加用HP治疗:选用珠海健帆生物科技股份有限公司生产的一次性使用血液灌流器HA330-II,调节灌流器参数至静脉—静脉血液滤过模式。在CVVH治疗前开始,控制灌流器速度在150~200 m l/min,单次持续血液灌流时间不低于2 h,每日进行1次血液灌流,灌流完成后取下灌流器,回血后接着进行CVVH治疗,持续治疗10 h,并对患者进行抗凝治疗,普通肝素钠抗凝,维持APTT(活化部分凝血酶时间)为50~70 s。
1.3 观察指标
(1)危重症疾病系统(APACHEⅡ)评分[7]:评估患者疾病严重程度,总分30分,分值越高说明疾病越严重;在治疗前、治疗后分别取患者静脉血,患者保持空腹状态,取血5 m l。离心处理后取血清,在自动生化分析仪下对患者肌酐、尿素氮水平进行测定。统计治疗前后患者肌酐、尿素氮水平变化,水平下降表示治疗有效果。
(2)统计治疗前后患者炎性因子水平变化:检测患者血清中炎性介质含量,免疫比浊法检测,记录C反应蛋白(CRP)水平;降钙素原(PCT),用化学发光法测定;肿瘤坏死因子-α(TNF-α),白细胞介素-6(IL-6),用放射免疫法检测。水平下降表示治疗有效果[8]。
(3)监测患者治疗即刻、治疗6 h、24 h、结束时刻的平均动脉压(MAP)、心排血指数(CI),上升说明治疗有效果。
(4)统计两组发生发热、心动过速、呼吸急促、外周血白细胞增加、感染例数,计算总发生率。
(5)评估患者临床疗效,判定标准:显效:患者感染、呼吸急促等炎性反应基本消失,患者血流动力学水平良好;有效:气促、感染等炎性反应部分消失,血流水平趋于正常,偶发不良反应;无效:与治疗前相比患者症状无缓解,甚至有加重趋势。
1.4 统计学方法
数据采用SPSS 21.0软件进行统计分析,计量资料以均数±标准差(±s)表示,组间比较采用t检验;计数资料以例数和百分比(%)表示,组间比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 治疗前后患者肾功能指标、APACHEⅡ评分比较
治疗前后两组APACHEⅡ评分差异明显,治疗后两组评分均下降,相比之下观察组评分更低(P<0.05);与治疗前相比,两组肌酐、尿素氮水平均下降(P<0.05),治疗后两组水平相比观察组更低(P<0.05),见表1。
表1 治疗前后患者肾功能指标、APACHEⅡ评分比较(±s)
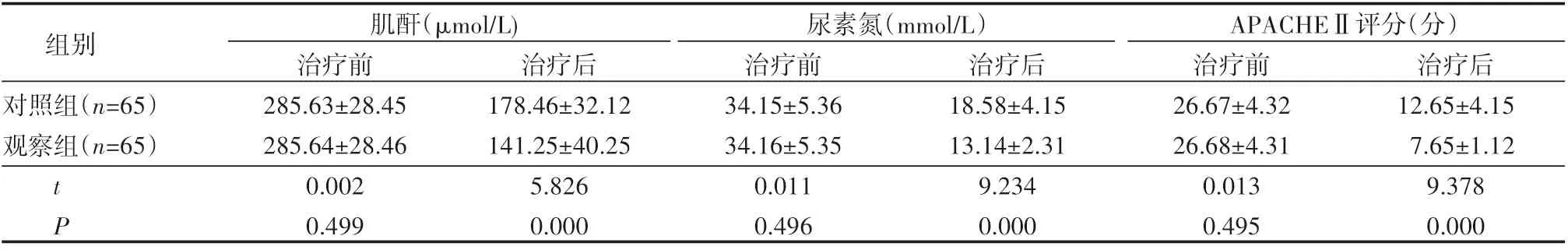
表1 治疗前后患者肾功能指标、APACHEⅡ评分比较(±s)
组别对照组(n=65)观察组(n=65)肌酐(μmol/L) 尿素氮(mmol/L) APACHEⅡ评分(分)tP治疗前285.63±28.45 285.64±28.46 0.002 0.499治疗后178.46±32.12 141.25±40.25 5.826 0.000治疗前34.15±5.36 34.16±5.35 0.011 0.496治疗后18.58±4.15 13.14±2.31 9.234 0.000治疗前26.67±4.32 26.68±4.31 0.013 0.495治疗后12.65±4.15 7.65±1.12 9.378 0.000
2.2 治疗前后患者炎性因子水平比较
治疗前两组CRP、PCT、TNF-α、IL-6水平差异不大(P>0.05),治疗后炎性因子水平均下降(P<0.05),相比之下观察组炎性因子水平更低,组间有明显差异(P<0.05),见表2。
表2 治疗前后患者炎性因子水平比较(±s)
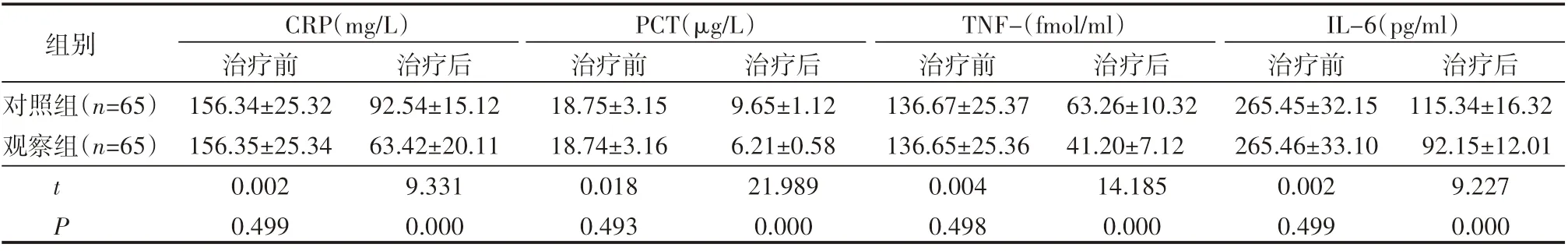
表2 治疗前后患者炎性因子水平比较(±s)
组别对照组(n=65)观察组(n=65)CRP(mg/L) PCT(μg/L) IL-6(pg/m l)TNF-(fmol/m l)tP治疗前156.34±25.32 156.35±25.34 0.002 0.499治疗后92.54±15.12 63.42±20.11 9.331 0.000治疗前18.75±3.15 18.74±3.16 0.018 0.493治疗后9.65±1.12 6.21±0.58 21.989 0.000治疗前136.67±25.37 136.65±25.36 0.004 0.498治疗后63.26±10.32 41.20±7.12 14.185 0.000治疗前265.45±32.15 265.46±33.10 0.002 0.499治疗后115.34±16.32 92.15±12.01 9.227 0.000
2.3 患者血流动力学水平比较
MAP、CI治疗即刻相比水平差异不大(P>0.05),在治疗6 h、24 h与结束时刻,观察组MAP、CI水平均高于对照组,差异明显(P<0.05),见表3。
表3 患者血流动力学水平比较(±s)
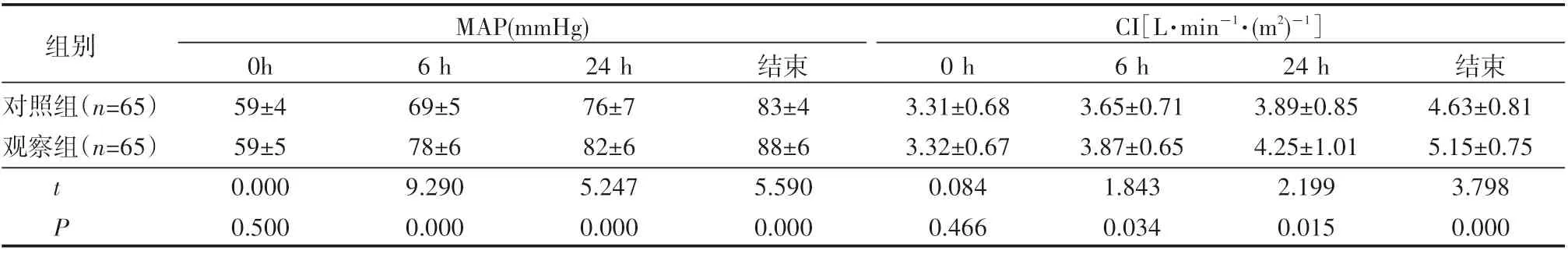
表3 患者血流动力学水平比较(±s)
组别对照组(n=65)观察组(n=65)MAP(mmHg) CI[L·min-1·(m2)-1]tP 0h 59±4 59±5 0.000 0.500 6 h 69±5 78±6 9.290 0.000 24 h 76±7 82±6 5.247 0.000结束83±4 88±6 5.590 0.000 0 h 3.31±0.68 3.32±0.67 0.084 0.466 6 h 3.65±0.71 3.87±0.65 1.843 0.034 24 h 3.89±0.85 4.25±1.01 2.199 0.015结束4.63±0.81 5.15±0.75 3.798 0.000
2.4 患者并发症发生情况比较
观察组并发症发生率为10.77%,对照组为20.00%,组间差异不明显(P>0.05),但观察组并发症发生率较低,见表4。
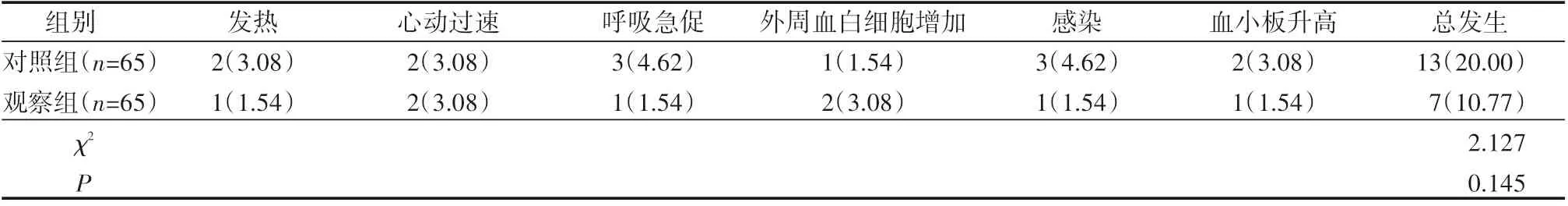
表4 患者并发症发生情况比较 例(%)
2.5 患者治疗有效率比较
观察组、对照组治疗总有效率分别为95.38%、80.00%,差异明显(P<0.05),见表5。
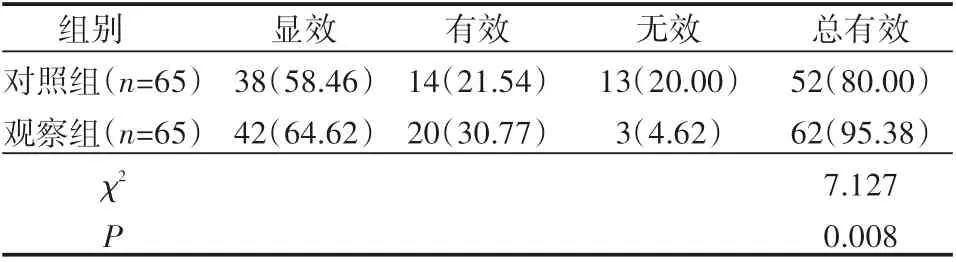
表5 患者治疗有效率比较 例(%)
3 讨论
脓毒症属于感染类疾病,在感染、创伤较重患者中具有较高发生率,疾病发生后会引起全身炎性反应。导致脓毒症的诱因众多,常见因素为真菌、细菌等感染[9]。在外部感染因子诱导下,TNF-α被单核巨噬细胞、中性粒细胞大量释放出来,白细胞介素1、2、6等水平均显著提升,导致体液内出现高水平炎性介质。病原体入侵后靶器官受损,随着炎性介质的增多,靶器官进一步受损。随着体液循环炎性介质进入到其它器官组织中,对远隔部位造成损伤,进而为加巨噬细胞、中性粒细胞的活化及聚集提供良好环境,导致花生四烯酸、蛋白酶等生成量增加,损伤内皮细胞,使其发生功能障碍。炎性因子会增加血管通透性,微循环正常状态被打破,发生体液渗出、血流分布异常等反应,持续作用下器官发生再灌注损伤,并大量生成热休克蛋白,导致机体休克风险增加[10]。凝血系统受炎性因子影响被激活,血浆蛋白C功能减弱,无法抑制炎性因子的大量繁殖,血管收缩功能障碍,导致其持续性扩张,血液循环障碍,机体器官受损,不及时治疗会导致器官衰竭。
发热、精神状态改变等是脓毒症发生的常见症状,早期症状不明显,易导致误诊、漏诊情况发生。随病情发展,患者发生轻微的器官功能障碍,伴随少尿、乳酸酸中毒等症状,少数患者出现组织灌注不足。脓毒症休克患者以持续性低血压为典型症状,患者四肢湿冷,体液治疗后无好转。临床上治疗脓毒症的方法较多,本研究重点探讨CVVH、HP联合治疗效果。
CVVH、HP联合在脓毒症治疗中的优势体现在:
(1)能快速改善患者肾功能,让患者脱离急危重症风险。肌酐、尿素氮超过正常范围,会对机体正常微循环产生影响,导致患者排尿异常。及时使用血液滤过联合血液灌流治疗方法,能快速降低血液中尿素氮及肌酐水平,使患者机体恢复正常状态。本研究显示,经联合治疗,观察组肌酐、尿素氮及APACHEⅡ评分均显著低于对照组,可见联合治疗效果明显。
(2)炎性介质清除率较高:通过对流、吸附等对体液中炎性物质进行清除[11]。对流是在跨膜压作用下,借助半透膜,将液体从压力较高一侧移动到压力较低一侧,在对流过程中体液中溶质也透过半透膜,从而完成炎性因子滤除动作。吸附指的是溶质大量吸附在滤器膜表面或活性炭上,随体液循环逐渐排出体外。上述操作都是CVVH的典型步骤,对流能全面清除大小分子毒素,能保证较高清除率,不会对肾脏造成过大影响,及时补充血容量,将内环境维持在稳定状态。但CVVH也存在一定局限性,对流、吸附后难免有少数炎性因子仍滞留在血液中。因此提出联合HP治疗,直接进行血液灌流,在灌流器中准备大量吸附剂并将血液灌流进去,一次性清除有害物质,提升炎性因子 清 除 率[12]。结 果 显 示,观 察 组CRP、PCT、TNF-α、IL-6水平在治疗后显著低于对照组。
(3)改善患者血流动力学水平:CVVH、HP联合使用比单一血液滤过疗法效果更为理想,能快速清除血液中的心肌抑制因子,刺激血管活动,进而对患者血液动力学水平进行改善。有研究者在报道中指出,心排血量指数、平均动脉压在联合治疗下能加快速提升到正常水平,并以置换液剂量为变量,结果显示单纯CVVH治疗的置换液使用量远多于联合治疗,可见联合治疗能有效减少血管收缩药物的使用。患者平均动脉压、射血分数等指标稳定后,患者肺部毛细血管通透性被改变,有效减少血管外肺水,提升患者肺功能[13]。上述部分结论与本研究不谋而合,经治疗观察组平均动脉压、心排血量指数均显著提升,且高于对照组。
(4)改善预后:CVVH、HP联合优势互补,与血液滤过不同的是,血液灌流是将血液引流到滤过器中直接对炎性因子进行吸附,弥补CVVH持续性滤过炎性因子不彻底的缺陷,有效提升炎性因子吸附清除率。本次使用的灌流器型号为HA330-II一次性灌流器,避免治疗中发生其它细菌感染[14]。使用AV600S型吸附器,功力强劲能保证吸附效果,但注意及时补充吸附器中的吸附介质,避免长时间治疗导致炎性因子清除率下降。经联合治疗,观察组治疗总有效率明显高于对照组,可见联合疗效显著。
(5)降低并发症发生率。炎性介质在体液中大量存在,网络复杂,需大面积进行治疗。持续性血液滤过治疗能确保治疗时间充足,持续性清除炎性因子,同时纠正酸碱失衡、乳酸中毒等反应。加之每隔12h进行血液灌流,集中清除CVVH治疗中的残留炎性因子,两者互补发挥“拦河网”作用,将机体炎性因子控制在较低水平,进而降低患者发生感染、发热等风险[15]。观察组发热、心动过速、呼吸急促、外周血白细胞增加、感染发生率为4.62%,对照组为20.00%,组间差异明显,可见联合治疗能最大幅度降低炎性因子,避免造成机体损伤。
尽管CVVH+HP联合在脓毒症治疗中有较大优势,但其也存在一定缺陷,在多次血液滤过及灌流下患者肾功能被改善,但多次滤过会导致血液中血小板数量增加,进而使血液中纤维析出,静脉滤网严重阻塞,管道凝血现象发生。为保证联合治疗效果需行抗凝治疗,目前临床常用抗凝剂是普通肝素,其特点为床旁监测方便,药物代谢速度较快,且可被鱼精蛋白中和,但此药物会直接作用于患者血液,对血液系统功能产生一定影响,甚至引发凝血功能障碍,因此必须注意监测凝血指标,维持APTT(活化部分凝血酶时间)为50~70 s。
综上所述,在脓毒症患者治疗中实施CVVH+HP联合治疗方式,能快速改善患者肺功能及血流动力学水平,提升炎性因子清除率,预后良好且能有效降低患者并发症发生风险,由此可见CVVH+HP联合治疗效果显著,此法值得在临床上推广使用。

