多聚免疫球蛋白受体在变应性鼻炎患者鼻黏膜的表达及临床意义△
邓智锋 许昱 向荣 朱霆
(武汉大学人民医院耳鼻咽喉头颈外科 武汉 430060)
变应性鼻炎 (allergic rhinitis , AR)是一种常见的鼻黏膜慢性非感染性炎症性疾病,主要表现为鼻痒、打喷嚏、流清涕、鼻塞,频发的症状严重影响患者的生活质量[1]。目前AR的发病机制尚不明确,可能与鼻黏膜的免疫缺陷有关。多聚免疫球蛋白受体(polymeric immunoglobulin receptor, pIgR)作为免疫球蛋白超家族中经典的一员,可特异性结合和转运多聚免疫球蛋白A(pIgA)和多聚免疫球蛋白M(pIgM),在先天性免疫应答和适应性免疫应答中起关键作用[2-3]。目前针对pIgR与AR关系的研究鲜有报道,本研究观察pIgR和IgA在AR患者鼻黏膜的表达,并初步探讨pIgR在AR发病中的作用。
1 材料与方法
1.1 材料 选取2016年1月~2017年5月在我科行鼻内镜手术的患者22例,其中AR患者(AR组)12例,男性7例、女性5例;年龄21~42岁,平均(31.3±2.5)岁。单纯鼻中隔偏曲患者(对照组)10例,男性6例、女性4例;年龄20~45岁,平均(32.7±2.8)岁。诊断标准依据2015年天津AR诊断和治疗指南[4]。所有患者皮肤点刺试验结果显示粉尘螨++及以上。术中收集的鼻黏膜组织一部分置于4%的甲醛溶液固定后用于免疫组织化学分析,另一部分鼻黏膜组织置于液氮中保存用于实时聚合酶链反应(real time PCR, RT-PCR)分析。该实验方案获得我院伦理委员会审核并通过,所有患者均签署知情同意书。
1.2 免疫组织化学分析 参考SP超敏试剂盒(购 自 北 京 中 杉 金 桥 生 物 技 术 有 限 公 司)说明书进行操作。将石蜡切片,脱蜡至水洗,室温下在3%过氧化氢甲醇溶液中孵育20 min;然后采用乙二胺四乙酸(EDTA)修复液(pH=9.0)进行修复,时间约20 min;滴加一抗1∶50 (兔抗人pIgR多克隆抗体和兔抗人IgA多克隆抗体,均购于美国Abcam公司),4 ℃冰箱过夜。依次滴加二抗及显色液,冲洗后苏木素复染、脱水、透明、中性树胶封片,置于显微镜下采集图片。 为测定pIgR和IgA 在AR组和对照组鼻黏膜细胞的表达水平,随机选取5个视野(200倍),用软件对照片进行分析,将发现棕褐色颗粒的细胞定为阳性细胞,测出阳性染色面积占整张图片面积的百分比。
1.3 RT-PCR 应用 Trizol法抽提组织和细胞中的总 RNA,用 PCR Master Mix (美国Fermentas公司)反转录成cDNA,并以其为模板进行PCR扩增。pIgR上游引物5′TGCTGACCTCCAAGTGCTAA3′,下游引物5′TCACCACACTGAATGAGCCA3′;IgA 上 游 引 物5′AC-TTCCAATGCCCGCACAAT3′,下游引物5′CAGGACTG-CTGGTATGACTC3′;内参照β-actin上游引物5′AGCG-AGCATCCCCCAAAGTT3′,下游引物5′GGGCACGAA-GGCTCATCATT3′(中 国 金 斯 瑞 生 物 科 技 有 限 公 司),PCR反应条件均为:95 ℃预变性15 s,94 ℃变性30 s,60 ℃ 1 min ,共40个循环,72 ℃延伸10 min。最后取10 mL反应液进行琼脂糖凝胶电泳,采集照片并进行扫描。每组均设置3个复孔,β-actin为参照,分析pIgR 及IgA mRNA的相对表达量。

2 结果
2.1 pIgR 和IgA在鼻黏膜的表达部位 鼻黏膜的免疫组织化学结果显示,pIgR 主要表达在鼻黏膜的上皮细胞及腺细胞,基底细胞及杯状细胞无表达;IgA主要表达在鼻黏膜的上皮细胞及固有层。
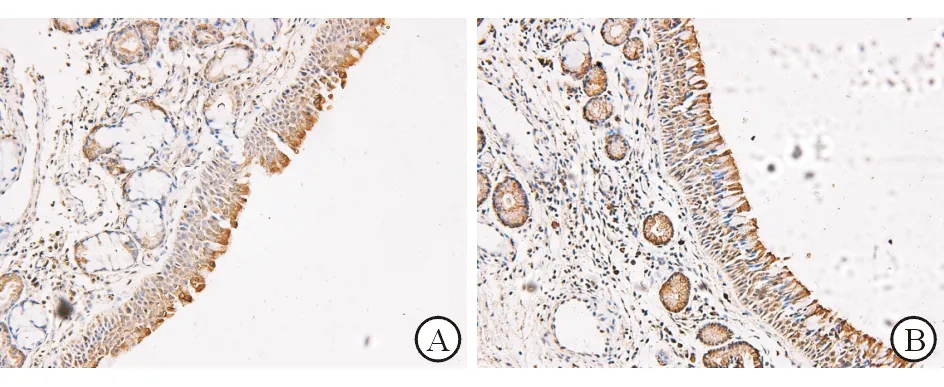
图1 pIgR在AR组和对照组中的表达(SP×200) A. AR组;B. 对照组
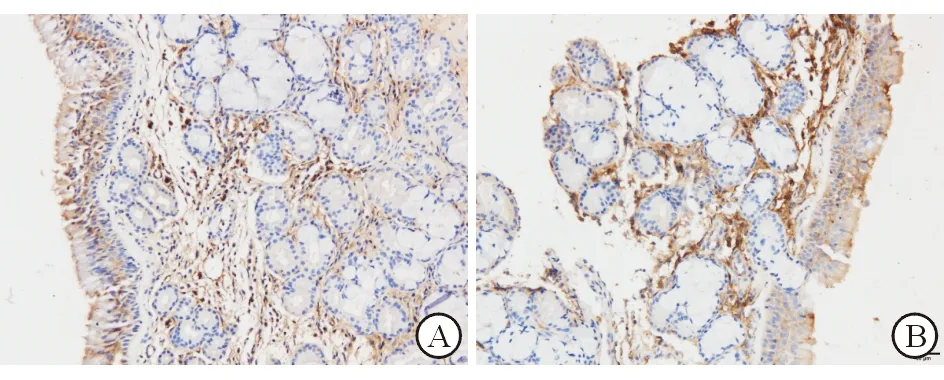
图2 IgA 在AR组和对照组中的表达(SP×200) A. AR组;B.对照组
2.2 pIgR 和IgA的RT-PCR分析 下鼻甲鼻黏膜pIgR mRNA表达水平在AR组明显低于对照组, IgA mRNA表达水平在AR组明显高于对照组,差异有统计学意义(P<0.05)。见表1。

表1 2组下鼻甲鼻黏膜中pIgR 和IgA mRNA表达水平的比较
2.3 pIgR和IgA免疫组织化学染色及结果判定 AR组鼻黏膜pIgR的阳性表达明显低于对照组,AR组鼻黏膜IgA阳性表达明显高于对照组,2组表达差异均有统计学意义 (P值均<0.05)。见表2。
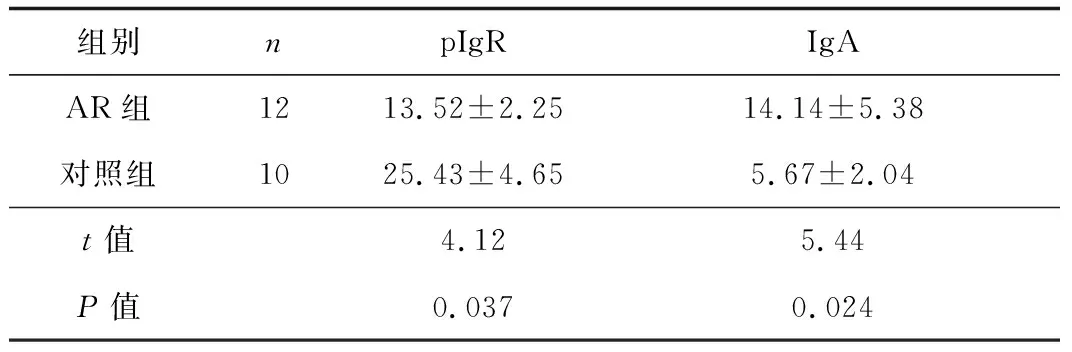
表2 2组下鼻甲鼻黏膜中pIgR 和IgA蛋白表达水平的比较
3 讨论
pIgR是一种细胞跨膜蛋白受体,在先天性免疫应答和适应性免疫应答中起关键作用[5-6]。pIgR主要由上皮细胞和腺体产生,可以将IgA从黏膜固有层转运至黏膜表面,同时其胞外段被蛋白水解酶裂解,形成分泌型免疫球蛋白(secretory IgA,sIgA),后者包括分泌成分(secretory component,SC)即pIgR的胞外段和IgA[7]。SC具有高度的稳定性,其多糖侧链可以封闭IgA最易被蛋白酶降解的铰链区;另外,分泌物中的SC可以使黏液更加黏稠,并且SC的糖基黏附于黏膜上皮,使SIgA在黏膜表面整齐排列,增加了上皮细胞表面黏液的黏附作用和防御能力。IgA是黏膜组织中的主要球蛋白,由浆细胞产生,在黏膜上皮主要以SIgA的形式存在,能够发挥多种保护作用,如黏附或中和病原体、免疫排除功能、调理作用等[2,8-9]。
在维持鼻黏膜机体稳态中,被转运至黏膜表面的sIgA可以与病原体结合,阻止病原体在黏膜表面的吸附,从而阻止病原体进入或破坏上皮细胞[8,10]。SC可以在黏膜表面与某些细菌成分相结合,减少感染发生率;SC还可以直接参与对机体的保护,能够发挥清除微生物的作用,发挥非特异性免疫保护功能[11-12]。SC可以降低细菌毒素对上皮细胞的损害,还可以阻止sIgA的降解,发挥保护sIgA的作用,提高黏膜的免疫功能[2,8,13]。
有研究[14-15]报道,pIgR在黏膜上皮的不同部位发挥防御功能。但在一定情况下微生物可以利用pIgR介导的穿胞转运作用为自己服务,即微生物通过pIgR介导侵入黏膜上皮屏障。在哺乳动物中,pIgR的表达上调能够促进sIgA的分泌,但pIgR的调节机制尚不明确,其表达和功能受多种因素的影响,如病原相关分子模式、促炎因子、激素等[16-17]。如细胞因子干扰素-γ(interferon γ, IFN-γ)刺激人肠上皮细胞系(HT-29细胞),发现IFN-γ的剂量与pIgR的浓度呈一定的剂量依赖关系;研究[19]发现,微生物及其代谢产物如脂多糖、丁酸盐、双链RNA及呼吸道病毒都可以上调人肠上皮黏膜pIgR的表达,丁酸盐能够上调HT-29细胞pIgR的表达[11,18]。我们早前的研究发现pIgR的表达还与嗜酸性粒细胞及Th17细胞转录因子有关。
黄丽等[20]发现,干燥综合征患者唾液腺上皮细胞中pIgR mRNA表达水平和pIgR表达水平均明显低于对照组,可能是诱发干燥综合征的重要机制之一。本研究发现,pIgR主要表达在鼻黏膜的上皮层和固有层腺体,IgA主要表达在鼻黏膜的固有层;与对照组比较,AR患者鼻黏膜组织中IgA的表达增多,pIgR的表达下降,差异有统计学意义。鉴于此,我们推测AR鼻黏膜组织中pIgR的表达下降,使IgA的转运受阻,导致IgA堆积,这种黏膜的免疫缺陷可能与AR的发生密切相关。
综上所述,我们证实了pIgR在AR鼻黏膜中的表达下调 ,提示pIgR介导的天然免疫在鼻黏膜防御作用下降可能是AR的一个重要发生机制。我们将进一步探究pIgR在AR鼻黏膜中表达的调控途径,为AR的治疗提供新思路。

