SLE-UPLC-MS/MS检测血液中溴敌隆和大隆*
时巧翠,李晓飞,谢伟宏
(1 浙江警察学院刑事科学技术系,浙江 杭州 310053;2 杭州市公安局刑事科学技术研究所,浙江 杭州 310004)
我国是农业大国,灭鼠剂应用广泛。因为毒性强,极易引起中毒,毒鼠强、氟乙酰胺等急性灭鼠药逐渐被禁止使用。现在被广泛使用的主要是抗凝血类的慢性杀鼠药[1]。溴敌隆和大隆是目前使用较多的抗凝血杀鼠药。由于溴敌隆和大隆比较容易获得,近年来人、家畜等误食中毒以及被用来投毒的情况时有发生。因此,建立一种快速检测血液中溴敌隆和大隆的方法,既能使中毒者获得对症治疗又可以为公安机关立案侦破及诉讼提供科学依据。
目前在法庭科学中广泛应用的前处理方法主要有固相萃取、液液萃取等。这些前处理方法虽然成本较低,但存在操作繁琐费时,常需要使用对人体和环境有毒害作用的有机溶剂且提取率较低。样品前处理技术是能够直接影响毒物检出率的关键步骤[2]。Johnson于1997年提出一种新的样品前处理技术,即介质液液萃取(supported liquid extraction,SLE)技术[3]。该技术操作简便,基质干扰小,能大大缩短样品的提取时间,提高样品的回收率,并且在96孔板结构的高通量体系中也可以使用。在药物分析[4],食品安全,环境检测及法庭科学等很多方面都有应用介质液液萃取技术的相关报道[5-6]。
目前,一般采用气相色谱法[7]、液相色谱法[8]、气质联用法及液质联用法[9-10]等来检测生物捡材中的溴敌隆和大隆。本研究建立了SLE-UPLC-MS/MS(介质液液萃取-高效液相色谱-三重四级杆/复合线性离子阱质谱)检测血液中溴敌隆和大隆的方法。该方法能够快速有效地对血液样品中的溴敌隆和大隆进行定性与定量分析且具有选择性强、提取率高、 重现性好,检测时间短等特点。
1 实 验
1.1 试剂与仪器
高效液相色谱/质谱联用仪(Shimazu LC 20A/AB Sciex Qtrap 6500);介质液液萃取柱(Biotage ISOLUTE SLE 1 mL)。100 μg/mL的溴敌隆和大隆标准溶液,Accustandard公司。
缓冲溶液:pH为2的缓冲溶液由0.2 mol/L HCl溶液和0.2 mol/L KCl溶液按比例配制而成;用0.2 mol/L Na2HPO4溶液和0.2 mol/L NaH2PO4溶液按比例配制成pH为4和6的缓冲溶液;pH为7的缓冲溶液以饱和NaCl溶液代替。
甲酸、甲醇、乙腈均为色谱纯。乙酸乙酯、二氯甲烷、氯仿均为分析纯。
1.2 仪器工作条件
色谱条件:色谱柱为Kinetex C18(50 mm×3.0 mm,2.6 μm);柱温40 ℃;流速0.8 mL/min。流动相:A相为0.1%甲酸水溶液,B相为乙腈:甲醇=1:1(V:V)。梯度洗脱程序为:B相初始为10%,0.5 min升到90%,保持到3 min,3.1 min降到10%,一直保持到6 min,进样量5 μL。
质谱条件:电喷雾离子源(ESI);分析物在负离子模式下进行检测;辅助加热气温度为500 ℃;离子化电压为-4500 V;压力选择Medium;喷雾气压力为50 psi;辅助加热气压力为50 psi;多反应监测(MRM);气帘气压力为20 psi;碰撞气为N2。主要质谱参数如表1所示。
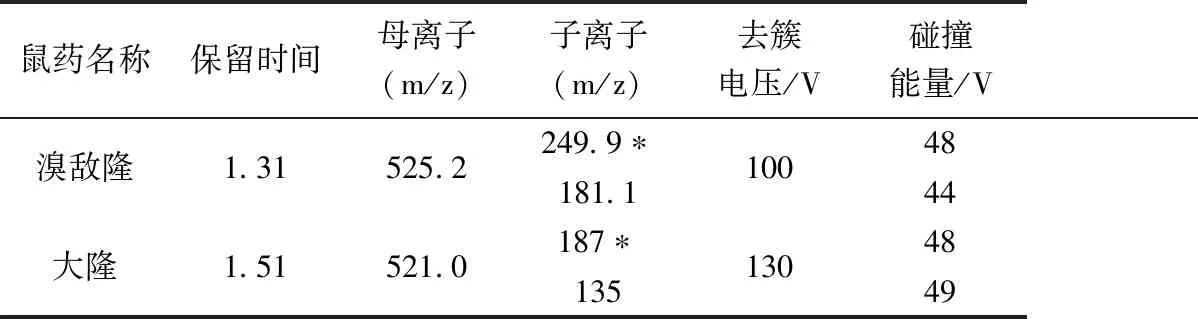
表1 溴敌隆和大隆的质谱参数Table 1 Mass spectrometric parameters for bromoadiolone and brodifacoum
1.3 血液样品的处理方法
在空白血液中加入一定量的溴敌隆和大隆,在振荡器上振动30 s,使其混合均匀。用移液枪准确移取0.5 mL血样,加入到0.3 mL 缓冲溶液(pH=2)中,振荡器上振动30 s,混合混匀。将上述制备好的血液样品加入到SLE柱中并施加一定的压力,使样品全部均匀分散在填料上。静置2 min后,用流速为1 mL/min的洗脱液将其洗脱,并施加压力将柱中残余液体挤出。用氮气将洗脱液吹干后,用初始流动相溶解并定容至1 mL,在上述选定的仪器工作条件下进行测定。
2 结果与讨论
2.1 质谱条件的选择
取浓度为100 ng/mL的溴敌隆与大隆标准溶液,ESI负离子模式下,采用微量蠕动泵连续进样,一级质谱全扫描,来确定二者的准分子离子。溴敌隆与大隆的准分子离子峰分别为525.2(m/z)和521.0(m/z)。以溴敌隆和大隆的准分子离子峰为母离子进行二级质谱扫描,选丰度最高的两个特征碎片离子作为定性定量离子。对特征离子对的去簇电(Declustering-potential,DP)、碰撞能量 (Collision energy,CE ) 碰撞室入口电压(Entrance potential,EP)和出口电压(Collision cell exit potential,CXP) 进行优化。相关主要质谱参数如表1所示。
2.2 液相色谱条件的选择
在实验过程中分别比较了体积比为1:1乙腈-甲醇溶液、0.1%甲酸-水、0.1%甲酸-甲醇、0.1%甲酸-乙腈、0.1%甲醇-乙腈、水-乙腈共6种流动相对分析结果的影响。当流动相为0.1%甲酸-水溶液时,溴敌隆和大隆的峰形和分离效果都比较理想,因此实验过程中选择0.1%甲酸-水溶液和体积比为1:1乙腈-甲醇溶液为流动相进行梯度洗脱。溴敌隆和大隆的MRM图质谱图分别如图1和图2所示。
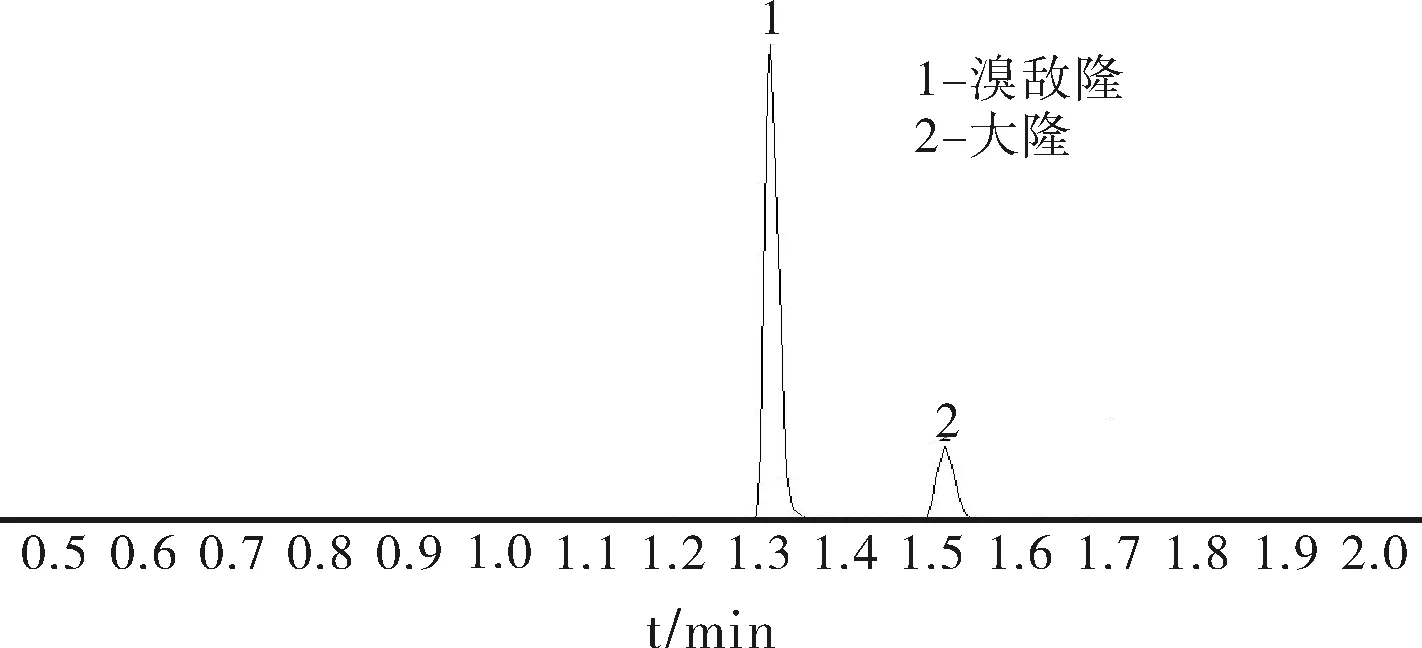
图1 溴敌隆和大隆的总离子流图Fig.1 TIC of bromoadiolone and brodifacoum

图2 溴敌隆和大隆的MRM图Fig.2 MRM chromatogram of bromoadiolone and brodifacoum
2.3 介质液液萃取(SLE)条件的优化
在空白血液基质中配制含有溴敌隆和大隆均为100 ng/mL的标准溶液并采用UPLC/MS/MS进行检测分析。
2.3.1 萃取体系pH值的选择
传统液液萃取方法提取血中溴敌隆和大隆,一般不需要添加缓冲溶液。在本实验中采用液液萃取柱,不添加缓冲溶液,仅根据溴敌隆和大隆的溶解性,分别采用乙酸乙酯、氯仿、二氯甲烷进行提取,结果显示溴敌隆和大隆的回收率均小于1%。若添加酸性缓冲溶液则能大幅度提高溴敌隆和大隆的回收率。
在实验过程中固定平衡时间为2 min、溶剂使用4 mL×2乙酸乙酯,考察萃取体系的pH值分别为2、4、6、7条件下萃取效率变化。结果发现萃取体系的pH值为2时,溴敌隆和大隆回收率最高。这可能是因为溴敌隆和大隆均为弱酸性结构的原因。因此实验过程中选择萃取体系的pH值为2。
2.3.2 萃取溶剂的选择
固定萃取体系的pH值为2、平衡时间为2 min、溶剂使用量为4 mL×2,考察乙酸乙酯、氯仿、二氯甲烷以及二元混合溶剂乙酸乙酯+氯仿=1+1、乙酸乙酯+二氯甲烷=1+1几种萃取溶剂的萃取效果。结果发现使用乙酸乙酯作为萃取溶剂时溴敌隆和大隆的回收率均大于85%,回收效果较好。因此实验过程中选择乙酸乙酯作为溴敌隆和大隆的萃取溶剂。
2.3.3 萃取溶剂用量的选择
固定pH条件为2、平衡时间为2 min、溶剂使用乙酸乙酯,当萃取溶剂使用量分别为2 mL×2、3 mL×2、4 mL×2时,溴敌隆和大隆的回收率随萃取溶剂用量的增加而增加。当萃取溶剂使用量为5 mL×2时,溴敌隆和大隆的回收率反而有所降低。因此实验过程中选择乙酸乙酯的用量为4 mL×2。
2.3.4 平衡时间的选择
固定pH条件为2、使用4 mL×2乙酸乙酯作为萃取溶剂,当样品均匀分散在SLE柱填料上以后,考察静置时间分别为2 min、5 min、10 min时溴敌隆和大隆的回收率。结果发现当平衡时间为2 min时,溴敌隆的回收率最高,随着平衡时间的增加溴敌隆的回收率开始下降。但大隆的回收率随平衡时间的变化较小。因此选择2 min为实验过程的平衡时间。
2.4 方法验证
2.4.1 工作曲线和方法检出限
在空白血液基质中配制含有溴敌隆和大隆均为5、10、25、50、100、200 ng/mL 6个浓度水平的添加血,按选定的色谱和质谱条件进行测定。以峰面积(y)对样品中溴敌隆和大隆的质量浓度(x, ng/mL)作图,溴敌隆和大隆的线性范围、线性回归方程和相关系数如表2所示。采用的含有溴敌隆和大隆均为1 ng/mL的添加血,按上述试验方法进行检测分析,以丰度较低的子离子峰强度的信噪比(S/N)为3计算溴敌隆和大隆的检出限(LOD)分别为0.1 ng/mL和0.092 ng/mL。

表2 溴敌隆和大隆的线性参数及检出限Table 2 Linear equation, correlation coefficient, linear range and LOD of bromoadiolone and brodifacoum
2.4.2 方法的加标回收率和精密度

表3 溴敌隆与大隆在空白血液中的加标回收率和精密度(n=6)Table 3 Recoveries and precision of bromoadiolone and brodifacoum in spiked blank blood
采用空白血样加标的方式进行回收率实验,在线性范围内分别加入浓度为10,50,200 ng/mL的溴敌隆和5,50,200 ng/mL的大隆,按照以上所选定的实验方法平行测定6次,两种目标化合物的平均回收率78.7%~95.8%,RSD为3.3%~8.6%,具体数据如表3所示。
3 结 论
本研究利用SLE技术结合高效液相色谱-三重四级杆/复合线性离子阱质谱建立了血液中溴敌隆和大隆的检测方法。利用该检测方法对血液中的溴敌隆和大隆进行了定性与定量分析。实验结果表明本方法具有良好的灵敏度、精密度和重现性,能快速高效检测血液中的溴敌隆和扎大隆,满足侦查、诉讼及医疗急救的检测要求。

