人卵母细胞体外成熟后受精所形成胚胎筛选模式的建立
狄春光,王慧,王功发,王毅,华科,王丽萍
(浙江省嘉兴市妇幼保健院生殖中心,嘉兴 314000)
卵母细胞体外成熟(in vitro maturation,IVM)是一项新的辅助生殖技术,可用于难治性多囊卵巢综合征(PCOS)患者和促排卵周期中卵巢反应不良患者不成熟卵母细胞的体外培养成熟,目前国内外IVM技术并不是很成熟。有研究表明IVM后的卵母细胞纺锤体结构和染色体构型异常比例要高于正常胚胎[1],因此如何在IVM胚胎中筛选出正常且发育潜能高的胚胎,是临床上亟待解决的问题。目前的胚胎形态学评估只能在固定的时间点对胚胎进行观察[2],不能对影响胚胎发育潜能的非正常事件,如非二倍性卵裂等进行观察评估,故胚胎形态学评估在不同发育潜能的胚胎筛选上有一定局限性[3]。而时差成像系统(time-lapse imaging,TLI)为非侵入性胚胎评估系统,通过对培养中的胚胎进行连续观察,获得与胚胎发育相关的动力学参数,从而准确评估其发育潜能[4-5],是对胚胎形态学评估的一个有力补充。因此本研究利用TLI结合胚胎形态学评估方法建立一种新的IVM胚胎筛选模式,以期为临床实践中挑选高发育潜能的胚胎移植提供参考,以提高患者临床妊娠率。
资料与方法
一、研究对象
收集2016年2月至2019年5月于本中心接受IVF/ICSI-ET助孕治疗患者的402枚未成熟卵母细胞进行IVM培养。卵母细胞IVM后行ICSI授精,精子来源均为患者丈夫,受精后的胚胎在TLI系统中观察培养。排除标准:合并艾滋病、梅毒、乙型肝炎抗原阳性患者。本研究通过本院医学伦理委员会审查,所有患者夫妻双方已签署知情同意书。
二、研究方法
1.IVM培养液准备:G-2 plus胚胎培养液(Vitrolife,瑞典),含有0.2 μg/ml 17β-雌二醇(Sigma,美国)、75 U/L FSH和150 U/L HCG(Serono,瑞士)。
2.未成熟卵母细胞的收集及培养:所有患者从上一月经周期排卵后7 d或月经第2天开始注射达菲林(Ipsen,法国)针剂0. 1 mg/d,降调节至少14 d后检查性激素水平,达降调水平,开始注射果纳芬(Serono,瑞士)或丽申宝(珠海丽珠制药)进行控制性促排卵,至双侧卵巢内有2个或2个以上的卵泡直径达 18 mm时,注射重组HCG 250μg(Serono,瑞士),36 h后在阴道超声引导下取卵。ICSI前剥除卵母细胞周围的大部分颗粒细胞,经倒置显微镜观察卵母细胞的成熟程度,选择未成熟卵母细胞(GV期或MI期)供本研究使用。将未成熟卵母细胞移入IVM培养液中培养24~40 h,如果卵母细胞成熟则行ICSI受精,受精卵在TLI系统中培养。
3.TLI系统使用及胚胎培养:使用Primo Vision(Vitrolife,瑞典)TLI系统,图像每5 min采集1次,共连续培养6 d。所有胚胎均采用WOW 9孔培养皿,卵裂期胚胎培养液为37℃、6%CO2平衡过夜的G-1 plus(Vitrolife,瑞典)培养液。囊胚培养为37℃、6%CO2平衡过夜的G-2 plus(Vitrolife,瑞典)培养液,培养过程中均有Primo Vision成像系统采集图像,并进行胚胎发育的动力学参数与卵裂模式分析。
4.胚胎发育时间参数和卵裂模式设定:胚胎发育各时间点的命名方法参照Ciray标准[6],将ICSI受精时间记为“0”点,原核消失时间(tPNF),发育至2细胞时间为t2,发育至3细胞时间为t3,以此类推为t4、t5。2细胞发育至3细胞所需时间为cc2,3细胞发育至4细胞所需时间为s2,比较第3天(D3)IVM胚胎未形成囊胚组(A组)和形成囊胚组(B组)相应的动力学参数。胚胎的卵裂模式包括正常卵裂、非轴性卵裂、不均、卵裂球碎裂、非二倍性卵裂、发育停滞等。
5.胚胎评估标准:卵裂期胚胎评估参考Peter标准[7],囊胚期胚胎评估参考Gardner标准[8]。D3可移植胚胎:细胞数≥4个,碎片≤30%,胚胎内无异常结构;D3优选胚胎:细胞数7~12个,碎片≤20%;D3次选胚胎:D3可移植胚胎中优选胚胎除外的胚胎。
三、统计学分析
采用SPSS 25.0软件对数据进行统计学分析。胚胎动力学参数tPNF、t2、t3、t4、t5、cc2、s2等计量资料不符合正态分布,以中位数(四分位数)[M(Q25,Q75)]表示,组间比较用非参数Kruskal-Wallis秩和检验。对非二倍性卵裂发生率、囊胚形成率等计数资料用频数和率表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
结 果
一、胚胎形态学评估选择发育潜能更高的IVM胚胎
本研究共纳入402枚未成熟卵母细胞进行IVM培养,共有315枚成熟,成熟率为78.4%;对315枚IVM成熟卵母细胞进行ICSI后,正常受精219枚,形成D3可移植胚胎数162枚。按胚胎形态学标准评估,在D3获得优选胚胎95枚,次选胚胎67枚。优选胚胎和次选胚胎的囊胚形成率比较,差异有统计学意义(P<0.05)(表1)。

表1 两组囊胚形成率比较(%)
二、IVM胚胎卵裂模式与囊胚形成的关系
通过TLI观察,我们发现在219枚受精卵中非二倍性卵裂的发生率最高(24.2%),其后分别为正常卵裂(21.9%)、不均(17.8%)、发育停滞(16.9%)、非轴性卵裂(10.1%)、卵裂球碎裂(9.1%)。IVM胚胎中正常卵裂胚胎的囊胚形成能力最高(52.1%),其次是非轴性卵裂胚胎(45.5%),再次为分裂不均胚胎(35.9%),卵裂球碎裂最低(10.0%),发育停滞和非二倍性卵裂胚胎均无囊胚形成(表2)。
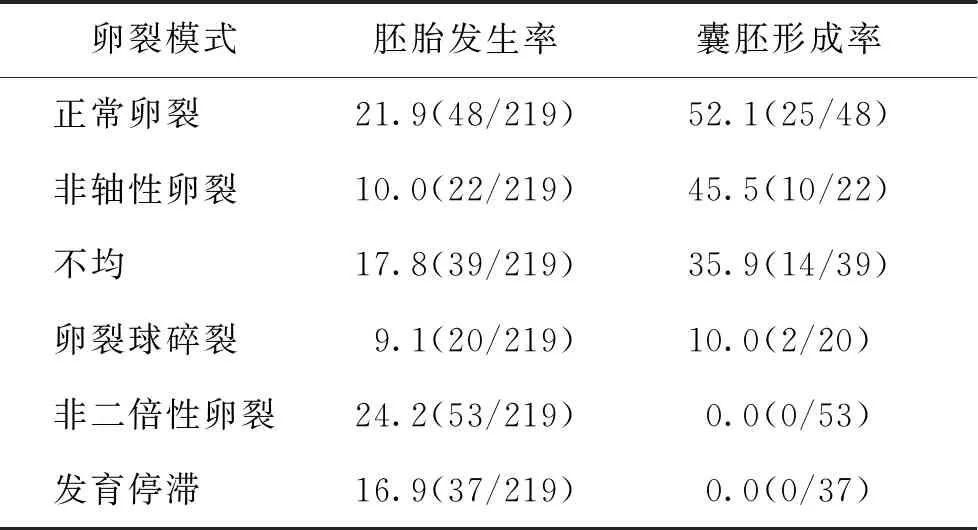
表2 IVM胚胎中各卵裂模式的发生率和囊胚形成率(n=219,%)
三、动力学参数对IVM胚胎发育潜能的预测性
D3 IVM胚胎未形成囊胚组(A组,111枚)和形成囊胚组(B组,51枚)相应的动力学参数进行比较,发现两组动力学参数tPNF、t2、t3、cc2、s2比较均无显著性差异(P>0.05),t4、t5比较有显著性差异(P<0.05)(表3),提示t4、t5对IVM胚胎的发育潜能具有一定预测性。B组t4、t5的参数值范围分别为(24.6~41.9)h和(26.1~56.9)h,该范围内的IVM胚胎具有更高的囊胚形成能力。
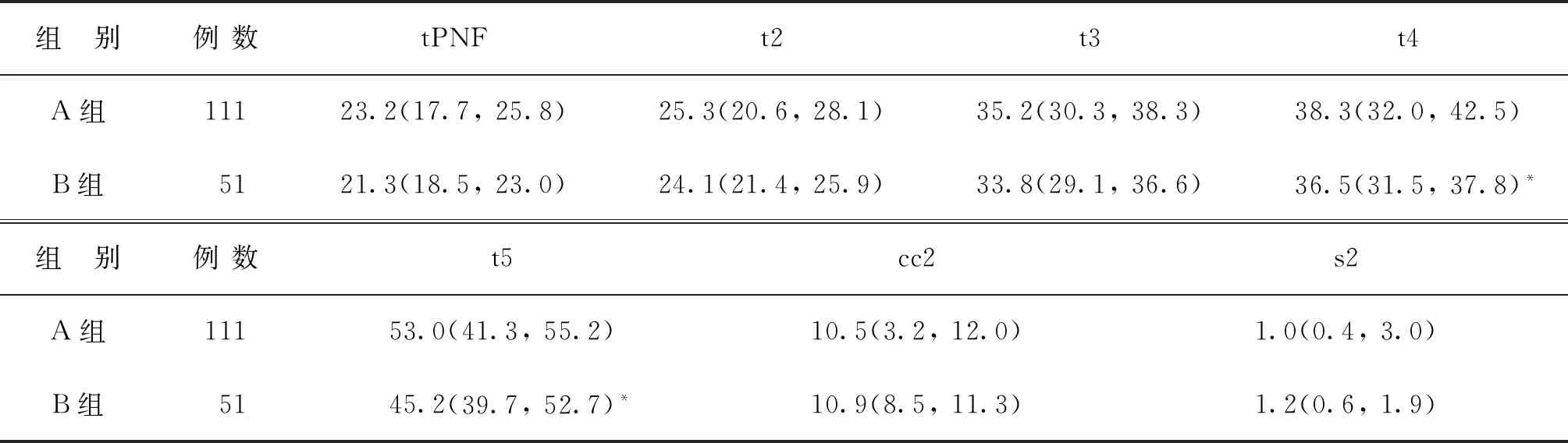
表3 两组动力学参数比较[M(Q25,Q75),h]
四、TLI结合胚胎形态学评估建立IVM胚胎筛选模式
首先在D3 IVM胚胎中排除发生非二倍性卵裂的胚胎,非二倍性卵裂胚胎为废弃胚胎(即E级胚胎)。然后再按胚胎形态学评估将IVM胚胎分为可移植胚胎和废弃胚胎,继续将可移植胚胎分为优选胚胎和次选胚胎,结合形成囊胚最佳的t4、t5动力学参数范围,再筛选出A、B、C、D四级胚胎。A级胚胎符合优选胚胎标准,且胚胎t4、t5动力学参数均在最佳范围内;B级胚胎符合优选胚胎标准,胚胎t4、t5动力学参数不在最佳范围内;C级胚胎符合次选胚胎标准,胚胎t4、t5动力学参数均在最佳范围内;D级胚胎符合次选胚胎标准,胚胎t4、t5动力学参数不在最佳范围内。胚胎移植或冷冻优先级为A>B>C>D(图1)。

图1 IVM胚胎筛选模式
五、验证筛选模式下所选胚胎的囊胚形成能力
再次收集123枚未成熟卵细胞,经IVM成熟92枚,受精后得到D3可移植胚胎43枚。在所建立的筛选模式下筛选出A级胚胎14枚、B级胚胎11枚、C级胚胎8枚、D级胚胎10枚,继续囊胚培养,结果优选胚胎囊胚形成率44.0%。该模式下各级胚胎的囊胚形成率如下:A(64.3%)>B(18.2%)>C(12.5%)>D(10.0%)。该模式所选出的A级胚胎囊胚形成率显著高于优选胚胎(64.3% vs. 44.0%)(P<0.05),证实该筛选模式在IVM胚胎高发育潜能胚胎的筛选中有较高的应用价值。
讨 论
如何快速有效地挑选高发育潜能的IVM胚胎,一直是临床上亟待解决的问题。本研究中我们利用TLI系统结合卵裂期胚胎形态学评估,建立了有效准确的IVM胚胎筛选模式,有利于优化筛选胚胎流程,快速挑选出高发育潜能的胚胎进行移植,经筛选后的A级胚胎囊胚形成率为64.3%,远高于胚胎形态学评估所得优选胚胎的囊胚形成率44.0%,具有非常大的临床应用价值。
胚胎发育过程中,一些非正常事件的发生,如非二倍性卵裂、不均、发育停滞、非轴性卵裂、卵裂球碎裂等,都可能预示着胚胎未来的命运[9]。非正常事件中不均、发育停滞可以通过在D1、D2、D3等固定时间点对胚胎进行形态学观察对照发现,而非二倍性卵裂、非轴性卵裂和卵裂球碎裂则很难被传统胚胎形态学评估方法发现,TLI技术对胚胎不间断地连续观察,可获取胚胎发育全过程的动态影像,能对胚胎发育进行更加全面和细致的记录[10],因此非轴性卵裂、非二倍性卵裂、卵裂球碎裂可在TLI观察下迅速被发现。本研究中非轴性卵裂、卵裂球碎裂等胚胎均有囊胚形成,而非二倍体卵裂胚胎的囊胚形成率为0%,并且非二倍性卵裂发生率最高(24.2%),因此我们认为在IVM胚胎筛选中应首先剔除非二倍性卵裂胚胎。王珊珊等[11]报道非二倍性卵裂胚胎的优质囊胚形成率仅为2.16%。Athayde等[12]报道非二倍性卵裂胚胎的囊胚形成率为11.7%,种植率只有3.7%,建议非二倍性卵裂作为胚胎筛选的排除条件。因此,本研究中我们建立的IVM胚胎筛选模式中首要的排除条件为非二倍性卵裂胚胎。
目前已有很多研究将TLI技术运用到胚胎筛选评估中,主要通过胚胎动力学参数对胚胎发育潜能进行预测[13-15]。本研究中我们发现t4形成囊胚的最佳范围为(24.6~41.9)h,当t4>41.9 h时囊胚形成能力下降。Yang等[16]利用TLI系统研究其动力学参数对138枚受精卵发育成囊胚的影响,发现当t4>41.3 h时,胚胎形成囊胚能力下降。与我们的结果相似,也从侧面证实参数t4的重要性。t5同样可以作为胚胎发育潜能的预测性参数,Meseguer等[15]对285例ICSI周期患者胚胎的卵裂时间、卵裂球大小和多核等做了详细的回顾性分析,总共移植了522枚胚胎,结果显示当t5最佳范围为(48.8~56.6)h时,其胚胎种植率约40%,远高于其范围之外的种植率。本研究中我们确定的t5最佳范围为(26.1~56.9)h,比Meseguer等[15]的确定范围略大,分析其原因可能为各中心的促排卵方案、培养环境及人员操作等差异造成了各中心提取的共性参数有所不同。因此,各生殖中心应该根据最适合本中心的共性参数,挑选优质胚胎进行移植。
胚胎形态学评估虽然有一定局限性,但其挑选的正常优质胚胎的囊胚形成率依然可达60%以上,且效率远高于TLI,依然是各大实验室胚胎评估的主要方法。而TLI虽然有很多优点,但考虑到价格因素,每台TLI系统加上配套耗材估计使用价格达百万元以上,因此现阶段大规模的TLI应用还不现实,但对于反复移植失败、高龄、需IVM等特殊患者的应用,能提高TLI的使用价值。尤其使用TLI结合胚胎形态学评估对胚胎进行筛选,可使筛选高发育潜能胚胎的效果得到提高[17-18]。对反复移植失败、高龄、需IVM等患者而言,其胚胎染色体异常的概率远大于正常患者,利用TLI结合胚胎形态学评估方法从中筛选高发育潜能的胚胎,可以显著提高这些患者的妊娠率。本研究中我们进行IVM培养的不成熟卵母细胞是当患者的优势卵泡直径达18 mm时经过取卵后获得,患者所获得的卵母细胞大部分已成熟,不成熟卵母细胞只占小部分,患者有足够正常成熟卵母细胞来源的胚胎移植,因此IVM胚胎的临床应用价值仍然具有一定局限性[19]。而在临床上经典的IVM促排方案中,当优势卵泡直径达10 mm~12 mm时,超声引导下经取卵术获得的卵母细胞均不成熟,经IVM培养后才能成熟,并具有受精形成胚胎的能力。因此临床上经典的IVM促排方案对因卵泡发育迟缓影响卵母细胞成熟的不孕患者来说意义重大。利用TLI结合形态学评估方法建立的这种针对IVM胚胎的筛选模式,对经典IVM促排方案来源的IVM胚胎筛选,具有极高的借鉴和应用价值。

