354例耳聋高危儿及39例先天性耳聋患者基因突变分析
张钏,周秉博,张庆华,王兴,郝胜菊,陈雪,李富萍,刘亚利,刘青,马旭,曹宗富*
(1.国家卫生健康委科学技术研究所,北京 100081;2.北京协和医学院研究生院,北京 100730;3. 甘肃省妇幼保健院医学遗传学中心,兰州 730050)
耳聋是人类最常见的感觉缺陷之一,耳聋在新生儿中的发病率约为1/1 000[1-2]。约有50%~60%的耳聋是由遗传因素引起的[3]。耳聋的遗传方式有常染色体隐性遗传、常染色体显性遗传、线粒体遗传及X/Y连锁遗传。目前已经有超过110多个基因被报道与耳聋相关[4]。流行病学研究表明GJB2、SLC26A4和12SrRNA是遗传性耳聋最常见的致病基因[2]。耳聋的遗传学诊断非常重要,它可以为患者家庭提供治疗决策、预后信息和遗传咨询。本研究采用耳聋基因芯片、Sanger测序法及高通量测序Pannel法,对在甘肃省妇幼保健院遗传中心就诊的354个耳聋高危儿及39个耳聋患者家系进行耳聋基因诊断分析,并为这些家庭提供遗传咨询及产前诊断。
资料与方法
一、研究对象
收集2015年5月至2019年12月在甘肃省妇幼保健院遗传中心就诊的354例汉族耳聋高危儿患者及39例汉族耳聋患者家系的临床资料。本研究经甘肃省妇幼保健院伦理委员会批准[2016院伦审研第(4)号],血样的采集及临床资料的收集征得所有家系成员的同意,并签署知情同意书。
二、基因组DNA提取
采集耳聋高危儿足跟血干血斑,其父母抽取外周血2~3 ml;耳聋患者及其父母抽取外周血2~3 ml。干血斑及外周血基因组DNA分别按照干血斑基因组DNA提取试剂盒(北京天根生化科技有限公司)与血液基因组DNA提取试剂盒(北京天根生化科技有限公司)的说明书进行。耳聋患者家庭的先证者母亲再孕时,于孕18~21周经腹行羊膜腔穿刺,抽取羊水15 ml。按羊水细胞基因组DNA提取试剂盒(北京天根生化科技有限公司)说明书进行模板DNA的提取,于-20℃保存备用。
三、耳聋基因芯片检测
使用晶芯十五项遗传性耳聋相关基因检测试剂盒(北京博奥晶典)检测GJB2基因c.35delG、c.176_191del16、c.235delC及c.299_300delAT 4个位点;GJB3基因c.538C>T 1个位点;SLC26A4基因c.2168A>G、IVS7-2A>G、c.1174A>T、c.1226G>A、c.1229C>T、c.1975G>C、c.2027T>A及IVS15+5G>A 8个位点;线粒体12SrRNA基因chrM-1494C>T及chrM-1555A>G 2个位点。PCR扩增条件:37℃ 10 min,95℃ 15 min,95℃ 30 s,57℃ 30 s,70℃ 45 s,35 cycles;60℃ 10 min,12℃暂停。芯片杂交:50℃水浴1 h。扫描判读:结果由晶芯十五项遗传性耳聋相关基因检测分析系统自动判读。当探针的检测信号值大于或等于该探针位点的cut off值时,判断该探针为阳性;当探针的检测信号值小于该探针的cut off值时,判断该探针为阴性。
四、GJB2及12S rRNA基因突变分析
基因外显子扩增引物由上海生工公司合成。PCR扩增体系为25 μl:其中2×Taq PCR Mastermix(北京天根生化科技有限公司)12.5 μl,基因组DNA模版1.5 μl(浓度20~50 ng/μl),上下游引物(10 μmol/L)各 0.5 μl,ddH2O 10 μl。PCR引物及扩增条件见表1,由于GJB2扩增产物较长,除了正反向测序外,同时使用两条测序引物进行测序反应,两条测序引物(5’-3’)分别为:TGGGTTTTGATCTC-CTCGATG,GCCTACCGGAGACATGAGAAG。PCR扩增产物经琼脂电泳鉴定后对目的条带单一的产物采用PCR产物纯化试剂盒(北京天根生化科技有限公司)纯化后,由ABI 3500型(ABI,美国)测序仪进行测序,测序结果使用SeqMan软件与标准序列进行比对分析,鉴定GJB2及12SrRNA是否存在突变。

表1 引物序列、产物大小及扩增条件
五、高通量测序Pannel分析
耳聋患者经GJB2及12SrRNA基因突变分析后,仍未明确突变者,采用高通量测序Pannel法(北京迈基诺基因科技股份有限公司)进行耳聋相关基因检测以明确致病突变,测序平均深度为200×,大于20×的靶向reads达到97%以上。
六、数据分析
高通量测序得到的结果与参考基因组(GRCh37/hg19)比对得到所有变异的文件,对检测到的碱基变异进行筛选,应用PolyPhen2(http:∥genetics.bwh.harvard.edu/pph2/)和 MutationTaster(http:∥www.mutationtaster.org/)软件对新变异进行蛋白功能预测,新变异致病性判读依据美国医学遗传学与基因组学会2015指南[5]。计数资料以率(%)表示。
结 果
一、耳聋高危儿基因芯片检测
晶芯十五项基因芯片检测发现,354例汉族耳聋高危儿中,316例高危儿未检测到突变,有21例检测到了GJB2基因突变,其中17例高危儿检测到GJB2杂合突变,2例高危儿检测到GJB2复合杂合突变,2例高危儿检测到GJB2纯合突变;有16例患者检测到了SLC26A4突变,其中11例高危儿检测到SLC26A4杂合突变,1例高危儿检测到SLC26A4复合杂合突变,4例高危儿检测到SLC26A4纯合突变;1例患者检测到12SrRNA均质突变。
GJB2突变中,突变频率最高的位点是c.235delC,其次为c.299_300delAT;SLC26A4突变中,突变频率最高的位点是c.919-2A>G(IVS7-2A>G),其次为c.1174A>T与c.2168A>G(表2)。
二、耳聋患者Sanger测序和高通量Pannel测序
Sanger测序及高通量Pannel测序发现,39例汉族耳聋患者中,有13例检测到了GJB2基因突变,其中9例检测到复合杂合突变,2例检测到纯合突变,2例仅检测到杂合突变;有15例患者检测到了SLC26A4突变,其中8例检测到复合杂合突变,5例检测到纯合突变,2例检测到杂合突变;10例患者检测到12SrRNA均质突变;1例患者检测到LOXHD1复合杂合突变。
GJB2突变中,突变频率最高的位点是c.235delC,其次为c.299_300delAT及c.109G>A;SLC26A4突变中,突变频率最高的位点是c.919-2A>G(IVS7-2A>G),其次为c.1174A>T、c.2162C>T、c.410C>T和IVS15+5G>A(表2)。

表2 耳聋高危儿及耳聋患者耳聋基因致病位点分布
三、耳聋患者家系产前诊断分析结果
39例汉族耳聋患者家系中,有6例先证者明确诊断的家系在再次妊娠时进行了遗传咨询及产前诊断。6例胎儿中,有3例检测到了与先证者相同的致病突变,2例胎儿仅检测到1个致病突变,1例胎儿未检测到与先证者相同的致病突变(表3)。
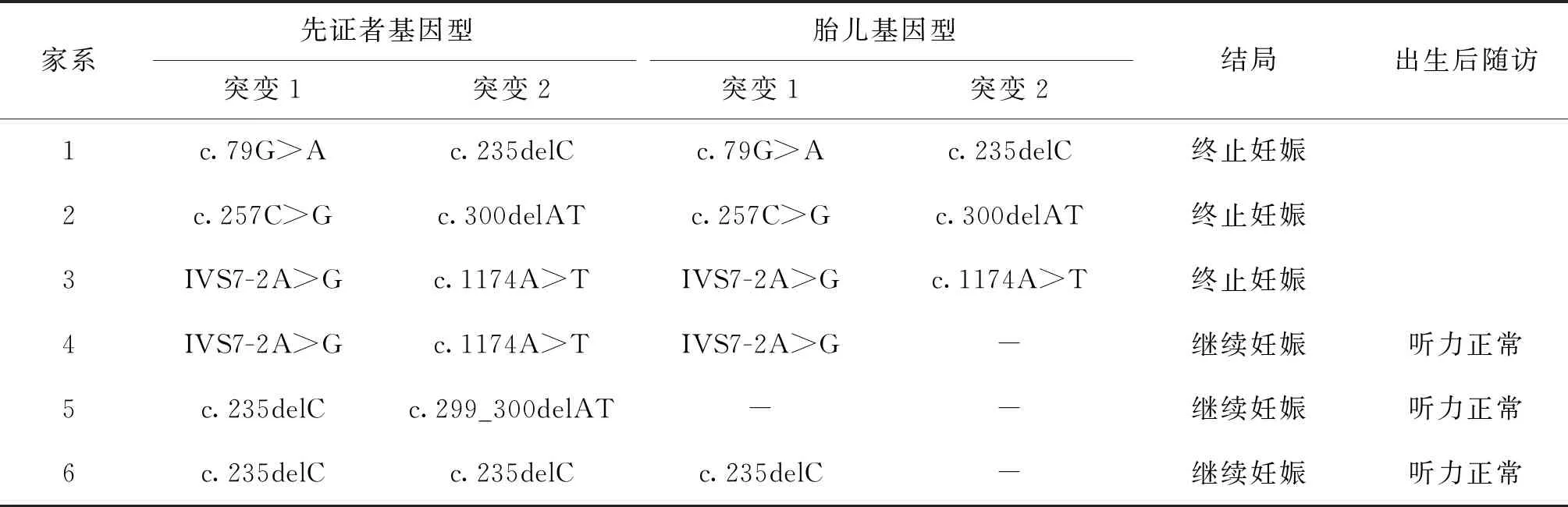
表3 耳聋家系产前诊断结果
讨 论
遗传性耳聋的致病基因受遗传背景影响,在不同地区、不同人种中耳聋致病基因及其突变频率存在明显的差异;在中国,GJB2、GJB3、SLC26A4及12SrRNA是遗传性耳聋的主要致病基因[6]。在本研究的39例汉族耳聋患者中,GJB2突变检出率为33.3%、SLC26A4突变检出率为38.5%、12SrRNA突变检出率为25.6%,高于国内新疆和福建地区报道的耳聋患者这三个基因的携带频率[7-8]。在本研究中,GJB2(c.235delC)位点及SLC26A4(c.919-2A>G)是最主要的突变位点,这与多个地区的文献报道[6,9-11]相一致。
我国已经普及了新生儿的听力筛查,有效降低了出生缺陷,但由于超过50%~60%的耳聋是由遗传因素造成,仅进行听力筛查不仅无法明确病因还会漏掉迟发性耳聋的检出。本研究中,354例耳聋高危儿中有38例(10.7%)检测到了耳聋基因突变,其中9例(2.54%)确诊为耳聋患者,1例为母系遗传药物性耳聋的易感个体。目前,国内多个省份地区已经开展了听力筛查+耳聋基因筛查的模式,有效提升新生儿异常检出率,可以更好地进行耳聋防治干预[12-14]。对新生儿进行耳聋基因筛查能及早发现母系遗传药物性耳聋的易感个体,通过用药指导可有效避免因药物导致的耳聋[15]。然而,目前国内新生儿的耳聋基因筛查只是在一些发达省份及地区普遍开展,在经济欠发达的西部省份还有待进一步推行新生儿耳聋基因筛查。
多种方法可以进行遗传性耳聋的基因诊断,包括基因芯片法、Sanger测序法、高通量测序Pannel法及全外显子组测序法等。临床上主要使用的是基因芯片法、Sanger测序法和高通量测序Pannel法。目前新生儿耳聋基因筛查主要使用的是耳聋基因芯片法,该方法虽然涵盖了GJB2、GJB3、SLC26A4及12SrRNA这4个耳聋基因,但是仅包含了少量的热点突变。近年来,高通量测序Pannel法和全外显子组测序法逐渐成为遗传性耳聋基因诊断的重要工具,可以发现一些罕见性的耳聋致病突变基因。
对新生儿进行耳聋基因筛查是预防耳聋的三级措施,对于生育过耳聋患者的家庭来说,明确致病基因及位点后,孕期进行产前诊断可以明确胎儿的基因型,从而有效避免患病胎儿的出生[16-17]。本研究对在甘肃省妇幼保健院诊断的39个耳聋患者家庭中的6个家庭进行了产前诊断,明确了胎儿的基因型,为这些家庭进行了生育指导。
本研究通过对354例耳聋高危儿进行耳聋基因检测,说明在新生儿中进行耳聋筛查+耳聋基因筛查的模式可以提高异常致病耳聋基因检出率,尽早地进行耳聋防治干预。高通量测序法可以提高耳聋致病基因的检出率,并且可以发现罕见的耳聋致病突变基因。通过对耳聋患者家系先证者进行耳聋基因产前诊断,可为这些家庭提供遗传咨询并进行生育指导,可以有效降低这些家庭的经济负担。

