SDBS改性海藻酸钠磁球吸附水体中Cu(Ⅱ)的性能
和 芹, 张红霞, 刘昌伟
(唐山师范学院 化学系, 唐山市绿色专用化学品实验室, 河北 唐山 063000)
重金属污染具有一定的生物毒性、 生物不可降解性及易在生物体内累积的特点[1], 因此, 需有效去除水体中的重金属离子. 目前, 去除水体中重金属的方法主要有化学沉淀法[2]、 生物法[3-4]和吸附法[5-9]等, 其中吸附法具有易操作、 低能耗、 低残留等优点, 是目前最常用的方法. 但传统吸附法大多利用具有较大比表面积及较高表面能的吸附剂进行物理吸附, 存在吸附后分离困难, 导致二次污染的缺点, 因此需研制新型高效且易分离吸附的材料. 将磁性铁氧化物与吸附材料结合所得磁性吸附材料具有高吸附性能和易分离的优点[10-21], 其中, 高分子类磁性吸附材料具有较高吸附量及吸附后可快速分离的优点而引起人们广泛关注: Shi等[14]制备了核壳结构的Fe3O4@SiO2@壳聚糖纳米粒子, 并将其用于去除水体中的Pb2+,Hg2+和Cu2+; 王君等[21]用两步法合成了Fe3O4@SiO2@壳聚糖磁性纳米材料, 对Cu2+的吸附量达154.8 mg/g, 但由于量子尺寸效应, 导致材料极易发生团聚, 因此在一定程度上限制了其在工程上的应用.
海藻酸钠(SA)广泛存在于褐藻类的海带或马尾藻中, 是一种天然高分子水凝胶, 与传统吸附材料相比, 具有更好的生物相容性, 原料来源丰富, 且成本低易回收[22-23]. 十二烷基苯磺酸钠(SDBS)是一种阴离子表面活性剂[24], 在水溶液中可电离出磺酸根产生阴离子吸附位, 通过静电作用吸附溶液中的Cu2+而增强吸附作用. 本文用针管滴注方式制备大粒径SDBS改性海藻酸钠磁球, 对磁球吸附Cu2+的影响因素进行研究, 寻找最佳吸附条件, 并研究其吸附动力学与吸附热力学特征.
1 实 验
1.1 主要仪器与试剂
1.1.1 主要仪器 SCIENTZ-18N型冷冻干燥剂机(宁波新芝生物科技股份有限公司); TENSOR37型Fourier红外光谱仪(德国布鲁克光谱仪器公司); JAM-6610型扫描电子显微镜(日本东京电子); TGA4000型热重分析仪(美国珀金埃尔默企业管理(上海)有限公司); TAS-990型原子吸收分光光度计(北京普析通用仪器有限责任公司).
1.1.2 主要试剂 FeCl2·3H2O, FeCl3·6H2O, 无水CaCl2, NaOH, 十二烷基苯磺酸钠(SDBS), 海藻酸钠(SA), CuSO4·5H2O, 铜标准溶液(1 000 μg/mL). 其中, NaOH为试剂纯, 其他试剂均为国产分析纯试剂; 实验用水均为去离子水.
1.2 改性磁球的制备
改性磁球制备过程如图1所示. 先制备Fe3O4磁流体, 再制备改性海藻酸钠磁球.
1)将0.18 g Fe2+与0.27 g Fe3+加60 mL水溶解后滴加NaOH溶液, 磁分离, 用去离子水洗涤至中性, 得到Fe3O4磁流体;
2)取1.0 g SA与0.15 g SDBS, 加适量去离子水溶解后加入3.4 g磁流体, 搅拌30 min, 用针管滴加到含质量分数为3%的 CaCl2交联剂中, 由于同等体积下球体的表面张力最小, 因此混合物呈球体滴落(直径约为2~3 mm). 陈化12 h, 冷冻干燥, 可得SDBS改性海藻酸钠磁球(简称改性磁球).
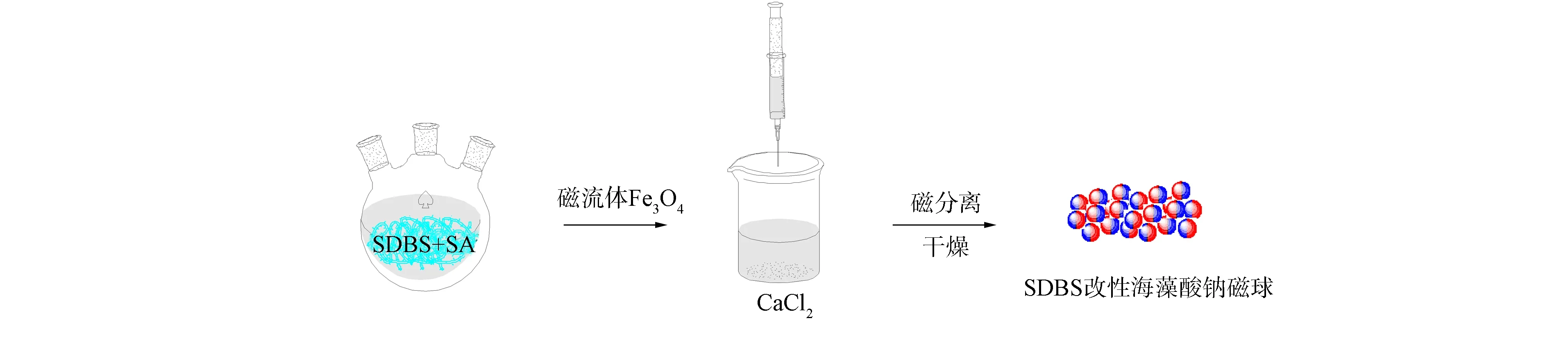
图1 磁球的制备过程示意图Fig.1 Schematic diagram of preparation process of magnetic sphere
1.3 改性磁球对Cu2+的静态吸附实验
实验采用静态吸附法, 在250 mL的碘量瓶中加入一定量的磁球和100 mL硫酸铜水溶液, 振荡吸附后磁分离, 取上清液, 用原子吸收分光光度计测量溶液中Cu2+的质量浓度. 研究吸附时间、 吸附初始质量浓度、 溶液pH值和磁球再生对吸附量的影响, 进一步对磁球进行吸附动力学和吸附热力学分析, 并在实验研究基础上对磁球吸附进行理论模拟.
吸附量计算公式为
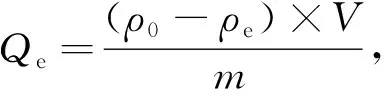
(1)
式中:ρ0为吸附前溶液中Cu2+的初始质量浓度(mg/L);ρe为吸附后溶液中Cu2+的质量浓度(mg/L);V为吸附溶液体积(L);m为吸附剂质量(g).
1.4 改性磁球表征方法
用溴化钾压片法对原料和产品磁球进行红外谱(FT-IR)分析; 将样品固定在导电胶上喷金处理后, 用扫描电子显微镜(SEM)观察磁球吸附Cu2+前后的表面形貌和元素组成; 用TGA4000型热重分析仪测定磁球吸附Cu2+前后的热分解特征曲线(TGA).
2 结果与讨论
2.1 吸附规律分析
2.1.1 吸附时间的影响 在室温条件下, 溶液质量浓度为100 mg/L, 研究吸附时间对吸附量的影响, 结果如图2所示. 由图2可见, 吸附作用主要发生在0~80 min, 在前80 min吸附量迅速上升, 80 min 后吸附达到平衡, 因此80 min 为最佳吸附时间, 平衡吸附量为116.6 mg/g.
由于吸附剂表面存在一定自由羧基、 磺酸基及钙离子螯合羧基等活性位点, 带正电的Cu2+可与自由羧基及磺酸基阴离子产生强烈静电引力, Cu2+还可置换交联海藻酸钠中的Ca2+, 因此Cu2+被迅速吸附, 在80 min前吸附量呈迅速上升趋势. 随着吸附时间的增加, 材料的活性位点逐渐趋于饱和, 在80 min吸附达到平衡.
2.1.2 Cu2+初始质量浓度对吸附量的影响 在室温条件下, 吸附时间为80 min, 吸附液质量浓度对吸附量的影响如图3 所示. 由图3可见: 在质量浓度为25~100 mg/L阶段, 随着溶液中Cu2+质量浓度的增加, Cu2+与吸附剂表面接触机会大幅度增加, 吸附剂表面活性位点得到充分利用, 受浓度梯度的驱动, 传质阻力减小, 有利于吸附进行, 吸附量呈线性上升; 当ρ(Cu2+)=100 mg/L时, 吸附趋于饱和, 继续增大Cu2+的质量浓度, 活性位点数相对降低, 吸附量不再发生变化, 磁球对Cu2+的吸附达到饱和状态. 在相同条件下, 未改性的磁球吸附量明显低于改性磁球吸附量. 当ρ(Cu2+)=100 mg/L时, 改性后的磁球饱和吸附量为116.6 mg/g, 未改性的磁球饱和吸附量为91.6 mg/g. 实验所用改性剂SDBS为阴离子表面活性剂, 在水中解离成磺酸根阴离子, 与Cu2+间存在一定静电吸引作用; 苯环与Cu2+间也存在一定的电子由苯环向Cu2+转移的阳离子-π键成键作用, 在一定程度上增强了磁球对Cu2+的吸附, 因此加入磺酸盐改性后的磁球有更好的吸附作用.
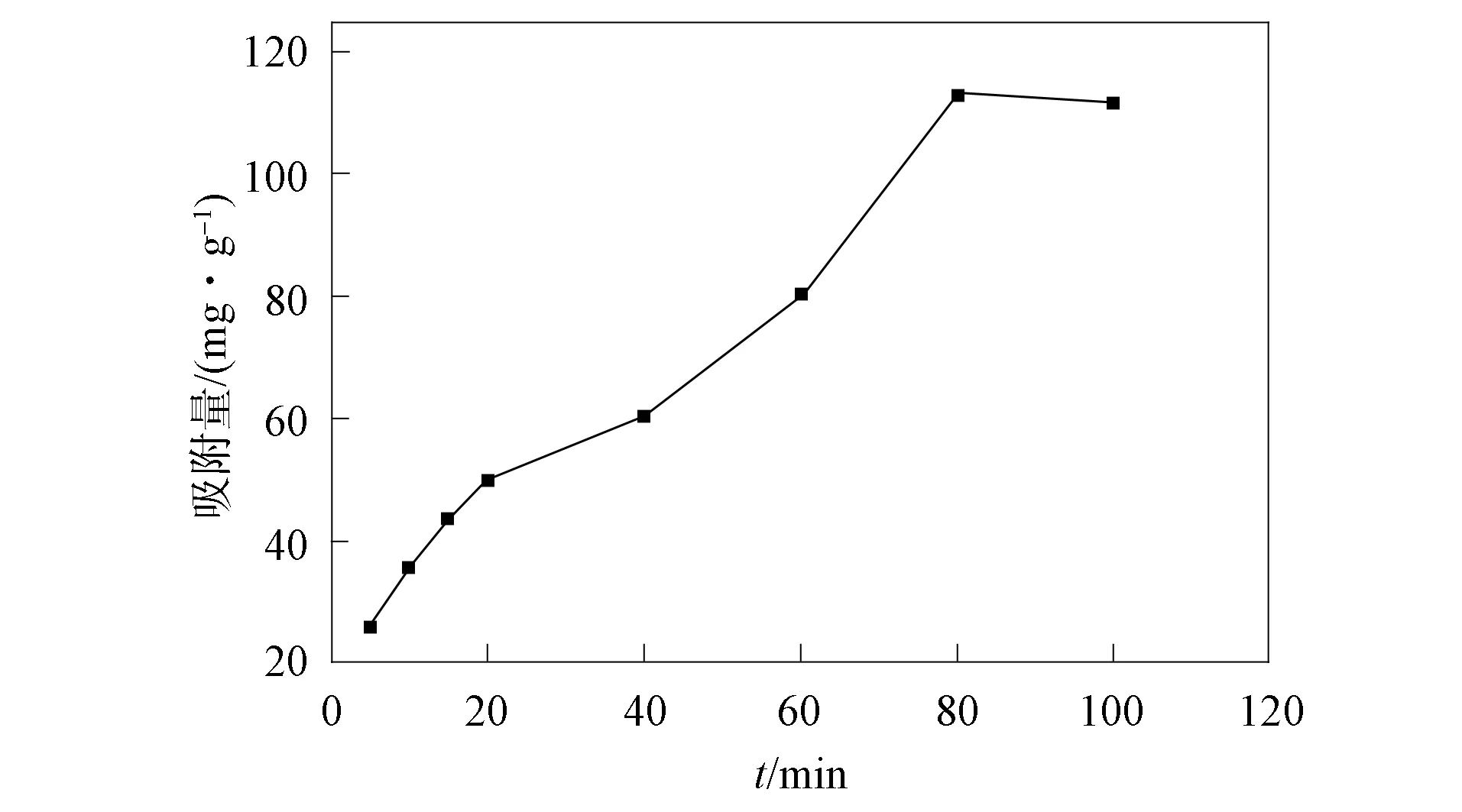
图2 吸附时间对吸附量的影响Fig.2 Effect of adsorption time on adsorption capacity

图3 Cu2+初始质量浓度对吸附量的影响Fig.3 Effect of initial mass concentration of Cu2+ on adsorption capacity
2.1.3 pH值对吸附量的影响 在室温条件下, 吸附时间80 min,ρ(Cu2+)=100 mg/L时, 研究pH值对吸附的影响, 结果如图4所示. 当pH>5时, Cu2+会发生水解, 因此实验最高pH=5. 由图4可见: 当pH=2~5 时, 吸附量呈先增大后略减小趋势; pH=4时, 吸附量最高达116.6 mg/L, pH=5 时, 吸附量减小至111.5 mg/g, 因此pH=4 为最佳吸附条件. 主要原因是磁球吸附Cu2+存在较强的离子交换作用, 即配位能力更强的Cu2+取代Ca2+, 与海藻酸钠羧基活性位点发生更强的配位作用. 当pH值较小时, 溶液中H+浓度较高, 与Cu2+存在竞争吸附, 在一定程度上阻碍了磁球活性位点对Cu2+的吸附作用, 因此pH值较小时的吸附效果较差. 当pH=4 时, H+浓度下降, 与Cu2+的竞争作用减弱, 导致Cu2+更易接触到吸附剂表面的活性位点, 从而吸附量增加. 继续增大pH值, 水中的羟基易和Cu2+发生配合, Cu2+存在状态发生变化导致吸附量略有下降.
2.1.4 吸附动力学 用动力学模拟研究吸附速率与吸附时间的关系. Lagergren准一级动力学与准二级动力学表达式分别为

图4 pH值对吸附量的影响Fig.4 Effect of pH values on adsorption capacity

(3)
式中:t为吸附时间(h);Qt为t时间的吸附容量(mg/g);Qe为平衡吸附量(mg/g).
Lagergren准一级动力学与Lagergren准二级动力学的拟合曲线如图5所示. 由图5可见, Lagergren准二级的拟合线性相关系数(R2=0.900 7)高于准一级的相关系数(R2=0.856 3), 准一级动力学的平衡吸附量为152.2 mg/g, 由于准二级动力学的平衡吸附量为145.6 mg/g, 与实验平衡吸附量更接近, 因此准二级动力学模型更适合描述该吸附过程. 该过程以化学吸附为主, 吸附过程的主要推动力为海藻酸钙与Cu2+的离子交换.

图5 Lagergren准一级动力学(A)与Lagergren准二级动力学(B)的拟合曲线Fig.5 Fitting curves of Lagergren quasi first-order dynamics (A) and quasi second-order dynamics (B)
2.1.5 吸附等温线的绘制 用Langmuir和Freundlich吸附等温模型分别对数据进行线性拟合, 通过拟合数据结果分析其吸附原理. Langmuir和Freundlich吸附等温表达式分别为

(4)
(5)
式中:ρe为平衡质量浓度(mg/L);Qe为平衡吸附量(mg/g);Qm为饱和吸附量(mg/g);KL为Langmuir吸附平衡常数(L·mg);KF为吸附剂吸附能力(mg·g);n为吸附剂对Cu2+的亲和力.
Langmuir与Freundlich的吸附等温拟合曲线如图6所示. 由图6可见, Langmuri大于Freundlich的线性拟合相关系数R2, 拟合得到的理论最大吸附量(135.0 mg/g)与实验测定值较接近, 且Freundlich吸附等温式的拟合系数n=3.370 4, 表明Langmuir模型可更好地描述Cu2+在磁球上的吸附行为, 磁球对Cu2+主要为单分子层吸附.
2.2 改性磁球吸附作用理论模拟
选择主要吸附作用结构单元海藻酸钠阴离子, 以H饱和端基, 研究该结构单元与Ca2+和Cu2+的配位特点, 如图7所示. 在B3LYP[25-26]水平上优化结构, 非金属采用6-31G**基组, 金属采用赝势LANL2DZ基组, 所有计算均由GAUSSIAN03[27]程序完成, 几何结构经频率分析证明是稳定结构.
计算结果表明, Ca2+和Cu2+均与海藻酸钠螯合成键, Ca2+交联海藻酸钠主要与海藻酸钠相邻羧基氧及临近环醚氧成键, 稳定化能为1 931.7 kJ/mol, Cu2+交联的海藻酸钠分别与其中一个羧基氧双齿成键, 与另一个羧基氧及临近环醚氧分别单齿成键. 由于羧基氧带负电荷, 与带正电的Cu2+存在更强的静电引力, 因此Cu2+交联的海藻酸钠稳定化能更高(2 764.9 kJ/mol), 远高于Ca2+的稳定化能(约827.8 kJ/mol), 从而可判断Cu2+的成键能力更强, 在吸附过程中极易与Ca2+发生离子交换, 该特点与能谱分析结论一致.
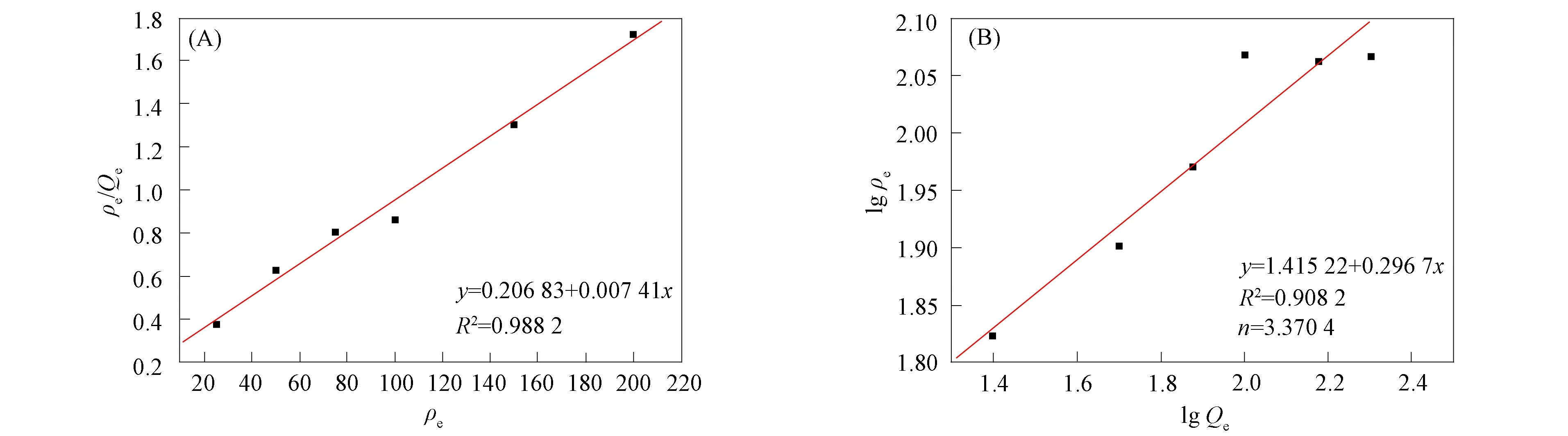
图6 Langmuir(A)与Freundlich(B)的吸附等温拟合曲线Fig.6 Adsorption isothermal fitting curves of Langmuir (A) and Freundlich (B)

图7 Ca2+和Cu2+交联SA结构示意图Fig.7 Schematic diagram of structure of SA crosslinked by Ca2+ and Cu2+
2.3 磁性材料的表征

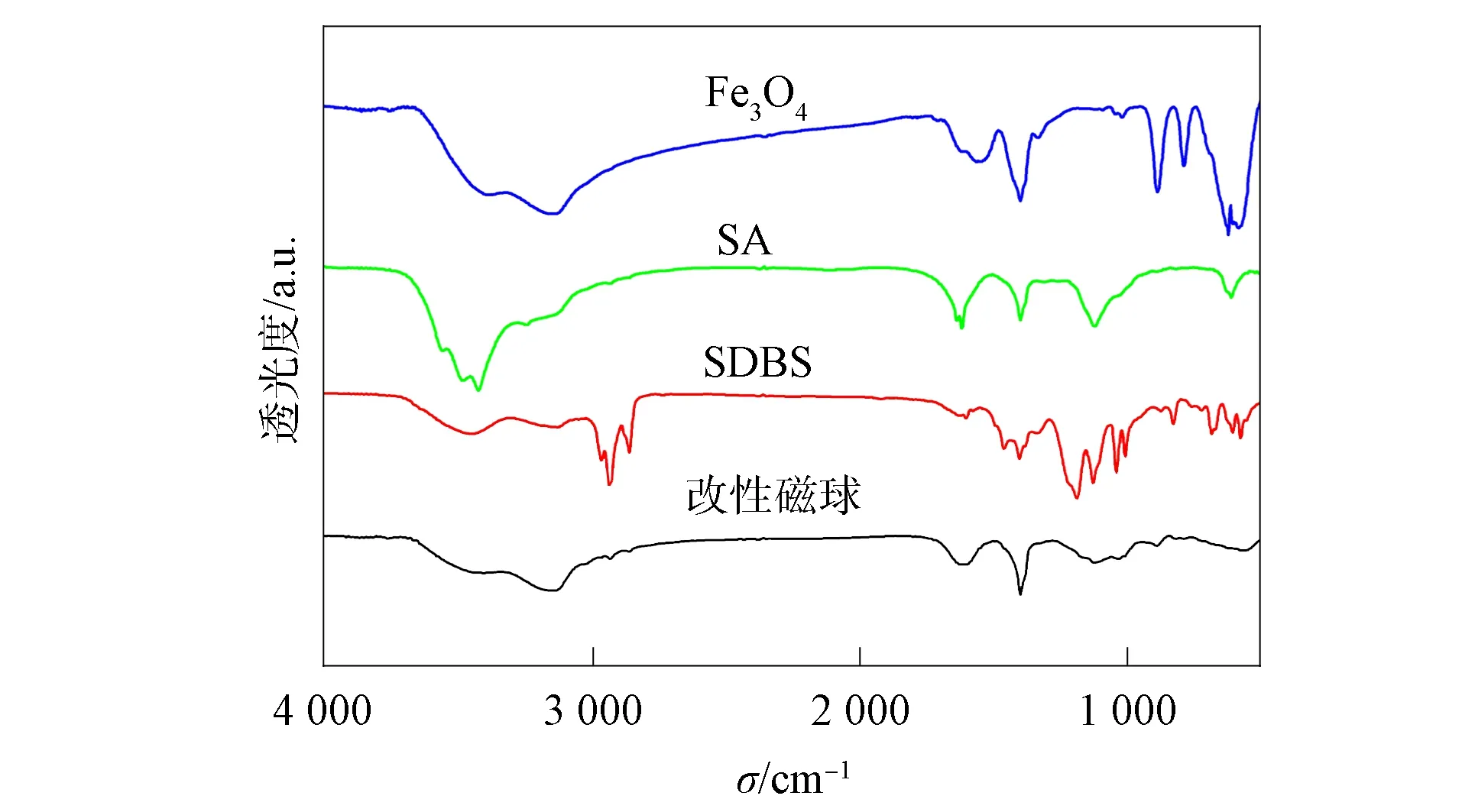
图8 样品的红外光谱Fig.8 Infrared spectra of samples
将适量改性磁球分散于样品瓶中, 磁铁置于样品瓶侧面, 在5 s内磁球全部被磁铁吸到一侧, 悬浊液变清澈, 表明改性磁球有较好的磁性.
2.3.2 改性磁球吸附Cu2+前后的SEM形貌分析 用扫描电镜(SEM)观察改性SA磁球吸附Cu2+前后的形貌, 图9(A), (B)分别为吸附前后放大300倍后的微球结构. 由图9 可见, 吸附前磁球表面凹凸不平, 吸附Cu2+后表面变得较光滑, 这是由于成键作用导致交联Ca2+被Cu2+置换, 且静电作用使部分被吸附的Cu2+覆盖在磁球表面所致.
2.3.3 改性磁球吸附Cu2+前后的能谱分析 图10为改性磁球吸附Cu2+前后的能谱分析(EDS). 由图10(A)可见: 吸附前磁球含有大量Ca2+, 表明CaCl2在磁球的制备过程中有重要的交联作用; 磁球还含有少量的Na+, 主要来自未交联的海藻酸钠残基和SDBS. 由图10(B)可见, 吸附后磁球中Cu2+的质量分数迅速增加, Ca2+的质量分数相应降低, 这是由于Ca2+与Cu2+产生离子交换所致, Na+完全被能产生更强静电作用的Cu2+取代.

图9 改性磁球吸附Cu2+前(A)和吸附Cu2+后(B)的SEM照片Fig.9 SEM images before Cu2+ adsorption (A) and after Cu2+ adsorption (B) by modified magnetic sphere

图10 改性磁球吸附Cu2+前(A)和吸附Cu2+后(B)的EDSFig.10 EDS before Cu2+ adsorption (A) and after Cu2+ adsorption (B) by modified magnetic sphere
2.3.4 改性磁球吸附Cu2+前后的TGA分析 图11为改性磁球吸附Cu2+前后的TGA曲线. 由图11(A)可见, 有3个阶段存在质量损失: 第一个阶段在30~205 ℃为脱去水和结合水的过程; 第二个阶段在205~369 ℃为SA分解过程, 当温度约为380 ℃时, SA分解为中间产物并进一步裂解且部分碳化; 第三阶段在380~535 ℃, 磁球中海藻酸钠完全分解为CaO, 因此剩余质量主要为CaO和Fe3O4. 由图11(B)可见, 吸附后的改性磁球有3个阶段存在质量损失: 第一个阶段在30~194 ℃为脱去水和结合水的过程; 第二个阶段在194~370 ℃为Cu2+交联海藻酸钠分解过程, 当温度约为370 ℃时, 交联海藻酸钠分解为中间产物并进一步裂解且部分碳化; 第三阶段在370~480 ℃, 中间产物氧化分解为CuO, 因此剩余质量主要为CuO和Fe3O4.
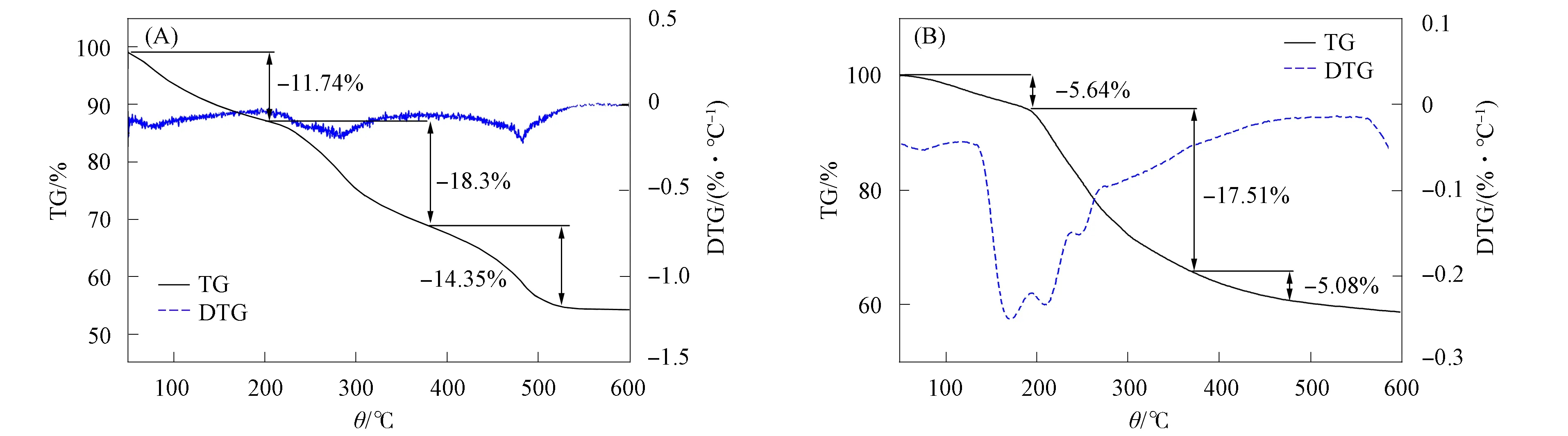
图11 改性磁球吸附Cu2+前(A)和吸附Cu2+后(B)的TGA曲线Fig.11 TGA curves before Cu2+ adsorption (A) and after Cu2+ adsorption (B) by modified magnetic sphere
综上所述, 本文以天然高分子材料海藻酸钠为原料、 CaCl2为交联剂、 Fe3O4为磁性载体、 十二烷基苯磺酸钠为改性剂, 制备了改性磁球吸附材料, 并用FT-IR,TGA,EDS 和 SEM 对改性磁球进行表征分析, 并测试其对Cu2+的吸附性能. 结果表明: 改性磁球可较快地吸附水体中的Cu2+, 最大吸附量为116.6 mg/g; 吸附动力学符合Lagergren模型, 吸附等温线符合Langmuir模型, 为单分子层吸附; 理论模拟在一定程度上揭示了磁球对Cu2+较高吸附性的内在原因, 通过实验研究和理论模拟推测磁球吸附过程中存在静电吸附和离子交换吸附.

