兔microRNA-18b生物信息学分析及其与CDK19的靶向验证
李 泽, 江钧益,王淑辉,孙秀柱, 魏泽辉*
(1.西北农林科技大学 动物科技学院,陕西 杨凌 712100;2.西北农林科技大学 草业与草原学院,陕西 杨凌 712100)
雌性哺乳动物的生育能力与卵巢卵泡的生长发育和闭锁紧密相关。而颗粒细胞(Granulosa cells, GCs)作为卵泡的重要组成,主要负责类固醇激素和调节因子的合成并为卵母细胞生长提供营养等[1-2]。因此,颗粒细胞的增殖,分化和凋亡是卵泡发育过程中的关键事件[3]。在哺乳动物的卵巢中,其生理调控过程涉及到多种细胞因子和信号通路。尤其是,卵泡的形成和闭锁过程受到一系列自分泌和旁分泌因子的调控[5-6]。microRNA(miRNA)作为一种短的非编码RNA,通过影响相关基因的转录和翻译广泛参与卵泡的发育、成熟以及卵巢激素合成和分泌等多种生物学过程,维持卵巢的正常生长发育及其功能的发挥。在正常细胞中,miRNA维持着关键细胞过程的平衡,包括细胞增殖、分化和凋亡。同时,miRNA的异常表达与多种疾病的进展有关[7]。据报道,miR-18b与乳腺癌有关[8],且循环系统中的miR-18b的升高可作为乳腺癌的潜在标志物[9]。另外,多囊卵巢综合征(Polycystic ovarian syndrome,PCOS)患者血清中miR-18b的表达增加[10]。而miR-18b在先兆子痫(Preeclampsia,PE)胎盘中表现出病理性低表达水平[11]。越来越多的证据表明,miR-18b在包括生殖系统疾病在内的人类疾病的发展中起着重要作用。但是,miR-18b的生物学作用及其可能的分子机制尚不清楚。
本研究以兔卵巢颗粒细胞为对象,主要通过生物信息学方法对miR-18b进行功能预测分析,并进一步通过双荧光素酶报告基因活性检测来验证miR-18b对CDK19(Cyclin dependent kinase 19)基因的靶向关系,为进一步研究miR-18b在卵巢卵泡发育中的作用提供分子基础。
1 材料与方法
1.1 生物信息学分析
利用生物信息学技术预测 ocu-miR-18b 的靶基因及其可能参与的生物学过程。首先,通过 miRbase 数据库获取兔、人、小鼠、大鼠、猕猴、负鼠和仓鼠七个物种的miR-18b成熟序列,并分析物种间保守性。然后,应用 miRWalk、miRanda、ENCORI 三种软件对 ocu-miR-18b 进行靶基因预测并取交集得到文氏图。接下来通过David Bioinformatic resources 6.8 在线软件进行功能注释(GO分析) 和 pathway信号通路富集分析,以P<0.05为显著性阈值,得到GO类别上的高频率注释及有统计学意义的信号通路。P值越小代表富集性越显著。利用R软件制作数据可视化散点图。
1.2 组织和细胞
成年健康母兔的卵巢组织来自陕西省咸阳市杨凌区某兔场,将新鲜摘除的卵巢置于含双抗的生理盐水中,并于3 h内送至实验室;HEK293T 细胞来自本实验室。
1.3 兔颗粒细胞的分离培养及细胞转染
将成年兔卵巢浸泡在37 ℃预热的含1%青霉素-链霉素的生理盐水中。去除卵巢周围的脂肪组织后,用针刺破卵泡,使卵泡液流出,将细胞收集在含有10%FBS,1%青霉素-链霉素的DMEM/F12培养基中,在37 ℃的5%CO2的培养箱中孵育24 h。
取出用新培养基清洗两次,以去除血液和未附着的细胞。将兔颗粒细胞以每孔3×105个细胞的量接种在6孔细胞板上。当细胞达到大约70%汇合度时,使用脂质体2000 (LipofectamineTM2000) (Thermo Fisher),分别用50 nM miR-18b模拟物 (Mimics),50 nM模拟阴性对照物 (Mimic negative control, mimcs NC),100 nM miR-18b抑制剂 (Inhibitor) 或100nM抑制剂阴性对照 (Inhibitor negative control, NC) 进行转染。
1.4 RNA提取,反转录及实时荧光定量PCR
使用Trizol (Life Technologies) 从颗粒细胞中分离总RNA。用NanoDrop 2000(Thermo)测定总RNA的浓度。根据miRNA cDNA合成试剂盒说明书,对每个样品中的1 μg RNA进行定量的特异性逆转录(Takara,日本)。使用SYBR Premix Ex TaqTMII(中国南京,Vazyme)进行实时定量PCR,分别检测mRNA和miRNA的表达。表1列出了所使用的基因特异性引物。用于检测mRNA的PCR循环条件为:在95 ℃下30s,60 ℃ 30s和72 ℃ 30s的40个循环。用于miRNA检测的PCR循环条件是:在95 ℃下持续15s,在60 ℃下持续1min的40个循环。使用相对标准曲线法(分别以β-actin和U6 snRNA作为内源参照)定量mRNA和miRNA的相对表达。
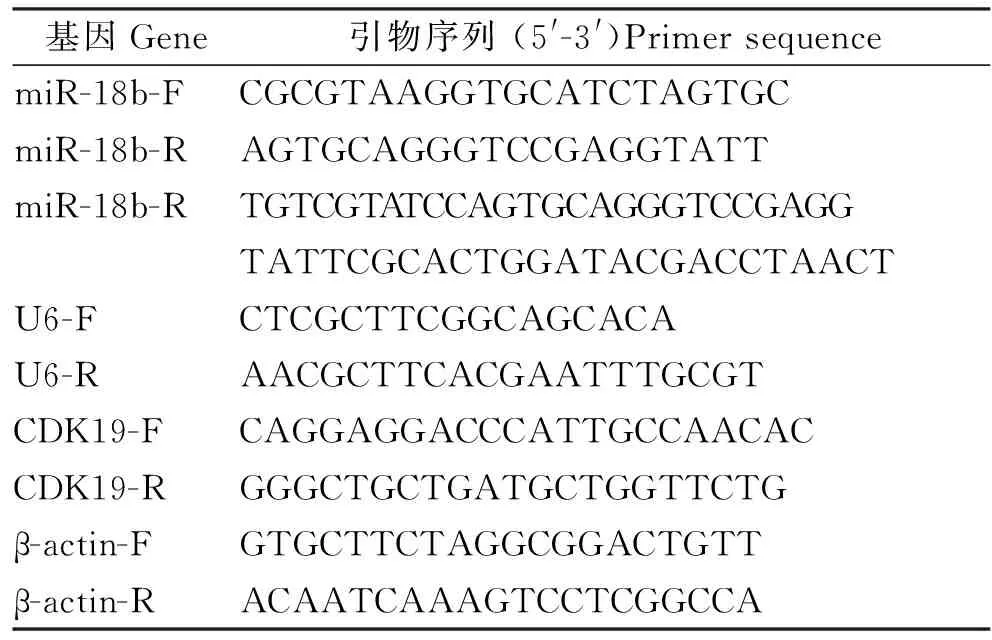
表1 荧光定量 PCR 引物Table 1 Summary of specific primers for Real-time PCR
1.5 双荧光素酶活性检测
根据GenBank中的兔CDK19 3'UTR序列设计并合成了具有推测的miR-18b结合位点的退火寡核苷酸对。将双链产物插入荧光素酶基因下游的pmiR-RB-REPORT TM双荧光素酶报告载体 ( Ribobio,中国广州) 。使用12孔板中培养的HEK293T细胞,用测序鉴定后的3' UTR野生型(WT)或CDK19 3' UTR突变型(对种子序列中的6个碱基进行点突变)(Mut)报告质粒分别与miR-18b mimics或mimics NC共转染细胞24 h。参照Dual-Luciferase reporter assay system试剂盒(Promega公司)的说明书步骤进行操作,并使用酶标仪(Bio Rad生物工程有限公司)进行荧光素酶活性的测定。
1.6 数据分析
使用 GraphPad Prism 7 ( GraphPad Software Inc, San Diego, CA) 进行统计学分析。两组间比较用t检验。所有结果表示为平均值±标准误。P<0.05被认为具有统计学意义,以P<0.01为差异极显著。
2 结果与分析
2.1 生物信息学分析
2.1.1 保守性分析 miRBase数据库中下载的人、小鼠、大鼠、猕猴、负鼠和仓鼠的miR-18b成熟序列与兔miR-18b序列进行比对分析,发现miR-18b的成熟序列在各物种间高度保守(表2)。

表2 不同物种miR-18b成熟序列Table 2 Mature sequences of mir-18b in different species
2.1.2 靶基因预测 用miRWalk、ENCORI、miRanda 分别预测到 2398、2826、7306个miR-18b的靶基因,取三者的交集,获得 332个靶基因(图 1)。
2.1.3 靶基因预测GO分析 针对332个靶基因进行GO(Gene Ontology)注释分类和富集分析。结果发现,miR-18b的预测靶基因在生物学过程(Biological process, BP)层面上显著富集在细胞增殖的负调控、BMP信号通路的正调控、髓鞘形成、神经管形成、神经肌肉接头发育、原肠(胚)形成的调节和外在凋亡信号通路的负调控等条目中(P<0.05);在分子功能(Molecular Function, MF)层面,靶基因显著富集在泛素蛋白连接酶、受体信号蛋白丝氨酸/苏氨酸激酶、ATP酶活性、转录激活子等的活性调控,和RNA聚合酶II核心启动子近端区域序列特异性结合等条目中(P<0.05);在细胞成分(Cell Component, CC)层面,靶基因主要富集在肌动蛋白丝、核质、粘着斑、高尔基体、膜的外在成分、髓鞘等条目中(P<0.05)(图2)。
2.1.4 miR-18b靶基因集合的KEGG通路分析 KEGG分析结果显示,miR-18b 的靶基因集合显著富集于胞吞作用、调节干细胞多能性、癌症中的MicroRNA、癌症的途径、胰腺癌、TGF-β、内质网中的蛋白质加工、膀胱癌和PI3K-Akt等信号通路(P<0.05)(图 3)。这些信号通路在细胞增殖和凋亡中发挥着重要的调控作用。
2.2 miR-18b特异性结合CDK19
由于miR-18b预测的靶基因显著富集于细胞增殖的负调控,BMP信号通路的正调控及致癌作用等信号通路,因此我们推测miR-18b可能在细胞增殖、分化和凋亡过程中发挥着重要的调控作用。所以推断CDK19是miR-18b的重要靶基因,影响着颗粒细胞的增殖和凋亡,并在兔卵巢颗粒细胞中进一步验证二者的靶向关系。
首先进行野生型(wt)和突变型(mt)载体的构建,然后将两组质粒载体分别与 miR-18b的mimics或mimics NC共转染至HEK293T细胞,检测双荧光素酶活性。结果显示,wt+mimics组与wt+mimics NC组的双荧光素酶活性相比显著降低,而mt组的活性无显著差异。证明miR-18b与CDK19 3' UTR有直接靶向关系。然后,在兔卵巢颗粒细胞中,分别转染 miR-18b的mimics,mimics NC,inhibitor及inhibitor NC后,利用qRT-PCR检测 miR-18b 的瞬时转染效率,结果显示,miR-18b的超表达效率及抑制效率,差异有统计学意义(P<0.05,图4C)。再利用qRT-PCR检测CDK19在兔卵巢颗粒细胞中的表达模式,发现miR-18b与CDK19表达模式恰好相反(P<0.05,图4D)。最终结果表明,CDK19是miR-18b的靶基因。
3 讨 论
对雌性动物而言,卵巢是卵母细胞生长发育和排卵的重要场所。从原始卵泡生长启动、增殖、分化、闭锁/排卵到黄体形成,颗粒细胞在形态、功能等方面都发生各种变化。卵巢颗粒细胞状态(凋亡或增殖)决定卵泡发育的命运(闭锁或排卵)[12-13]。而miRNA-18b,作为卵巢卵泡发育的主要调节因子,在颗粒细胞凋亡(卵泡闭锁)中发挥重要作用[9-10]。近年来,miRNAs的失调被认为与许多疾病存在互为因果的关系。在疾病的早期它可以提供一些有价值的信息以预防疾病传播及进行疾病诊断[14]。通过生物信息学分析预测miRNA 的靶基因,与已经实验验证的靶基因集进行生物功能富集分析和信号通路富集分析,可为进一步研究 miRNA 提供引导方向。
本研究发现,miR-18b预测到的靶基因富集在抑制细胞凋亡的信号通路,此外还包括TGF-β(转化生长因子,transforming growth factor-β)超家族中的BMP(骨形态发生蛋白,bone morphogenetic protein)信号通路的正调控等生物学过程;调控基因转录,蛋白质降解等分子功能;TGF-β,PI3K-Akt(磷脂酰肌醇3激酶/蛋白激酶B,phosphatidylinositol 3 kinase (PI3K) / protein kinase B (AKT))等信号通路。总之,miR-18b可能对细胞周期调控,抑制细胞增殖更新,促进细胞凋亡等过程具有重要的作用[15-18]。其中,关键靶基因CDK19,具有复杂的转录调节功能,并且对细胞的增殖凋亡起到调节作用,并且与癌症发生息息相关。例如,CDK19在前列腺癌中特异性表达,且与癌细胞的侵袭性有关[19]。并且CDK19能维持前列腺癌细胞G1/S的正常转化,促进了肿瘤细胞的增殖[20]。Nitulescu等[21]证明,CDK19能促进急性髓系白血病细胞的增殖和分化。通过实验研究,CDK19的抑制剂对抑制白血病细胞增殖、肿瘤侵袭、转移性或肿瘤对抗癌药物的反应具有潜在的良性作用[22]。更为重要的是,McDermott等[23]发现,抑制或敲除CDK19能够抑制雌激素诱导的雌激素受体阳性乳腺癌细胞的转录;这种效应在雌激素受体的下游发挥作用。Porter等[24]分析表明,CDK19在乳腺癌和卵巢癌中的高度表达与不良的预后状况密切相关。CDK19可能与卵巢的发育和卵泡生长密切相关。
miRNA可以作为CDK19重要的调节因子,参与体内的生理代谢活动。如在胰腺祖细胞中,miR-18a靶向CDK19抑制其表达,从而抑制胰腺祖细胞的增殖[25];在骨髓间充质干细胞中,CDK19的表达可被miR-18a-5p,miR-383等负调控[26]。在肾细胞癌中,过表达miR-15可显著降低CDK 19的表达水平[27]。本研究中,过表达miR-18b后,兔卵巢颗粒细胞中CDK19的表达受到了显著抑制,但关于其具体的调控作用及机制仍需进一步探索。
总之,miR-18b预测的靶基因富集的数据突出了miR-18b在抑制细胞增殖和促进细胞凋亡中的潜在作用。并进一步通过双荧光素酶报告试验验证了CDK19和ocu-miR-18b的靶向关系;在兔卵巢颗粒细胞中,发现miR-18b与CDK19表达模式恰好相反,证实了其作用方式。在后续研究中,以确证miR-18b对卵巢颗粒细胞增殖和凋亡的调控作用,这将进一步扩展miR-18b的分子机制,这对进一步了解卵巢颗粒细胞miRNA对卵泡发育的分子调控机制,提高畜牧生产的经济效益具有重要意义。

