肝动脉化疗栓塞术介入治疗联合阿帕替尼对原发性肝癌患者疗效及对visfatin、prohibitin的影响
许春生,马翠真,房巨波*
(1. 山东省单县东大医院肝胆外科,山东 单县;2. 山东省单县东大医院普外科,山东 单县)
0 引言
原发性肝癌是我国常见恶性肿瘤之一,每年全球约有60万新发病例,其死亡率仅次于胃癌和食管癌[1]。由于肝癌的起病隐匿,多数患者确诊时已处于肝癌中晚期,错过外科手术时机,生存期较短[2]。目前,对于无法进行手术的患者,肝动脉化疗栓塞术(transcatheter arterial chemoembolization, TACE)是临床上首选的治疗手段,其近期治疗有效率可高达70%,但仍存在较高的复发率[3]。研究发现[4],TACE的一方面通过抑制肿瘤病灶内新生血管的形成而起效,但另一方面对周围正常的肝脏组织供血也有一定影响,当出现组织缺氧的情况下,体内血管内皮生长因子(VEGF)表达增加,促使残存的肿瘤细胞进一步发生扩散和转移,影响肝癌患者预后。因此国内大量研究指出[5],TACE术后联合使用抗新生血管形成药物可有效提高治疗效果,减少疾病的复发。阿帕替尼是一种新型的抗新生血管生成的药物,可靶向抑制VEGFR-2,具有广谱抗肿瘤作用,有效抑制肿瘤细胞的增殖分化。研究表明[6-7],血清内脂素(visfatin)与抑制素(prohibitin,PHB)水平均与原发性肝癌的发生、发展密切相关。本研究通过观察TACE治疗联合阿帕替尼对原发性肝癌患者临床疗效以及对血清visfatin、PHB的影响,以期为该病的临床治疗提供参考,现报道如下。
1 资料和方法
1.1 一般资料
选取2016年1月至2017年1月山东省单县东大医院收治的80例原发性肝癌患者,根据随机数字表法分为观察组和对照组,每组各40例。其中对照组患者,男23例,女 17例;年龄 38~69岁,平均年龄 (53.8±5.4)岁;肿瘤直径(7.56±2.23)cm;分型:弥漫型 9例,结节 20例,块状型11例,Child分级: A 级 15例,B 级 16例,C 级9例。观察组患者年龄40~71岁,平均年龄(54.7±5.1)岁;肿瘤直径(7.32±2.43)cm;分型:弥漫型8例,结节型19,块状型13例,Child分级:A 级14例,B 级17例,C 级9例。两组的年龄、性别、肿瘤大小、分型、Child分级等一般资料均无显著差异(P>0.05),具有可比性。所有患者均已知情同意,且本研究已经伦理委员会批准。
纳入标准:⑴所有患者经影像学检查、病理检查等确诊均符合原发性肝癌的诊断标准[8];⑵无法手术切除者或切除术后复发者;⑶患者此前均未接受任何放疗和化疗措施,ECOG评分≤2分,预计生存时间大于6个月;⑷所有患者均经影像学检查排除其它部位转移。
排除标准:⑴排除患有精神疾病或存在认知功能障碍;⑵严重心、肝、肾功能损害患者;⑶血常规异常患者;⑷存在其他部位恶性肿瘤;⑸凝血功能异常难以纠正的患者;⑹对本研究药物过敏者。
1.2 治疗方法
对照组:行经导管TACE治疗,具体操作方法如下:患者取仰卧位,局部浸润麻醉铺巾后,采用改良Seldinger法经股动脉穿刺置入导丝,经导丝置入导管后,于X线透视及DSA造影指导下明确肿瘤大小、数量以及供血动脉情况,将导管治愈靶血管处后退出导丝,经导管缓慢注射化疗药物以及栓塞剂,造影药物:吡柔比星(厂家:深圳万乐药业有限公司,国药准字:H10930106)10-20mg+超液态碘化油(厂家:LaboratorieGuerbrt)5-10mL;化疗药物:奥沙利铂(厂家:江苏奥赛康药业股份有限公司,国药准字:H20064296)50-100mg+吡柔比星10-30mg;栓塞剂:碘化油。药物注射完成后退出导管,局部压迫止血,常规采取保肝治疗,同时密切监测心率、血压变化,防止化疗过程中血压异常导致休克。定期随访,密切观察患者的用药反应,若发生不良反应应及时采取治疗措施。根据患者恢复情况可重复进行TACE治疗,间隔时间>1月,共不超过12次。
观察组在TACE治疗基础上给予口服甲磺酸阿帕替尼片(厂家:江苏恒瑞医药股份有限公司,国药准字H20140103),服用方法:从TACE术后第4天开始口服,每次750mg,每日1次,根据患者耐受情况进行调整用量,耐受力差时可逐步调整剂量至500mg、250mg甚至停药。
1.3 观察指标
1.3.1 近期疗效
在治疗后1月、3月、6月、12月进行随访。依据RECIST标准[9]对所有患者治疗效果进行评估。疗效判定标准:(1)完全缓解(complete response,CR):病灶完全消失,增强CT提示无动脉期增强;(2)部分缓解(partial response,PR):病灶直径较前缩小>30%,增强CT提示动脉期病灶直径缩小>30%;(3)进展(progressive disease,PD):病灶直径较前增大20%,或出现新生病灶,增强CT提示动脉期病灶直径增大>20%;(4)稳定(stable disease,SD):病灶较前无明显变化。总有效率=(CR例数+PR例数)/该组例数×100%。
1.3.2 无进展生存时间
无进展生存时间(PFS)是指从开始第1次治疗到患者出现病情进展(PD)或死亡的时间。
1.3.3 血清visfatin和PHB水平
分别于治疗前及治疗后3月清晨对患者行空腹静脉取血操作,血液标本采用离心机离心5分钟,离心条件为3000r/min,取血清进行冷冻保存待检(保存在-70℃条件下),采用ELISA法测定血清visfatin、PHB水平,严格按试剂盒(厂家:联科生物科技有限公司)说明书进行操作检测。
1.3.4 不良反应
密切观察监测患者的治疗过程中病情变化情况,对患者发生不良反应 (如发热、恶心呕吐、骨髓抑制、高血压、腹痛、手足综合征、蛋白尿) 进行观察统计。
1.4 统计学处理
采用SPSS 19.0统计软件对所有数据进行分析, 计数资料以(n,%)的形式表示,采用卡方检验;计量资料以()表示,采用t检验;无进展生存时间采用 Kaplan - Meier 法进行绘图分析,采用 log - rank 检验。P值<0.05为有统计学差异。
2 结果
2.1 临床疗效比较
经治疗后1月及3月,两组患者治疗有效率无明显差异(P>0.05),治疗后6月及12月观察组治疗有效率明显高于对照组,P<0.05,有统计学意义,详见表1。
2.2 无进展生存时间比较
观察组中位PFS为12.6个月,显著长于对照组(6.1个月),χ2=8.618,P=0.0022,有统计学差异。
2.3 两组患者血清visfatin和PHB水平比较
与治疗前相比,两组患者治疗后血清visfatin、PHB水平均显著降低,差异具有统计学意义(P<0.05);且与对照组比较,观察组患者visfatin、PHB水平较低,差异具有统计学意义 (P<0.05)。详见表 2。
2.4 不良反应比较
观察组不良反应发生率较对照组均有所增加,主要表现在高血压、蛋白尿、手足综合征(手掌、足底红肿疼痛或指端红斑)等方面,两组相比有显著差异(P<0.05);两组均未出现重度血小板下降,所有不良反应经对症处理后患者均可耐受,未影响治疗。见表3。
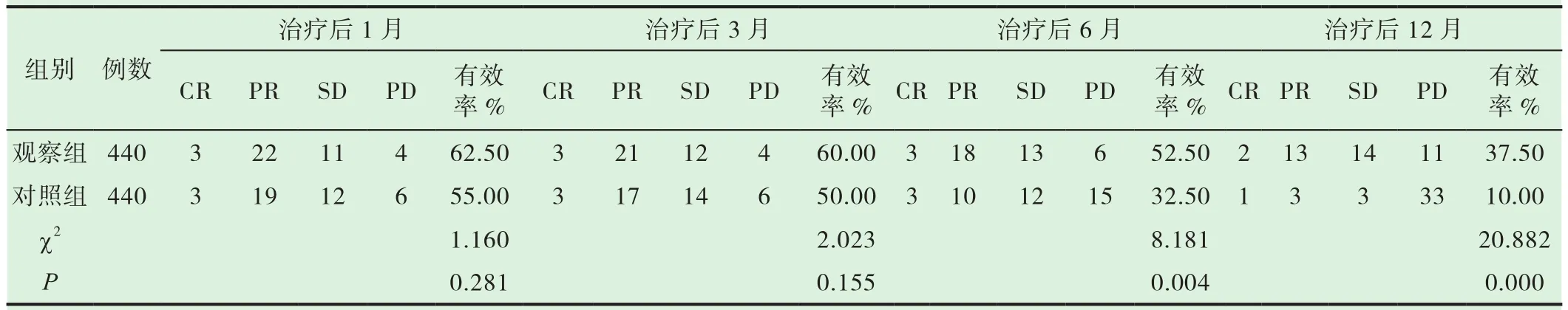
表1 两组患者临床疗效比较[n(%)]
表2 两组患者visfatin、PHB水平比较( )
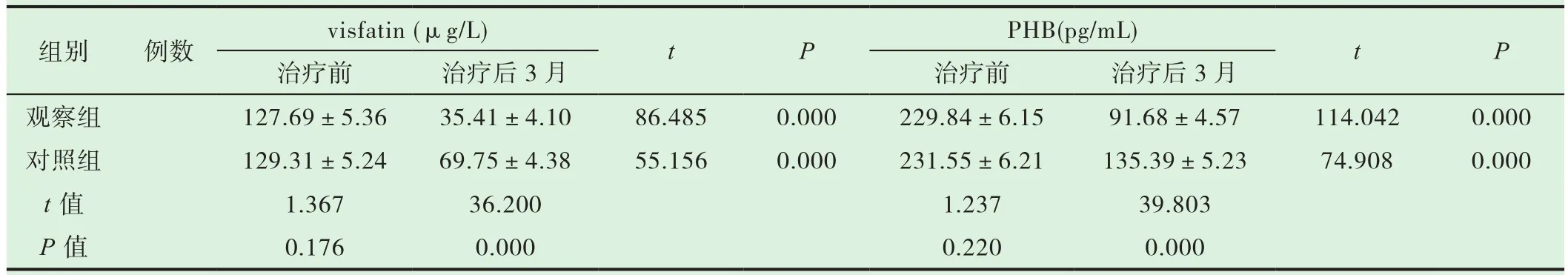
表2 两组患者visfatin、PHB水平比较( )
组别 例数 visfatin (μg/L) t P PHB(pg/mL) t P治疗前 治疗后3月 治疗前 治疗后3月观察组 127.69±5.36 35.41±4.10 86.485 0.000 229.84±6.15 91.68±4.57 114.042 0.000对照组 129.31±5.24 69.75±4.38 55.156 0.000 231.55±6.21 135.39±5.23 74.908 0.000 t值 1.367 36.200 1.237 39.803 P值 0.176 0.000 0.220 0.000
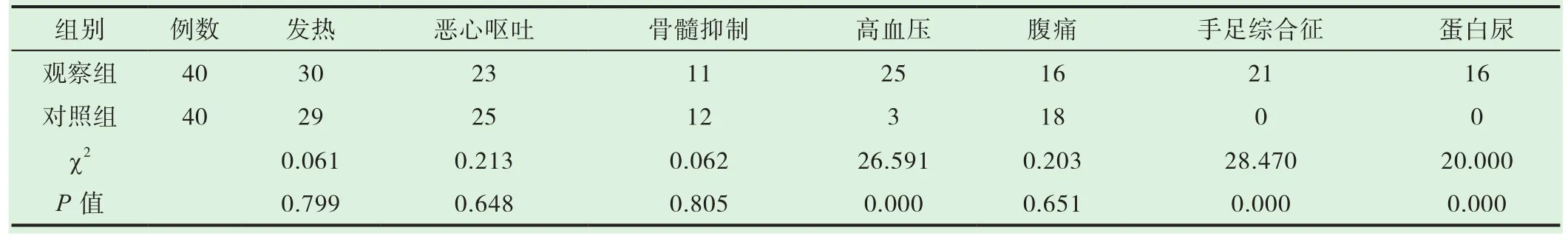
表3 两组患者治疗后不良反应发生率对比[n(%)]
3 讨论
原发性肝癌是常见的恶性肿瘤,其发病率及死亡率均较高,该病早期症状不明显,临床确诊时常伴有多发转移,错过最佳的手术切除时机。研究发现,对于中晚期肝癌患者采取放疗或化疗可明显缩小肿瘤病灶体积,提高临床疗效[10,11]。TACE是常见的化疗手段,可有效抑制肿瘤病灶组织内新生血管形成,阻断肿瘤组织的血供从而起到治疗的效果。但研究发现[12,13],TACE对治疗包膜不完整、病灶较大的肝癌临床效果欠佳。同时,TACE对周围正常的肝脏组织供血也有一定影响,当出现组织缺氧的情况下,体内血管内皮生长因子(VEGF)表达增加,促使残存的肿瘤细胞进一步发生扩散和转移,影响肝癌患者预后。研究发现[14],肿瘤的转移与复发与新生血管的形成密切相关。阿帕替尼是一种VEGFR-2酪氨酸激酶抑制剂,可有效抑制VEGF的表达水平及血管内皮细胞的增殖与迁移能力,从而抑制肿瘤细胞的生长。
本研究采用TACE治疗联合阿帕替尼对原发性肝癌,结果显示:两组患者治疗后1、3个月治疗有效率无明显差异(P>0.05),但观察组治疗后6、12个月治疗有效率显著高于对照组(P<0.05),同时观察组中位PFS明显长于对照组,提示TACE联合阿帕替尼能有效抑制肝癌患者的肿瘤细胞的增殖,延缓病情的发展,提高治疗效果。分析认为:TACE的作用一方面在于注入靶血管的化疗药物具有直接的细胞毒作用,另一方面在于TACE直接阻断了肿瘤组织及周围组织的血供导致细胞缺血、缺氧以及坏死,然而后者代偿性地刺激体内VEGF的活化,促进新生血管的形成,从而使肝癌患者出现复发和转移;而阿帕替尼抑制了VEGFR-2活性,抑制新生血管的形成,阻断了肿瘤细胞的营养供应通路,一定程度上弥补了单纯使用TACE进行治疗的缺陷,提高肝癌患者的治疗效果,延长了患者肿瘤进展时间。Qing等研究证实,阿帕替尼能有效延长肝癌患者肿瘤进展时间[15],与本研究结果相符。
此外,本研究中观察组治疗期间发生的不良反应情况更多,主要表现在高血压、蛋白尿、手足综合征等方面,考虑是与服用阿帕替尼相关,患者多表现为轻中度血压升高,考虑与血管退化导致的外周阻力升高相关,注意监测血压、清淡饮食,常规服用降压药物即可;蛋白尿及手足综合征则是服用阿帕替尼后常见的不良反应,注意定期复查尿常规及肾功能,注意加强皮肤的护理工作,必要时局部可使用抗菌药膏。
近年来,异常表达的组织蛋白研究在肝癌研究中已成为热点问题,PHB是一种细胞膜蛋白,广泛表达于多种肿瘤细胞中,PHB基因的缺失可抑制人肝癌细胞株细胞的增殖,导致细胞凋亡。石娟娟等[16]研究提出,PHB可能参与肝癌的发生和发展过程,PHB水平与肝脏细胞损伤程度、肝癌的恶性程度密切相关。Visfatin是由内脏脂肪分泌的活性因子,广泛存在于消化系统中,可参与糖尿病、高脂血症、肥胖等脂质代谢异常的疾病。研究表明,visfatin与结肠癌、胃癌等多种肿瘤的发病及进展相关,其机制考虑与促进血管生成、胰岛素抵抗以及细胞周期的调控相关[17]。肝癌患者血清内脏脂肪素水平升高与患者营养状态和肿瘤TNM分期相关,高血清内脏脂肪素水平是肝癌死亡的危险因素之一[18]。
本研究中,治疗后两组患者血清visfatin、PHB水平均显著下降,而观察组visfatin、PHB水平明显低于对照组,提示TACE 联合阿帕替尼治疗能够显著提高临床疗效,改善患者预后,下调visfatin、PHB水平。分析原因认为:肝动脉为肝脏转移病灶主要血供来源,TACE将化疗药物直接灌注到相关肿瘤供血肝动脉杀灭肿瘤细胞,同时阻断病灶血供抑制血管增生,促进细胞凋亡,相关因子明显下降;阿帕替尼可抑制血管内皮细胞的再生,抑制新生血管的形成,避免肿瘤细胞的再生,从而降低visfatin水平;此外研究表明,阿帕替尼通过上调P53基因以及caspase-3、8水平对HepG2细胞的增殖和迁移愈合起抑制作用[19],联合两种治疗方法可有效提高增强化疗的疗效,抑制外周血visfatin、PHB水平的表达,抑制肿瘤血管的新生,缩小病灶体积,改善患者的预后。
综上所述,TACE联合阿帕替尼治疗原发性肝癌提高患者中远期临床疗效,下调visfatin、PHB水平,延缓疾病的进展,但仍存在较多的不良反应,总体可耐受。

