有氧运动和白藜芦醇对2型糖尿病大鼠肾脏JAK2及TGF-β1的影响*
孙晓娟,冯武龙,侯 娜,李 娜,姜蔚丽
(咸阳师范学院体育学院,陕西 咸阳 712000)
2型糖尿病肾脏损伤病变的早期主要标志是出现尿微量白蛋白(microalbuminuria, UA)持续升高,病理改变表现为肾小球肥大和基底膜增厚等,晚期主要是肾小球硬化和肾小管间质纤维化,这些是糖尿病患者致残致死的重要原因之一[1-3]。Janus激酶信号转导子2和转录激活子3(janus kinase signal transducers and activators of transcription, JAK/STAT)信号通路是一条重要的信号途径,广泛参与细胞的增殖、分化及凋亡的调控,在糖尿病肾脏的病理损伤过程中发挥着重要作用[4,5]。运动是2型糖尿病常用的辅助疗法,具有抗氧化性、促进葡萄糖吸收、增强胰岛素敏感性和调节糖脂代谢等作用[6]。此外,研究证实白藜芦醇是一种多酚类植物抗毒素,可能通过改善糖脂代谢紊乱、减轻脂质过氧化损伤及抑制氧化应激反应等,在糖尿病防治中发挥作用[7]。但有氧运动和白藜芦醇对糖尿病肾损伤的保护作用是否与JAK/STAT信号通路有关,目前尚不清楚。
本研究采用高糖高脂饲料喂养5周加腹腔注射低剂量STZ的方法诱导建立2型糖尿病大鼠模型,对糖尿病大鼠进行8周有氧运动和白藜芦醇干预,基于JAK/STAT信号通路来探讨有氧运动和白藜芦醇对2型糖尿病大鼠肾脏损伤的影响机制,为糖尿病肾脏病变运动和药物疗法的开展提供实验依据。
1 材料与方法
1.1 实验的设备(仪器)与试剂
光学显微镜( 日本OLYMPUS 公司) ; 冰冻切片机( 德国Leica 公司) ;链脲佐菌素(STZ)(美国Sigma公司);JAK2抗体(1∶100)、TGF-β1抗体(1∶200)(美国Cell signaling公司);PCR引物由生工生物工程上海股份有限公司构建。大鼠尿微量白蛋白ELISA Kit(美国ABR公司);二步法免疫组化检测试剂盒和DAB显色试剂盒(北京中杉金桥生物公司)。
1.2 模型的建立与分组
65只清洁级雄性SD大鼠,6~8周龄,体重140~170 g,由第四军医大学实验动物中心提供[SCXK(军)2007-007],在咸阳师范学院体育学院生理学实验室进行实验操作[SYXK(军)2007-020]。所有动物于实验开始一周前适应新环境,常规分笼饲养,自由饮食,室温20~22℃,相对湿度45%~50%,每日光照时间为12 h。
SD大鼠经基础饲料喂养1周后,随机分成正常对照组 (NC,10只) 和糖尿病造模组(55只)。NC组喂基础饲料,造模组喂以高脂高糖饲料。5周后,造模组单次腹腔注射STZ(35 mg/kg)。注射1周后,检测血糖,随机血糖≥16.7 mmol/L,为暂成模大鼠。1周后复测血糖,随机血糖≥16.7 mmol/L为建模成功。将48只建模成功大鼠随机分为糖尿病安静组(DC组),糖尿病运动组(DE组),糖尿病药物组(DR组)和糖尿病运动药物组(DER组),每组各12只。
1.3 实验方案
运动组大鼠经3 d的跑台适应性训练后,进行8周递增负荷的中等强度有氧运动。第1 周跑速为15 m/min,持续30 min; 第2 周跑速仍然是15 m/min,运动时间延长至60 min; 第3周增加跑速到20 m/min,持续60 min; 第4周开始以20 m/min 恒定速度进行训练。每次运动时间为60 min,每周运动6 d。
依据药理学方法,将白藜芦醇溶于双蒸水中制成(6 mg/ml)悬浊液。灌胃组大鼠按每天45 mg/kg剂量给药,模型安静组和模型运动组施予等体积双蒸水灌胃,均灌胃8周,每周7 d。
8周干预末,代谢笼收集24 h 尿液检测24 h UA。腹腔注射0.4%戊巴比妥钠(1 ml/100 g体重)麻醉大鼠,心脏采血,经左心室插管冷生理盐水充分灌洗肾脏,取新鲜肾皮质,一半放入4%的多聚甲醛溶液中固定,作肾脏HE染色和免疫组化检测; 一半置液氮中速冻,后放置于-80℃冰箱保存,作荧光定量PCR和Western blot检测。
1.4 生化指标检测
血糖、血清肌酐(serum creatinine, Scr)、血尿素氮(blood urea nitrogen, BUN)采用全自动生化分析仪测定。24 h尿蛋白定量采用酶联免疫法(ELISA法)测定,试剂盒由美国ABR公司提供。实验按照各试剂盒说明书进行操作。
1.5 实时荧光定量PCR检测
分别取各组肾脏组织100 mg用眼科剪剪碎,采用Trizol试剂盒提取各组肾脏组织总RNA进行逆转录,采用PCR扩增JAK基因,且扩增β-actin基因为内参。逆转录反应体系50 μl:ddH2O 14.5 μl,SYBRGreen Mix 32.5 μl,上下游引物各0.5 μl,cDNA 模板2 μl。反应程序:95℃ 预变性5 min,95℃ 变形20 s,50℃ 退火30 s,75℃ 延伸30 s,55℃ 退火30 s,70℃ 延伸45 s,35个循环。记录每个反应管中的荧光强度值(CT值),每个样本设置3个重复孔,以β-actin基因为内参,以组织中基因光密度与其对比所得值(2-△△Ct表示)为准(表1)。

Tab. 1 Primers sequences of JAK2 and β-actin
1.6 免疫组织化学实验
采用SP两步法免疫组织化学检测法。制作石蜡切片,切片脱蜡至水;用3%H2O2去离子水孵育切片10 min;加复合消化液消化10 min;滴加一抗(1∶100,兔抗人JAK2抗体;1∶200,兔抗人TGF-β1抗体),4℃孵育24 h;滴加HRP标记的二抗(羊抗兔IgG),37℃孵育30 min;DAB 显色;脱水,透明,封固。以PBS代替一抗作为阴性对照。对切片用计算机图像分析系统进行定量分析。各组肾脏组织切片随机选片5张,每一例组织切片选择5个高倍视野照片(×400)进行测定,取平均值,分别测定肾脏组织JAK2和TGF-β1免疫反应阳性表达的积分吸光度(A)。
1.7 Western blot蛋白印迹检测
称取100 mg大鼠肾皮质组织,加入预冷的蛋白质抽提试剂,匀浆充分,离心(4℃, 12 000 r/min×15 min),收集上清液。取上清液经SDS-PAGE电泳后转膜至PVDF膜,5%的BSA溶液封闭2 h,加入JAK2一抗(1∶1 000)、TGF-β1一抗(1∶500),4℃孵育过夜,加入HRP标记的二抗,室温孵育1 h。洗膜充分后曝光、显影、定影、扫描。用Image J软件对蛋白条带进行定量分析。
1.8 统计学处理
2 结果
2.1 大鼠血糖、24 h 尿蛋白定量、Scr、BUN的变化
与NC组相比,DC组的血糖、24 h 尿蛋白定量、Scr、BUN均明显升高(P<0.05);DE、DR和DER组的血糖、24 h 尿蛋白定量、Scr、BUN均较DC组明显降低(P<0.05);且DER组的下降更显著,与DE、DR组相比差异有显著性(P<0.05, 表2)。
Tab. 2 Changes of blood glucose, 24 h UA, Scr, BUN n=10)
2.2 肾组织形态结构的HE染色结果
光学显微镜下显示,NC组的肾脏形态结构正常,肾小球清晰,大小正常,球囊壁光滑,毛细血管袢开放,肾小管细胞排列整齐(图1A);DC组显示肾小球体积明显增大,较多球囊壁粘连和毛细血管袢塌陷,肾小管细胞肿胀明显(图1B);DE组和DR组显示肾小球体积增大,少数球囊壁粘连和毛细血管袢塌陷,部分肾小管细胞肿胀,但DE组和DR组肾脏形态差异不明显(图1C、图1D);DER组可见肾小球清晰,体积增大不明显,球囊壁较光滑,毛细血管袢开放,肾小管细胞排列基本整齐,明显优于DE组和DR组(图1E)。
2.3 肾脏JAK2 mRNA表达的变化
实时荧光定量PCR检测结果显示,DC组肾脏JAK2 mRNA表达较NC组明显上调(P<0.05);与DC组比较,DE、DR和DER组的肾脏JAK2 mRNA表达明显下调(P<0.05),且DER组的下调更显著,与DE、DR组相比差异有显著性(P<0.05,表3)。
2.4 肾组织JAK2和TGF-β1 Western blot检测结果
Western blot检测结果显示,DC组肾组织JAK2和TGF-β1蛋白相对表达量均较NC组明显增加(P<0.05);与DC组比较,DE、DR和DER组肾组织JAK2和TGF-β1蛋白相对表达量均显著降低(P< 0.05),且DER组的降低更显著,与DE、DR组相比差异有显著性(P<0.05,图2,表3)。
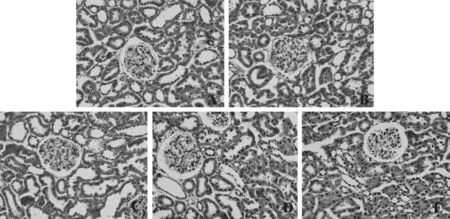
Fig. 1 Results of HE staining in kidney (×400)
Tab. 3 Expression changes of JAK2 mRNA, JAK2 and TGF-β1 in kidney n=8)

Fig. 2 Expression changes of JAK2 and TGF-β1 in kidney
2.5 肾组织JAK2免疫组织化学观察
NC组肾组织中JAK2免疫反应阳性呈棕黄色,主要分布在肾小球和肾小管上皮细胞(图3A);DC组肾组织免疫反应阳性细胞非常丰富,免疫反应活性非常强,大量的棕黄色阳性表达分布于肾小球和肾小管(图3B);DE组和DR组肾组织免疫反应活性较强,较多的棕黄色阳性表达分布于肾小球和肾小管(图3C、图3D);DER组肾组织免疫反应活性减弱,上皮细胞棕黄色阳性表达减少,明显低于DE组和DR组(图3E)。
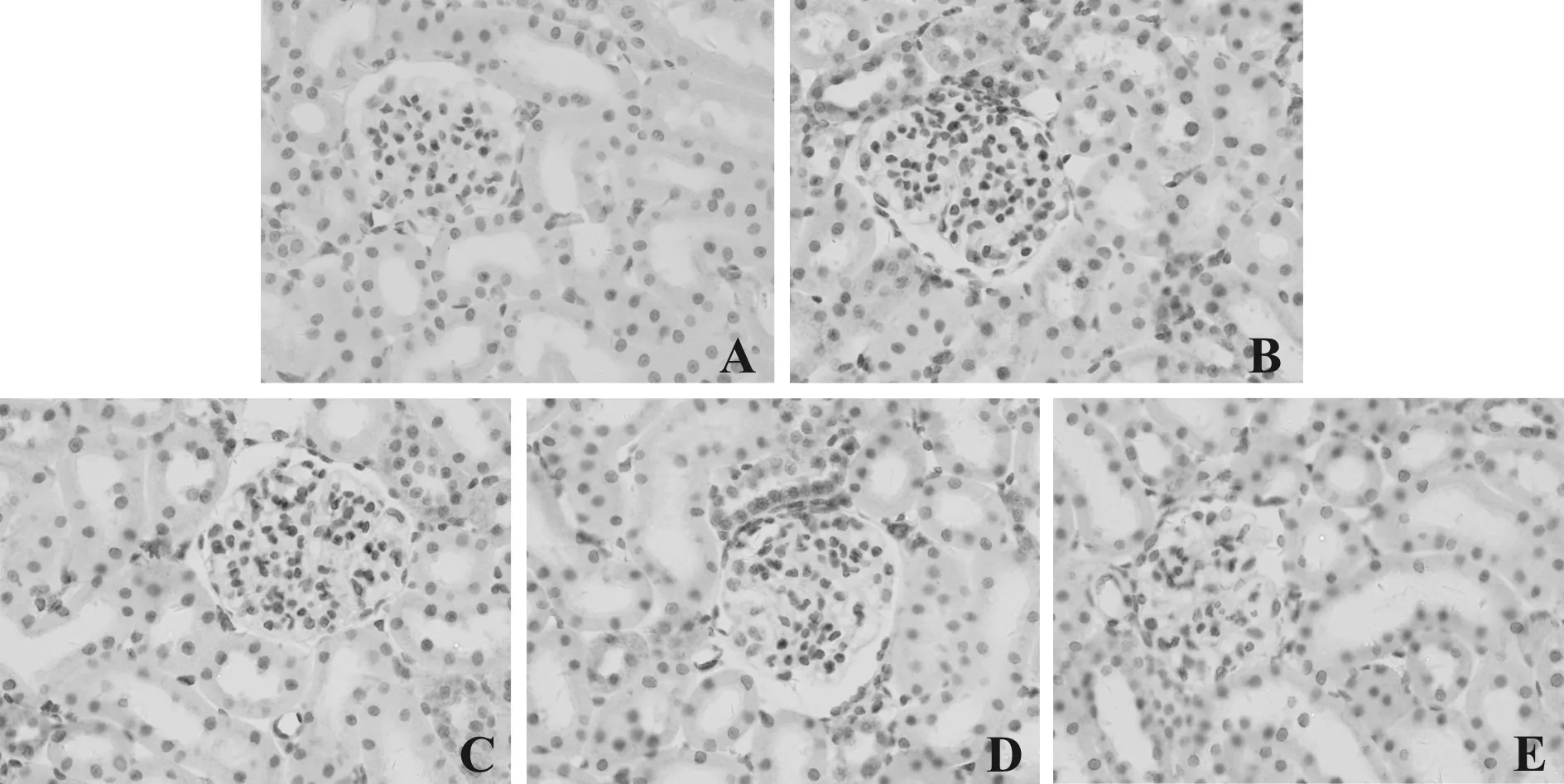
Fig. 3 Results of JAK2 immunoreactivity in kidney (×400)
2.6 肾组织TGF-β1免疫组织化学观察
NC组肾组织中TGF-β1免疫反应阳性表达呈棕黄色,主要分布在肾小管上皮细胞的细胞浆(图4A);DC组肾组织免疫反应活性明显增强,可见大量的棕黄色阳性表达分布于肾小管上皮细胞(图4B);DE组和DR组肾组织免疫反应活性较强,可见一定量的棕黄色阳性表达分布于肾小管(图4C、图4D); DER组肾组织免疫反应活性减弱,上皮细胞棕黄色阳性表达减少,明显低于DE组和DR组(图4E)。

Fig. 4 Results of TGF-β1 immunoreactivity in kidney (×400)
3 讨论
2型糖尿病的发生和发展具有非常复杂的机制,目前尚未完全阐明。血糖、24 h UA、Scr、BUN等指标在临床研究作为糖尿病早期肾脏病变的标准,反映肾脏结构及功能的损伤程度[8,9]。本研究结果表明,DC组大鼠血糖浓度、24 h UA、Scr、BUN含量均较NC组明显升高;HE染色结果显示DC组肾小球体积增大,部分球囊壁粘连,部分毛细血管袢塌陷,肾小管细胞出现肿胀,从组织形态学方面佐证糖尿病大鼠出现肾脏形态结构的损伤。表明5周高糖高脂饮食喂养加STZ腹腔注射诱发大鼠糖尿病,在干预前大鼠肾脏功能已出现特征性病变。
本研究中分别采用8周有氧运动与白藜芦醇灌胃给药,DE、DR和DER组血糖浓度、24 h UA、Scr、BUN含量均较DC组显著下降。同时光镜示DE、DR和DER组肾组织病理损伤较DC组明显减轻,且DER组肾组织形态结构明显优于DE组和DR组。提示有氧运动与白藜芦醇两种干预方式均能降低2型糖尿病大鼠的血糖水平,减少肾脏蛋白尿的排出,减轻肾脏病理损伤,且运动与白藜芦醇联合干预的治疗方式优于单纯运动和单纯给药。
近年来,JAK/STAT信号通路在肾脏疾病中的调控作用受到广泛关注,研究证实该通路与多种肾脏疾病中的足细胞、系膜细胞、肾小管上皮细胞及间质炎症细胞的改变关系密切[10-12]。其中JAK2作为该信号通路的重要成员,广泛存在于各种组织和细胞,与STATs发生作用,介导多种细胞因子和生长因子的胞内信号转导通路过程,使相应靶基因活化,产生多种生物学效应[13]。研究显示,某些中草药可通过作用于JAK/STAT信号通路,起到延缓糖尿病大鼠肾脏损伤进展的作用。王金晶等[14]研究藕节对糖尿病大鼠肾组织JAK2/STAT3信号通路的影响,发现糖尿病大鼠肾脏组织JAK2表达明显升高,而藕节通过抑制肾脏组织JAK2蛋白表达,使糖尿病肾脏损伤得以改善。宋纯东等[15]研究表明JAK2/STAT3信号通路可能参与糖尿病肾脏损伤的发病过程,益肾活血方可能通过调节肾脏组织异常JAK2蛋白的表达,使糖尿病大鼠的炎症反应减轻,对肾脏有一定保护作用。
目前研究发现JAK/STAT信号通路激活与转化生长因子(transforming growth factor-β1, TGF-β1)表达有关。TGF-β1是一种具有多种生物学功能的信号传递分子,能够促进众多蛋白的表达增加,对细胞外基质分泌起到重要的调节作用,是造成糖尿病肾脏损伤的重要致病因子[16,17]。研究表明高糖和AngⅡ可激活肾小球系膜细胞内的信号转导途径,进一步激活JAK/STAT信号通路,增加原癌基因c-jun和c-fos的表达,形成的二聚体可以激活TGF-β1基因启动子,促使TGF-β1的产生增加。TGF-β1具有很强的致纤维能力,能加速肾脏细胞肥大,使成纤维细胞增生并产生更多纤维粘连蛋白[18,19]。研究证实通过阻断JAK/STAT信号通路,可以显著抑制TGF-β1、ICAM-1和MCP-1等蛋白的合成,改善胰岛素抵抗,从而改善糖尿病肾损伤[20]。
本研究结果显示DC组肾组织TGF-β1、JAK2和JAK2 mRNA的表达均较NC组明显增加。分别施与有氧运动与白藜芦醇干预,DE、DR和DER组肾组织TGF-β1、JAK2和JAK2 mRNA的表达均显著降低,且DER组的降低更显著。提示有氧运动、白藜芦醇单独或联合干预均可能通过下调肾脏JAK2 mRNA表达,减少JAK2和TGF-β1蛋白的合成,减轻糖尿病大鼠肾脏病理损伤,且有氧运动联合白藜芦醇干预效果优于单一的有氧运动或白藜芦醇干预。其机制可能是有氧运动、白藜芦醇及联合干预可通过增加肾脏的血流量,使机体糖的合成代谢增加,显著降低糖尿病的高血糖。同时,运动与药物干预可以抑制高血糖激活的JAK/STAT信号通路,下调肾脏JAK2 mRNA表达,抑制JAK2蛋白的合成,使下游TGF-β1等细胞因子的合成减少,从而抑制系膜细胞外基质蛋白的合成,减少肾脏细胞外基质的沉积和肾小管间质纤维化,最终减轻糖尿病肾损伤的病理变化,发挥肾脏保护作用。

